大鼠shRNA-TRPC4重组腺病毒载体的构建及其在EPCs中转染效率的测定*
2018-08-02林慕之刘兴德刘姿麟刘志琴况春燕
林慕之,刘兴德,张 璐,刘姿麟,刘志琴,况春燕△
(1.贵州医科大学附属人民医院/贵州省人民医院心内科,贵阳 550002;2.贵州医科大学附属医院心内科,贵阳 550004)
冠状动脉粥样硬化性心脏病(冠心病)、高血压等疾病发病的共同环节是血管内皮的损伤和损伤后的不良修复,因此,防治此类疾病的关键是尽早促进损伤血管内皮的修复。1997年ASAHARA等[1]首次分离出的内皮祖细胞(endothelial progenitor cells,EPCs),其可分化为成熟的内皮细胞从而促进血管内皮的修复[2]。瞬时感受器电位(transient receptor potential,TRP)通道是阳离子通道的一个超家族,广泛分布于多种细胞,并在功能调节中起重要作用[3],主要充当钙内流孔道促使胞外钙内流[4]。瞬时感受器电位C离子通道(transient receptor potential canonical channel,TRPC)是一个重要亚家族[5]。研究表明TRPC在平滑肌细胞中对细胞增殖和收缩功能起重要作用[6-7]。TRPC亚家族包含7个成员,分别为TRPC1~7,其中TRPC4参与血管紧张性和渗透性的调节[8],并可以调控血管再生[9]、内皮细胞增殖和凋亡[10]。EPCs作为内皮细胞的前体细胞,TRPC4是否参与其生物学功能的调节目前仍未阐明。为研究TRPC4对EPCs生物学功能的影响,本研究构建大鼠TRPC4的重组腺病毒干扰质粒并观察其在EPCs中的转染效率,现报道如下。
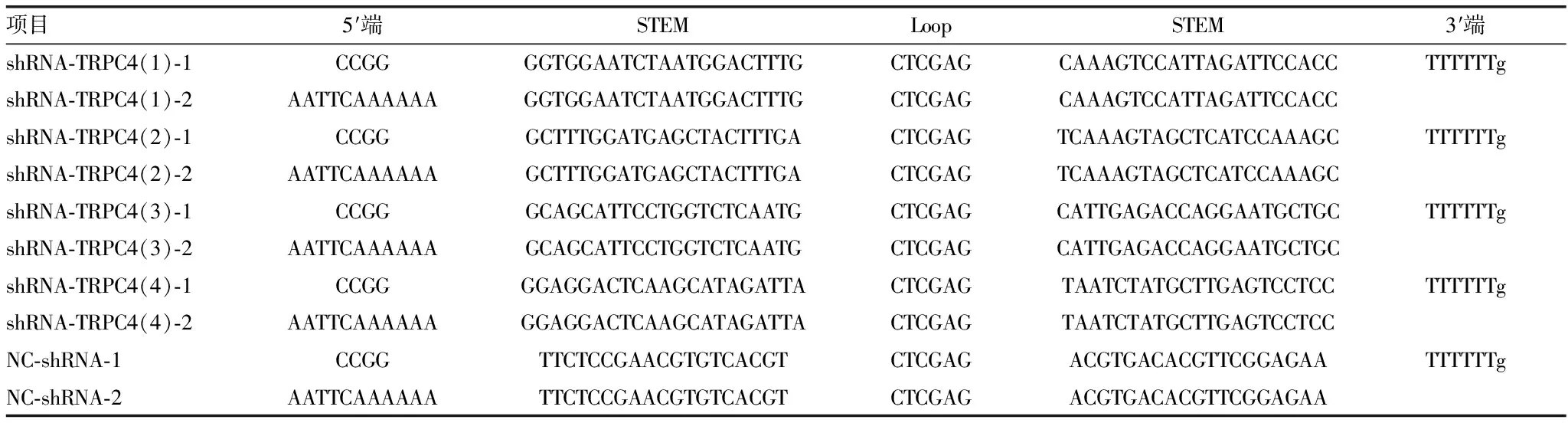
表1 DNA Oligo片段及阴性对照
1 材料与方法
1.1材料
1.1.1动物和试剂 清洁级(170±20)g SD大鼠购于贵州医科大学动物实验中心;pDK-CMV-GFP-U6-shRNA载体、限制性内切酶AgeⅠ和 EcoRⅠ购于纽恩(上海)生物科技有限公司;HEK293细胞购于上海和元生物技术有限公司;大鼠组织淋巴细胞分离液购于天津灏洋生物生物制品科技有限公司;小抽试剂盒购于Promega公司;4 DNA ligase和内切酶购于NEB公司;Taq酶和dNTP DH5α感受态细胞、琼脂糖凝胶DNA回收试剂盒均购自Takara公司;引物由上海英骏生物技术有限公司合成;华大基因进行阳性克隆测序。
1.1.2仪器 DNA电泳槽、稳压电泳仪(北京六一仪器厂);电热恒温水槽(上海一恒科学仪器有限公司);凝胶成像仪(上海天能科技有限公司);恒温培养箱(上海精宏实验设备有限公司);恒温摇床(太仓市实验设备厂);PCR仪(Applied Biosystems公司);冷冻高速离心机(Thermo公司);移液器(Eppendorf公司)。
1.2方法
1.2.1TRPC4腺病毒穿梭质粒构建 从GenBank中查询大鼠TRPC4基因(NM_001083115)上下游序列设计并合成4对siRNA前体寡核苷酸片段,siTRPC4-1:GGT GGA ATC TAA TGG ACT TTG;siTRPC4-2:GCT TTG GAT GAG CTA CTT TGA;siTRPC4-3:GCA GCA TTC CTG GTC TCA ATG;siTRPC4-4:GGA GGA CTC AAG CAT AGA TTA。设阴性对照NC序列:TTC TCC GAA CGT GTC ACG T,合成DNA双链Oligo片段,见表1。将得到的DNA oligo片段加水溶解至40 μmol/L。在退火体系中加入溶解好的正反义DNA oligo片段各18 μL,10×Buffer 4 μL,混匀后置于95 ℃水浴,10 min 后取出置于室温,使之自然冷却。取pDK-CMV-GFP-U6-shRNA载体经AgeⅠ和EcoRⅠ酶切使载体线性化。然后将双链DNA连接入酶切载体后转化入大肠杆菌DH5α感受态细胞,于恒温培养箱中培养16 h。
1.2.2PCR阳性克隆鉴定及测序对比 挑取平板上长出的转化子进行菌落PCR鉴定。正向引物:5′-CCT ATT TCC CAT GAT TCC TTC ATA-3′, 反向引物:5′-GTA ATA CGG TTA TCC ACG CG-3′。将菌落鉴定得到的阳性克隆进行测序验证,通过Chromas测序软件分析设计的4对穿梭质粒是否与设计的4对干扰靶点序列一致。
1.2.3腺病毒包装 利用Admax系统,选取目的穿梭质粒shRNA-TRPC4(1)与腺病毒骨架质粒共转染到HEK293细胞中获得重组腺病毒。将HEK293细胞接种到6孔板中,控制细胞转染时的密度为70%~80%。转染前1 h去除原有细胞培养基,加入1.5 mL的Opti-MEM培养基。将待转染的病毒载体质粒4 μg(骨架质粒∶穿梭质粒=1∶1)溶于Opti-MEM培养基,总体积为250 μL,混匀。将8 μL和腺病毒包装转染试剂溶于Opti-MEM培养基,总体积为250 μL,混匀。将腺病毒包装转染试剂稀释液滴加到质粒稀释液中,边加边轻轻混匀,室温静置20 min,使DNA和转染试剂充分结合形成稳定的转染复合体。将配好的DNA-转染试剂复合体加入到细胞培养板中。6 h后吸去培养基,磷酸盐缓冲液(PBS)洗1次,加入2 mL新鲜完全培养基培养。每72小时补液1次,约7~15 d病毒空斑出现,完全病变后,收集上清液。经包装后的shRNA-TRPC4腺病毒质粒命名为Ad-shRNA-TRPC4。
1.2.4腺病毒扩增 将HEK293细胞铺在10 cm培养皿中,待细胞长到90%以上汇合度,加入合适滴度的病毒1 000 μL,感染细胞,待5~6 d全部病变后,收取病毒,并反复冻融细胞3次,分装。
1.2.5病毒滴度测定 选取状态良好的HEK293细胞,接种至24孔板中,每孔种入5.0×105个细胞后常规培养。依次将10-5至10-8稀释的病毒液加入24孔板中,每孔加入100 μL,感染48 h。经免疫组织化学后,在24孔板每孔选择5个视野,在光学显微镜10×物镜下观察并计数阳性细胞个数,计算每个孔阳性细胞平均个数及病毒滴度。根据公式病毒滴度(ifu/mL)=(平均视野阳性细胞个数×每孔视野的个数×稀释倍数)/0.1 mL可计算病毒滴度。
1.2.6Western blot检测Ad-shRNA-TRPC4有效靶点干扰情况 因TRPC4过表达腺病毒载体包含有Flag基因,因此将293T细胞接种24孔板后,用过表达腺病毒载体和各组干扰质粒共转染,48 h后收集细胞提取蛋白样品,用Western blot鉴定已构建的Ad-shRNA-TRPC4是否有效减弱Flag基因的蛋白水平。
1.2.7大鼠EPCs的培养 参照文献[11],使用密度梯度离心法分离大鼠骨髓单个核细胞并加入Hyclone的含20%胎牛血清及双抗的DMEM-L培养基培养,48 h换液,细胞贴壁生长待密度长至70%时备用。
1.2.8Ad-shRNA-TRPC4质粒转染EPCs 转染前将EPCs密度调整至70%左右,先用基础培养液将细胞换液3次,然后用不含血清和双抗的DMEM-L培养液将Ad-shRNA-TRPC4的病毒液稀释后进行转染。4 h后加入新鲜的含20%胎牛血清及双抗的DMEM-L培养基,48 h可在荧光倒置显微镜下观察细胞转染状况并照相,观察绿色荧光的细胞占所有细胞的百分比,计算出细胞转染效率,转染效率=视野可见的绿色荧光细胞数/总细胞数×100%。因Ad-shRNA-TRPC4带绿色荧光蛋白(GFP),用流式细胞仪检测带GFP的细胞(即示转染上Ad-shRNA-TRPC4的细胞)所占比例。
2 结 果
2.1PCR阳性克隆鉴定 用PCR鉴定4组干扰质粒,每组培养后挑取10个转化子,shRNA-TRPC4(1)组1~5、7~10号转化子为阳性克隆,shRNA-TRPC4(2)组1~6、8号转化子为阳性克隆,shRNA-TRPC4(3)组1~6、8~9号转化子为阳性克隆,shRNA-TRPC4(4)组1~6、8~10号转化子为阳性克隆。阳性克隆得到343 bp的片段,阴性对照条带得到307 bp的片段,见图1。
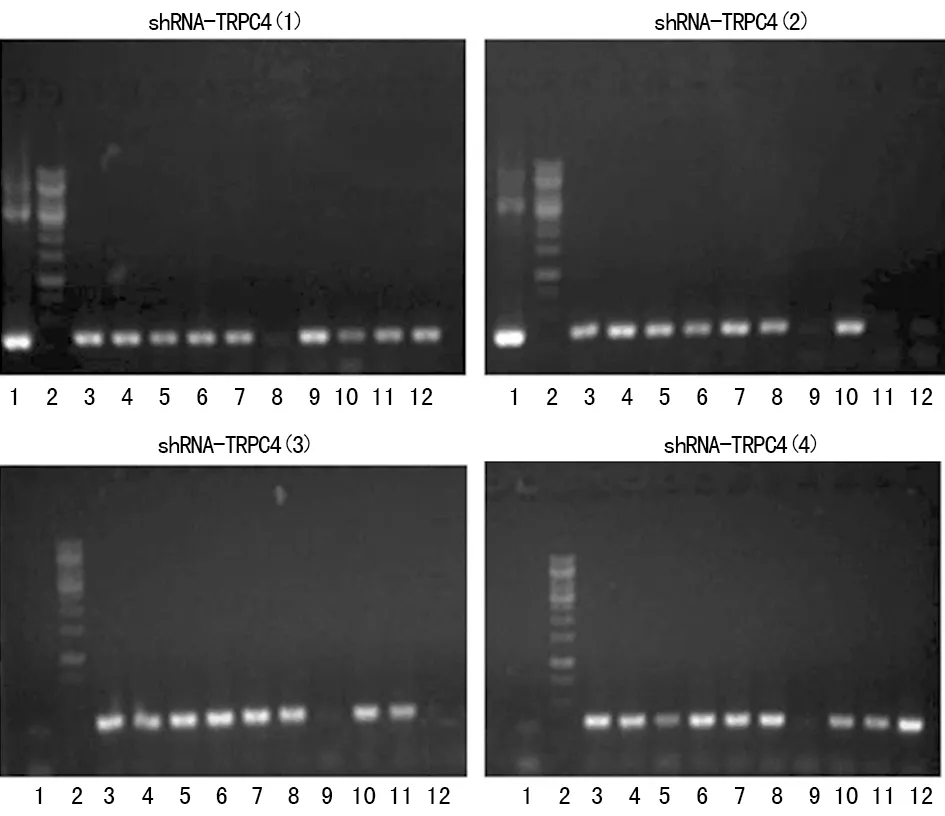
2.2RNA干扰(RNA interference,RNAi)测序验证 挑取阳性克隆进行测序,通过测序软件Chromas分析,所插入的4对shRNA与设计序列完全一致,说明4对目的穿梭质粒shRNA-TRPC4(1)、shRNA-TRPC4(2)、shRNA-TRPC4(3)、shRNA-TRPC4(4)构建成功,见图2。
1:阴性对照(空载体质粒);2:DNA Marker,从上到下的方向依次为2 000、1 000、750、500、250、100 bp;3~12:挑取的10个转化子
图1菌落PCR鉴定
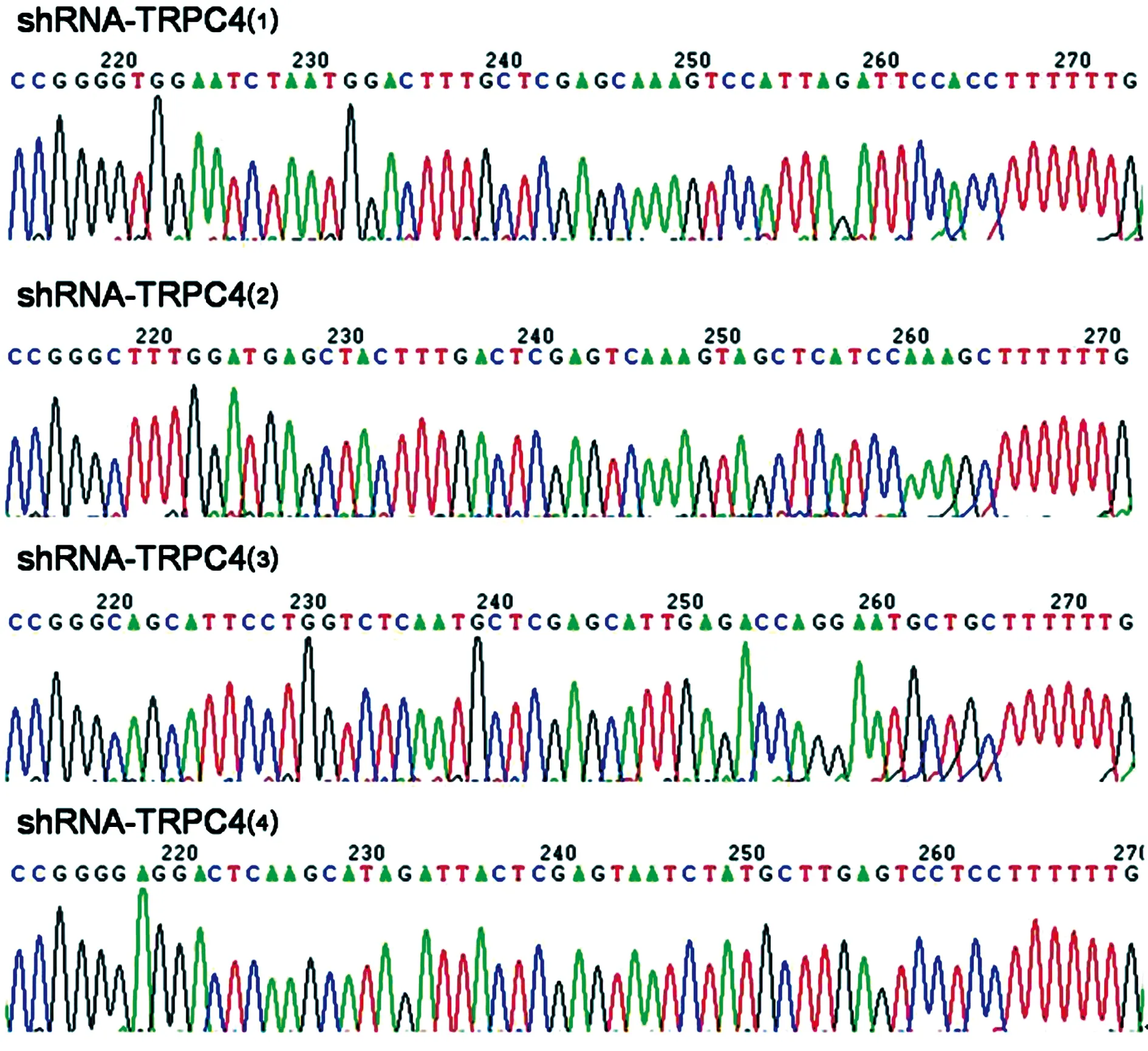
图2 shRNA-TRPC4穿梭质粒测序结果
2.3病毒包装 选取测序正确的shRNA-TRPC4(1)和骨架质粒共转染HEK293细胞,转染11 d后观察,HEK293细胞已大量飘落,细胞基本呈绿色,此时可收集细胞进行病毒贮藏,获得TRPC4重组腺病毒载体Ad-shRNA-TRPC4,见图3。
2.4病毒滴度 显微镜下5个视野中计算的阳性细胞平均数为7个,此孔病毒稀释了107倍,得出病毒滴度为5×1010ifu/mL。
2.5各质粒转染293T细胞的Flag基因的表达 shRNA-TRPC4(1)、shRNA-TRPC4(2)、shRNA-TRPC4(3)、shRNA-TRPC4(4)组Flag蛋白的表达与对照组TRPC4过表达腺病毒载体组比较完全缺如,说明shRNA-TRPC4(1)、shRNA-TRPC4(2)、shRNA-TRPC4(3)、shRNA-TRPC4(4)明显抑制293T细胞中TRPC4基因的表达。
A:转染2 d后HEK293细胞;B:转染7 d后HEK293细胞;C:转染11 d后HEK293细胞
图3荧光显微镜下转染后的HEK293细胞(×100)
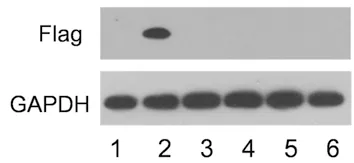
1:293T阴性对照细胞样品;2:TRPC4过表达腺病毒载体转染293T样品;3~6:shRNA-TRPC4(1)、(2)、(3)、(4)分别与TRPC4过表达腺病毒载体共转染293T细胞样品
图4 Flag在293T细胞中的表达
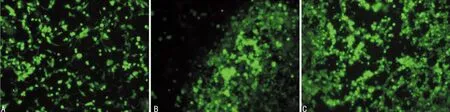
2.6Ad-shRNA-TRPC4转染EPCs 用Ad-shRNA-TRPC4(1)转染EPCs 48 h后,在倒置荧光显微镜下观察,转染效率为(85.47±2.05)%,见图5。用流式细胞仪测定带GFP的细胞占总细胞的比值,Ad-shRNA-TRPC4转染EPCs效率为(67.27±2.94)%,见图6。
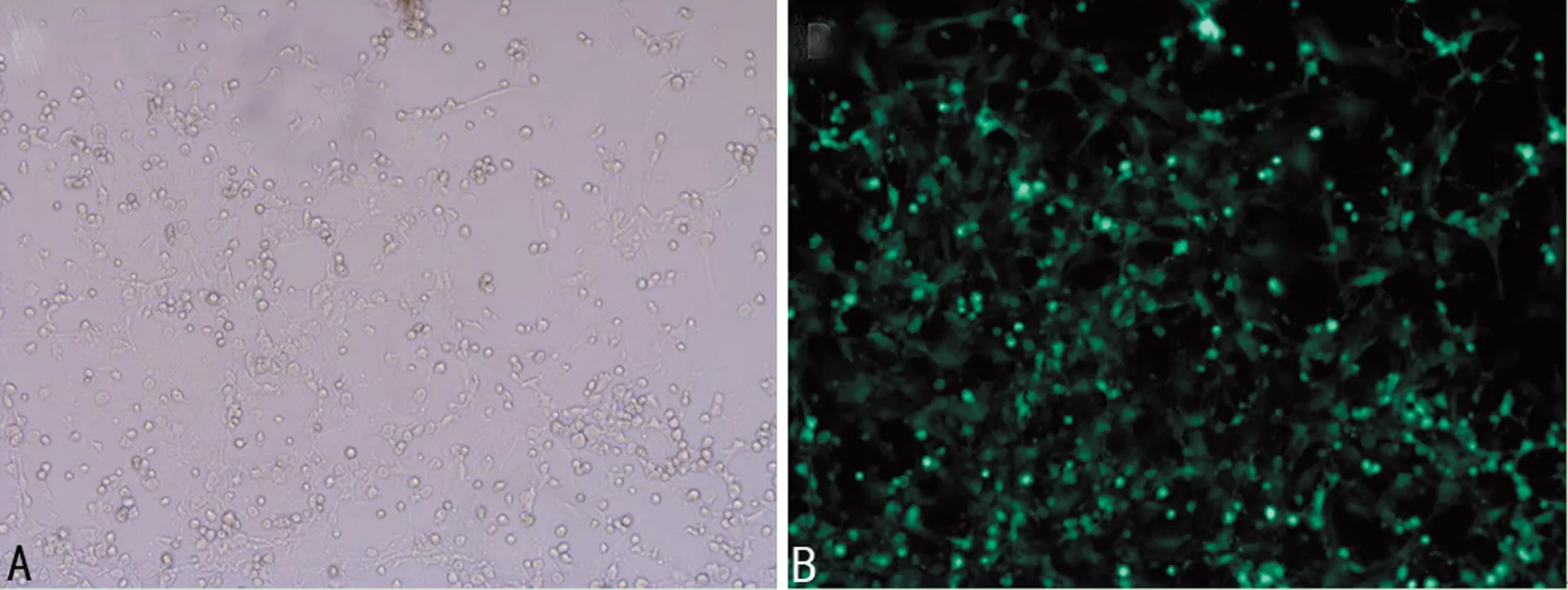
A:转染48 h后白光下EPCs;B:转染48 h后荧光显微镜下EPCs
图5 Ad-shRNA-TRPC4转染EPCs的代表图(×100)
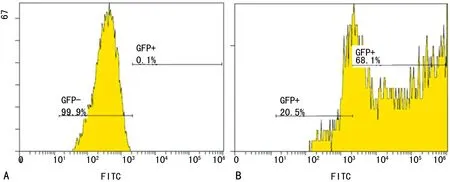
A:未经Ad-shRNA-TRPC4转染的EPCs;B:经Ad-shRNA-TRPC4转染的EPCs
图6流式细胞仪测定带GFP的EPCs细胞水平的代表图
3 讨 论
本研究有两个重要成果:(1)成功构建TRPC4的shRNA质粒,并进行腺病毒包装,为后续的细胞实验及动物模型实验提供研究基础;(2)用构建的Ad-shRNA-TRPC4成功转染体外培养的EPCs,并得到高效率的转染,为后续实验提供保障。
血管内皮损伤是动脉粥样硬化、高血压等疾病发病的共同环节。血管损伤时,EPCs可从骨髓激活并特异性迁移至损伤血管部位,分化为成熟的内皮细胞,促进损伤血管内皮的修复[12]。钙离子是细胞重要的第二信使,参与了细胞的增殖、分化、迁移和细胞因子分泌等多种功能的调控[13],而TRP通道则参与了作为胞外钙内流途径之一的钙库操纵性钙通道孔径的构成。最新研究表明,TRPC4作为TRP通道的重要成员之一,在心血管系统疾病的发生、发展中发挥了重要作用[14],TRPC4对内皮细胞的功能有重要影响[15],但TRPC4对内皮细胞的前体细胞EPCs是否有生物学功能影响目前仍不清楚。为完成上述研究,本课题组需沉默TRPC4基因在EPCs的表达,观察其对EPCs生物学行为影响。目前用于沉默基因表达的常用方法如下:(1)复制基因敲除的动物;(2)构建基因干扰质粒包括siRNA和shRNA干扰质粒。本研究通过RNAi的方法构建沉默大鼠TRPC4基因表达的重组腺病毒载体。RNAi是由内、外源性双链RNA介导的多步骤、多因子参与的过程,可使细胞内mRNA发生特异性降解,导致目的基因有效沉默或抑制[16]。研究表明,siRNA介导的RNAi干扰默靶基因表达的效率低,而shRNA介导的RNAi可以稳定地抑制目的基因的表达,且比化学合成siRNA有更低的成本。目前用于包装质粒的病毒有慢病毒、腺病毒、腺相关病毒及反转录病毒,本实验选择腺病毒作为病毒载体,该病毒宿主范围广,基因组信息清楚,易操作,容易获得高滴度,瞬间表达,安全性较高,可感染多种人类细胞。目前较为成熟的载体系统有非复制型(如AdMax)和复制型(又叫溶瘤腺病毒)两种。本课题组选择Admax包装系统,此系统主要利用Cre/loxP(或FLP/frt)重组酶将携带外源基因的穿梭质粒与骨架质粒在HEK293细胞中重组,产生重组腺病毒[17]。
综上所述,本实验成功构建了shRNA-TRPC4重组病毒载体,实现了高效干扰EPCs中TRPC4表达的目的,为后续研究基因沉默大鼠TRPC4表达对EPCs的生物学功能有何影响奠定了基础,有助于进一步探索血管损伤后内皮的再生机制。
