葛黄颗粒含药血清对乙醇诱导L-02肝细胞损伤的保护作用及其机制研究*
2018-08-02陈柚伶仁德芳王洪连王晓栋
付 裕,郎 涵,陈柚伶,仁德芳,王洪连,魏 嵋,王晓栋,李 志
(1.西南医科大学中西医结合学院,四川泸州 646000;2.西南医科大学附属中医医院脾胃科,四川泸州 646000;3.西南医科大学附属中医医院中西医结合防治器官纤维化实验室及中西医结合研究中心,四川泸州 646000;4.西南医科大学附属中医医院肝胆内科,四川泸州 646000)
酒精性肝病(ALD)是我国常见的肝脏疾病之一,是长期大量饮酒所导致的一类疾病,严重危害人民身体健康。近年来ALD发病率越来越高。肝细胞凋亡在各种肝脏疾病中常常出现,其中Fas/Fas 配体(Fas Ligand,FasL)通路是当前最重要的一条主导途径,发挥十分关键的作用。许多资料表明,在非酒精性脂肪性肝病的发展中Fas/FasL途径有着极其重要的影响,然而其在酒精性肝损伤的进程中所具有的影响和机制尚未阐明[1-3]。目前ALD的治疗方法及药物较少,研发治疗ALD的新药是亟待解决的问题。本研究采用的实验模型是乙醇诱导的L-02肝细胞损伤模型,研究中应用葛黄颗粒含药血清来进行系列干预,并研究和分析Fas/FasL系统及其相关基因表达的情况,以期发现葛黄颗粒防治ALD的分子机制。
1 材料与方法
1.1材料
1.1.1实验动物与细胞系 健康雄性SD大鼠共60只,质量180~220 g,由西南医科大学实验动物中心提供。人正常肝细胞L-02,由西南医科大学附属中医医院中西医结合研究中心提供。
1.1.2药物 葛黄颗粒药物构成:葛花、柴胡、赶黄草、虎杖、丹参、枳椇子等。将原生药制作成深褐色流浸膏以利于灌胃,2 g原生药可制作成1 mL流浸膏。由西南医科大学附属中医医院制剂室提供。生产批号20150504。美他多辛片,由山东齐都药业有限公司生产,规格每片0.5 g。生产批号1402002。
1.1.3试剂 RPMI-1640购自美国Hyclone公司;CCK8购自同仁化学研究所;天门冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)及细胞凋亡试剂盒均购自南京建成生物工程研究所;反转录试剂盒(RevertTra Ace qPCR RT Master Mix)购自日本 Tokoyo公司。Fas引物:上游5′-ATAAGCCCTGTCCTCCAGGT-3′,下游5′-GTTGCTGGTGAGTGTGCATTT-3′;FasL引物:上游5′-AGAGAGGGAACCACAGCACA-3′,下游5′-TGCCAGCTCCTTCTGTAGGT-3′;caspase8引物:上游5′-TCTGTGCCCAAATCAACAAG-3′,下游5′-GCTCTTCAAAGGTCGTGGTC-3′;caspase3引物:上游5′-AAATGGACCTGTTGACCTGA-3′,下游5′-CACAAAGCGACTGGATGAAC-3′;内参18S:上游5′-GTAACCCGTTGAACCCCATT-3′,下游5′- CCATCCAATCGGTAGTAGCG-3′。
1.2方法
1.2.1葛黄颗粒含药血清的制备 雄性SD大鼠60只(180~220 g),喂养1周后,分为空白对照组、葛黄颗粒组及美他多辛组,3组各20只,均给予一般饲料喂养。含药血清制备给药剂量参照《动物与人体的每千克体重剂量折算系数表》及李仪奎[4]提出的相关理论,最终用药剂量为葛黄颗粒组(3.1 g·100 g-1·d-1)、美他多辛组(0.1 g·100 g-1·d-1)、空白对照组(等体积蒸馏水),每天早、晚灌胃给药各1次,连续灌胃5 d。最后一次灌胃前禁食12 h,但不禁水,在最后一次灌胃给药1 h后,采用2%戊巴比妥钠(0.3 mL·100 g-1)腹腔注射麻醉,腹主动脉取血,离心转速3 000 r/min,离心10 min后将上层血清吸取出来,同组血清合并归放,将收集的血清放置于56 ℃恒温水浴箱中灭活30 min,过滤除菌,-20 ℃保存备用。
1.2.2细胞培养 将L-02肝细胞培养在含10%胎牛血清的RPMI-1640培养液中,在37 ℃ 、5% CO2、湿度95%的培养箱中培养。
1.2.3乙醇作用浓度的确定 通过参考文献[5],将L-02肝细胞以每毫升1×105个接种于96孔板,待细胞贴壁后,更换培养液为10%胎牛血清和含不同浓度 (0、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、5.0%)乙醇的培养液,将不含乙醇组设为对照组。于6、12、24 h后,分别将96孔板中的培养基全部吸出,然后在96孔板中加入浓度为10% CCK-8的不含胎牛血清的培养基后,再分别于30 min、1、2、4 h不同时间段,将酶标仪数值设定在450 nm处检测各孔的吸光值,然后计算L-02肝细胞活力。每个小组设置5个复孔。最后根据L-02肝细胞的活力选择出最合适的乙醇浓度。
1.2.4造模时间的确定 用含0、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、5.0%不同浓度的乙醇作用于L-02肝细胞,再分别于6、12、24 h不同时间点收集L-02肝细胞上清液,最后用于测定AST、LDH水平。根据AST、LDH水平的高低,同时结合L-02肝细胞活力最终确定细胞造模的最佳时间。
1.2.5细胞模型的建立和分组 用含10%胎牛血清的RPMI-1640培养液将L-02肝细胞配制成每毫升2×105个的细胞悬液,并将其接种于6孔板中培养,待细胞贴壁生长后分为6组,正常组、模型组、葛黄颗粒低、中、高剂量组、阳性对照组,正常组加入10%正常大鼠血清,模型组在上述基础上加入3%乙醇,葛黄颗粒低、中、高剂量组分别加入3%乙醇、不同浓度(1.25%、2.5%、5%)葛黄颗粒含药血清及(8.75%、7.5%、5.0%)正常大鼠血清,阳性对照组则加入3%乙醇、5%美他多辛含药血清及5%正常大鼠血清。然后再培养24 h后,将L-02肝细胞及上清液收集用于后续指标检测。
1.2.6观察指标及方法 采用日本Olympus公司AU 2700全自动生化分析仪检测细胞上清液AST、LDH水平。流式细胞仪检测细胞凋亡,使用反转录聚合酶链反应(RT-PCR)法检测Fas、FasL、caspase3、caspase8 mRNA的表达。
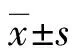
2 结 果
2.1乙醇作用浓度的确定 当乙醇浓度为3.0%时,各时间点的细胞活力均大于75%(P<0.05),镜下观察肝细胞体积稍增大,悬浮的细胞较对照组增多。见表1。
2.2乙醇作用时间的确定 当乙醇浓度为3.0%时,作用时间为24 h时AST、LDH水平最高(P<0.05)。见表2。
2.3乙醇诱导L-02肝细胞损伤模型的建立 模型组镜下显示,用含浓度为3.0%乙醇的培养液培养L-02肝细胞24 h后,其L-02肝细胞体积变大,悬浮未贴壁的细胞与正常组相比增多。见图1。
2.4各组细胞上清液AST、LDH水平的比较 模型组的AST、LDH水平均较正常组显著增加,且差异有统计学意义(P<0.05)。与模型组相比,高、中、低剂量组的 AST、LDH水平均有不同程度的下降,且随着剂量越高,下降幅度越大。中、高剂量组与模型组比较差异有统计学意义(P<0.05),阳性对照组AST、LDH水平较模型组更低(P<0.05)。阳性对照组和中剂量组比较差异有统计学意义(P<0.05),阳性对照组和高剂量组比较差异无统计学意义(P>0.05)。见表3。

表1 不同浓度乙醇对L-02肝细胞6、12、24 h CCK8检测结果的影响

表2 不同浓度乙醇作用于L-02肝细胞6、12、24 h后AST、LDH水平
a:P<0.05,与乙醇浓度0%比较

A:正常组;B:模型组
图1乙醇诱导的肝细胞损伤模型(×400)

表3 各组细胞上清液AST、LDH水平的比较
a:P<0.05,与正常组比较;b:P>0.05,c:P<0.05,与模型组比较;d:P<0.05,e:P>0.05,与阳性对照组比较
2.5L-02肝细胞凋亡的比较 从肝细胞凋亡率分析,与正常组比较,模型组L-02肝细胞凋亡率明显升高,且差异有统计学意义(P<0.05)。阳性对照组和模型组相比,均明显降低,且差异有统计学意义(P<0.05)。中、高剂量组、阳性对照组L-02肝细胞凋亡率和模型组相比明显下降(P<0.05)。阳性对照组和中剂量组比较差异有统计学意义(P<0.05),阳性对照组与高剂量组比较差异无统计学意义(P>0.05)。 见图2。
2.6各组L-02肝细胞的Fas、FasL、caspase3、caspase8 mRNA表达水平的比较 模型组中Fas、FasL、caspase3、caspase8 mRNA表达水平和正常组相比,以上指标均明显升高(P<0.05)。阳性对照组和模型组相比,上述指标均明显降低,且差异有统计学意义(P<0.05);高、中、低剂量组上述指标均下降,且随剂量的高低不同呈现出正相关,中、高剂量组和模型组比较差异有统计学意义(P<0.05)。阳性对照组和中剂量组比较差异有统计学意义(P<0.05),阳性对照组和高剂量组比较差异无统计学意义(P>0.05)。见表4。

图2 流式细胞检测各组L-02肝细胞凋亡

表4 各组细胞的Fas、FasL、caspase3、caspase8 mRNA相对表达水平的比较
a:P<0.05,与正常组比较;b:P>0.05,c:P<0.05,与模型组比较;d:P<0.05,e:P>0.05,与阳性对照组比较
3 讨 论
ALD是因长期大量饮酒所引起的肝脏损害的一系列疾病。随着我国酒文化的快速发展,使ALD患者数量逐渐的上升,但是当前还缺乏较好的治疗手段,且ALD发病机制仍不明确。较多研究者认为ALD的发生可能与肝细胞凋亡有关。肝细胞凋亡是引起各种肝脏疾病及肝脏损伤的非常关键的环节,所以有效降低其凋亡发生率将有可能成为一种防治肝脏疾病的重要方法[6]。许多研究表明,细胞内及细胞外凋亡途径是引发细胞凋亡的最主要的信号转导途径[7]。NEPAL等[8]研究发现Fas/FasL系统通路是细胞外凋亡途径中引起肝细胞凋亡最关键的一环,虽然Fas/FasL通路是细胞外凋亡途径,然而可以同时通过细胞内外途径激活效应分子caspase-3,caspase-3又能激活下游的相关基因而导致细胞凋亡的发生。美他多辛片是现在临床治疗ALD的主要药物,但是具有很多的不良反应,并且价格较高,所以急需研发出治疗该病的其他药物。中药与西药相比价格低廉,不良反应少,可多途径、多靶点对机体各方面起到疗效,大量研究表明中医药在治疗ALD方面具有显著的效果[9-10]。大部分医家学者认为ALD的基本病机为肝胆不畅,以致疏泄失常。本病多因酒食无制,内损脾胃,脾胃失于运化水湿,湿浊积聚,蕴而化热,以致湿热内蕴,郁于肝胆,肝胆失于疏泄,气机内阻,继而血瘀内停,从而导致以肝脏损伤,同时波及其他多脏腑。葛黄颗粒是西南医科大学附属中医医院全国名老中医孙同郊教授在其长时间治疗ALD的经验之中整理归纳的经验方“葛黄解酒方”,主要有葛花、柴胡、赶黄草、虎杖、丹参、枳椇子等,主要功效为醒酒解毒、清热利湿、健脾疏肝。本方就是依据上述的基本病机化裁而来,在临床实际运用当中效果显著。前期动物实验已证实葛黄颗粒对ALD的防治作用[11]。本研究是基于细胞层面对其防治ALD进一步探究,这对完善其治疗依据有极为关键的作用。
本实验参考大量相关文献研究,同时结合CCK8检测的L-02肝细胞活力结果及不同时间段上清液AST、LDH水平,最终成功建立3%乙醇干预24 h诱导的体外肝细胞损伤模型。(1)当细胞损伤、凋亡或死亡时,会引起细胞膜结构的完整性受到破坏,从而造成细胞质内的AST、LDH进入到细胞外[12]。本实验结果提示葛黄颗粒含药血清具有保肝降酶的功效,且该功效和含药血清的体积比呈现正相关。(2)长时间摄入酒精,会促进肝脏、胃黏膜等细胞出现凋亡,并且在酒精性肝损伤发生发展的全过程之中,始终有肝细胞凋亡的存在[13]。本实验结果表明葛黄颗粒含药血清能有效地降低肝细胞凋亡率,且降低肝细胞凋亡率与含药血清的体积比呈正相关。(3)很多研究表明,在凋亡途径之中,死亡受体途径是一个极其关键的途径,是指配体与死亡受体结合之后造成的凋亡,而主要的配体有FasL等。Fas和配体FasL结合后,激活下游的效应分子caspase8、caspase3,引发逐级活化,最终导致细胞凋亡。本研究表明葛黄颗粒含药血清可以减少L-02肝细胞凋亡,其主要的机制或许是抑制Fas/FasL途径和其下游效应因子相关。
综上所述,葛黄颗粒含药血清能够抑制Fas/FasL途径及其下游效应因子的活化,发挥防治ALD的作用。因此,通过抑制Fas/FasL途径及其下游效应因子的活化或许是葛黄颗粒治疗ALD的重要机制之一。
