酿酒酵母菌株的筛选与发酵特性分析
2018-08-02许亚杰李华玮
张 莉,张 兰,张 玉,许亚杰,李华玮
(1.河南工业大学 生物工程学院,河南 郑州 450001; 2.河南牧业经济学院 生物工程学院,河南 郑州 450046)
酵母菌大多数为腐生,生活在含糖量较高、偏酸性的环境中。酵母是人类应用最早和较为广泛的微生物之一,利用酵母可以制作发酵食品、酿酒。随着人们对酵母菌研究的不断深入,酵母菌也逐渐被应用在环境保护、物料生产、酶制剂以及医药工业等各个方面。酿酒酵母是酿酒工业发酵最主要的菌种,是酒品质的灵魂,对酒体颜色、气味、口感的影响非常大[1]。品质优良的酿酒酵母生长速度比较快,而且在较高的糖度、酸度、酒精度或SO2浓度中也能够快速平稳地发酵。使用不同酵母菌种发酵生产的酒,其酒体质量和口感也不一样,因此,筛选优良酿酒酵母菌对于优质酒的生产具有重要意义。目前,国内大部分葡萄酒厂所使用的酵母菌大多是国外的商业酵母,此种酵母的大量使用会使葡萄酒酿造过程中本土酵母失去发酵主导地位,导致酿造出的葡萄酒风格单一,体现不出产区特色[2]。优良的本土酿酒酵母菌缺乏,在一定程度上制约了我国酿酒产业的发展,目前国内的研究者已对我国本土优质酵母菌种进行了选育工作。王志恒等[3]对宁夏玉泉营地区葡萄园土壤、葡萄果皮等中的酵母菌进行分离筛选和菌株鉴定,共鉴定出6种菌株,分别为大隐球酵母(Cryptococcusmagnus)、美极梅奇酵母(Metsclmikowiapulcherrima)、葡萄酒有孢汉生酵母(Hanseniasporavineae)、酿酒酵母(Saccharomycescerevisiae)等。杨小冲等[4]对内蒙古各旗县果园的果实和土壤中的酵母菌进行分离筛选,得到一株可耐受酒精度16% vol的酵母菌株。程仕伟等[5]对烟台本土酿酒酵母进行选育,用贵人香葡萄自然发酵醪液涂布选择性培养基筛选出优良酵母菌株YGF2,将其用于酿造霞多丽干白葡萄酒,酿造的葡萄酒质量较好,香气浓郁。对本土酿酒酵母菌种资源的研究鉴定是优良酿酒酵母菌种选种、育种、优化的基础,对保存我国优良酿酒酵母菌种资源和开发工业菌种也具有重要意义[6]。为此,对河南省本土酿酒酵母菌种进行分离筛选,并对其发酵特性进行研究,以期为本地优良酵母菌种资源研究奠定基础。
1 材料和方法
1.1 材料
酵母菌分离材料来自河南省郑州、洛阳、南阳、开封4个地区的果园土壤、果实及表皮。
PDA培养基(分离培养基):称取100 g马铃薯,切成小块煮烂,用纱布过滤,加入葡萄糖10 g、琼脂10 g,继续加热混匀,稍冷却后补水定容至500 mL,分装到三角瓶中,115 ℃灭菌25 min。
发酵培养基:称取100 g马铃薯切块,煮烂过滤,加入葡萄糖7.5 g,补水至500 mL,115 ℃灭菌25 min。
耐性基础培养基:称取100 g马铃薯切块,煮烂过滤,加入2%葡萄糖,调节pH值至7.0,115 ℃灭菌25 min。
1.2 方法
1.2.1 酿酒酵母菌的分离 采用10倍稀释法用无菌水将果园土壤、果实及表皮等样品稀释至10-4、10-5、10-6[7],分别吸取1 mL稀释液转入PDA培养基中,用涂布棒涂抹均匀,于28 ℃培养48 h,待培养基表面长出单个菌落。根据菌落大小、颜色、透明度,筛选出具有酿酒酵母菌典型菌落特征的单个菌落[8],用接种针挑取单个菌落于平板上划线分离,划线分离3次后,用显微镜观察,挑选纯菌落,然后接种在试管培养基斜面上,28 ℃条件下培养48 h后,于4 ℃保存备用。
1.2.2 酿酒酵母菌的筛选 将分离得到的酿酒酵母活化24 h后,接种于含100 g/L葡萄糖带有杜氏小管的发酵培养基中,接种量为2%,接种浓度为106个/mL(使用血球计数板计数),在28 ℃条件下发酵,以起始发酵时间、发酵速度和发酵气味为指标,筛选发酵启动时间较快、发酵速度快、发酵气味较好的菌株进行下一步耐受性试验[9]。
1.2.3 酿酒酵母菌耐受性测定
1.2.3.1 高糖耐受性 分别配制含葡萄糖100、200、300、400 g/L带有杜氏小管的耐性基础培养基,分别接种活化24 h的1.2.2中筛选的酿酒酵母菌株(使用血球计数板计数,接种量为2%,接种浓度为106个/mL)[10],恒温培养箱中培养,温度设定为28 ℃,记录发酵启动时间和发酵结束时间。在酿酒酵母菌接种之后开始记时,等到培养基内杜氏小管开始产生气泡时,记录产气的开始时间即发酵启动时间,以气泡产生时间的长短来评定酿酒酵母发酵过程的长短。下同。
1.2.3.2 高酒精耐受性 分别配制酒精体积分数10%、20%、30%、40%带有杜氏小管的耐性基础培养基,分别接种活化24 h的1.2.2筛选的酿酒酵母菌株(使用血球计数板计数,接种量为2%,接种浓度为106个/mL),在恒温培养箱中培养,温度设定为28 ℃,记录发酵启动时间和结束时间。
1.2.3.3 高酸耐受性 分别配制含柠檬酸质量浓度为5、10、15、20 g/L带有杜氏小管的耐性基础培养基,分别接种活化24 h的1.2.2中筛选的酿酒酵母菌株(使用血球计数板计数,接种量为2%,接种浓度为106个/mL),在恒温培养箱中培养,温度设定为28 ℃,记录发酵启动时间和结束时间。
1.2.3.4 高SO2耐受性 分别配制含SO2100、150、200、250 mg/L带有杜氏小管的耐性基础培养基,分别接种活化24 h的1.2.2筛选的酿酒酵母菌株(使用血球计数板计数,接种量为2%,接种浓度为106个/mL),在恒温培养箱中培养,温度设定为28 ℃,记录发酵启动时间和结束时间。
1.2.4 酿酒酵母发酵条件的优化
1.2.4.1 原料的预处理 将挑选、清洗后的苹果原料去核打浆。为防止苹果汁褐变,可在去核的过程中用SO2进行护色,同时SO2还具有杀菌、抗氧化、澄清、改善酒的风味等作用。打浆压榨后立即加入100 mg/L SO2,并搅拌均匀(SO2选用偏重亚硫酸钾,1 g偏重亚硫酸钾约含0.5 g SO2)[11]。使用SO2处理盛装苹果汁的容器。将处理过的苹果汁摇匀,对其进行过滤,之后静置澄清。由于果胶酶在低温下作用不明显,同时影响对不同苹果原料沉渣量的观测,所以在澄清过程中未使用果胶酶。
1.2.4.2 酿酒酵母发酵条件优化 将上述澄清苹果汁分别加入三角瓶中,苹果汁的量约占发酵容器的3/4,酿酒酵母接种量为200 mg/L,在不同发酵条件下测定苹果汁在发酵过程中残糖量、酒精度的变化,并通过感官评价酿酒酵母发酵性能的优劣,以确定最优发酵条件。从理论上计算,1 mol葡萄糖经过发酵之后可生成2 mol乙醇,根据苹果酒的主要生理生化指标及特性,只有酒精度达到10% vol以上,产品质量才算合格。当苹果汁糖度不够时需要加糖,但加糖量不宜过高,过高会影响成品质量。因此,在温度25 ℃、pH值4.0条件下,初始发酵糖(葡萄糖)质量浓度分别选择200、250、300 g/L进行发酵试验,以确定最优葡萄糖质量浓度。低酸性环境可以抑制有害微生物的生长,如果苹果汁的酸度不够,可能会造成细菌、霉菌等杂菌的大量生长,最后污染苹果汁,影响其发酵。酿酒酵母菌的最适pH值为4.0~5.0,因此,在温度25 ℃、葡萄糖质量浓度200 g/L条件下,选择pH值分别为3.0、4.0、5.0进行发酵试验,以确定最优pH值。酿酒酵母菌最适生长温度在28 ℃左右,故在葡萄糖质量浓度200 g/L、pH值4.0条件下,选择初始温度分别为20、25、30 ℃进行发酵试验,以确定最优温度[12]。
2 结果与分析
2.1 酿酒酵母菌株的筛选及形态特征
对从苹果园土壤、果实及表皮等分离得到的酿酒酵母,进行初步筛选,得到发酵启动时间较早、发酵速度较快、发酵气味较好的36株菌株。进一步对这36株酿酒酵母菌株进行发酵试验发现,酿酒酵母菌株Y-1、Y-2、Y-5、Y-7、F-3、F-4、F-5、F-8发酵开始后6 h杜氏小管产气泡,发酵后20 h开始大量产生气泡,24 h达到高峰,菌液浓度可以达到108个/mL,酒香味较浓,26 h发酵基本结束。说明这8株酿酒酵母菌适合进行下一步耐受性试验。
对这8株酿酒酵母菌株进行菌落和细胞形态观察发现,菌落呈白色、乳白色、淡黄色、黄色,菌体扁平或凸起,菌落大小各异,边缘整齐,挑起时粘连,多数生长速度较快,有明显或者浓郁的酒香味;细胞形态呈现圆球形、椭圆形或卵圆形,一端或两端出芽(表1)。

表1 酿酒酵母菌株的菌落和细胞形态特征
2.2 酿酒酵母菌株的耐受性
2.2.1 高糖耐受性 酿酒工业中,酒精发酵的基础是糖,但是高浓度的糖会对酿酒酵母生长产生抑制作用,影响发酵的进行。从表2可以看出,随着葡萄糖质量浓度逐渐升高,酿酒酵母发酵启动时间总体上随之延长。其中,Y-2、F-3菌株与同系列其他菌株相比总体上发酵启动时间较早、发酵速度较快,即使在300~400 g/L高葡萄糖质量浓度下也能较快的启动发酵。
2.2.2 高酒精耐受性 酒精体积分数越高,越能够抑制酿酒酵母的存活率、发酵力和增殖速度。耐酒精能力强的菌株可以发酵更加完全、彻底,从而提高酒的酒精度[13]。从表3可以看出,酒精体积分数越高,酿酒酵母发酵启动和结束时间均越晚,发酵速度越缓慢。当酒精体积分数达到14%时,菌株Y-1没有发酵产气;当酒精体积分数在12%~16%时,F-8菌株没有发酵产气;当酒精体积分数达到16% 时,菌株F-5没有发酵产气。Y-2、Y-5、Y-7、F-3、F-4菌株在较高酒精体积分数下虽然发酵启动时间晚,但仍然能够启动发酵,具有较强的高酒精耐受性。在酒精体积分数14%~16%条件下,Y-2、F-3菌株的发酵启动时间早于同系列其他菌株。
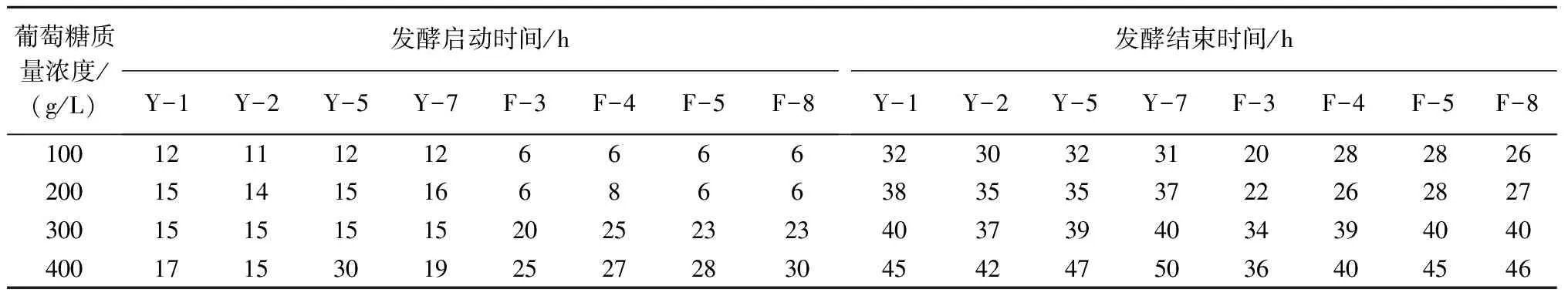
表2 葡萄糖质量浓度对不同酵母菌株发酵启动和结束时间的影响
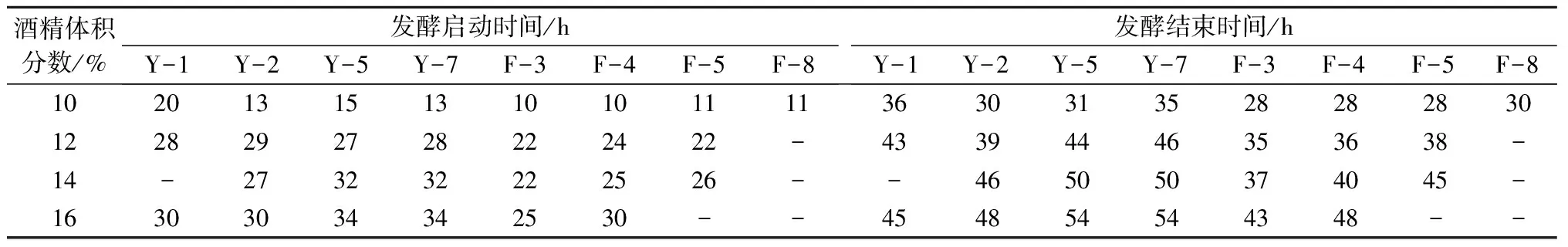
表3 酒精体积分数对不同酵母菌株发酵启动和结束时间的影响
注:-代表发酵没有产气,下同。
2.2.3 高酸耐受性 pH值是影响酵母菌株正常生长的重要因素,当pH值小于3时,平板内的酵母菌不再生长;pH值为5左右时,酵母菌生长良好;当pH值大于9时,酵母菌也不能生长[14]。从表4可以看出,酿酒酵母发酵启动和结束时间均随着柠檬酸质量浓度的增加而延长。当柠檬酸质量浓度≤10 g/L 时,Y-2、F-3菌株总体上发酵启动时间和结束时间早于同系列其他菌株。当质量浓度达到 15 g/L 及以上时,酿酒酵母菌株F-8停止发酵。当质量浓度达到20 g/L时,Y-2、Y-7能较快启动发酵,发酵结束时间也较早,酿酒酵母菌株F-4在此条件下停止发酵。
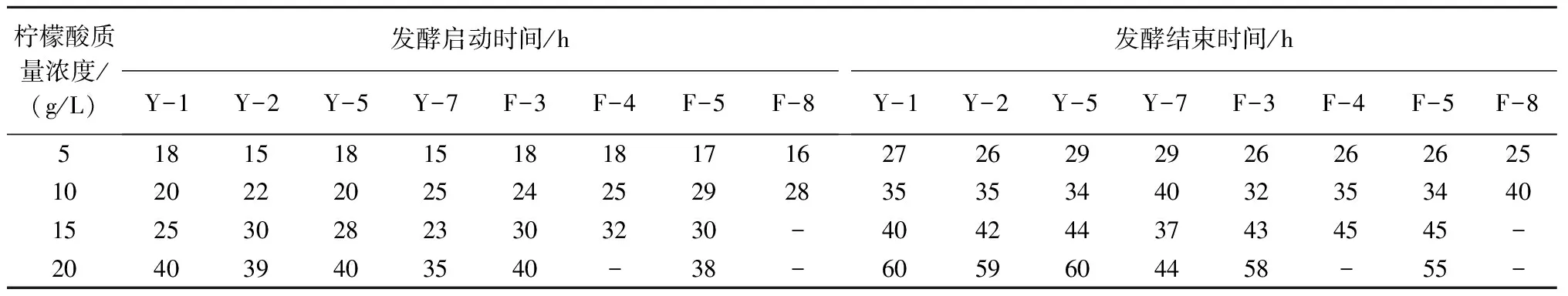
表4 柠檬酸浓度对不同酵母菌株发酵启动和结束时间的影响
2.2.4 高SO2耐受性 SO2在酿酒过程中起到重要的作用,它既可以抑制有害微生物,抗氧化,并且能加速有机酸的溶解,还有助于改善酒的风味,有利于酒体的澄清[15]。从表5可以看出,酿酒酵母发酵启动和结束时间均随着SO2质量浓度增加而延长。SO2质量浓度为100 mg/L时,酿酒酵母都能够启动发酵,但启动时间比较长;在150 mg/L 时,F-5、F-8菌株停止发酵;而250 mg/L SO2下,所有酿酒酵母菌株的发酵明显受到抑制,其中菌株Y-5、F-3、F-4、F-5、F-8停止发酵。当SO2质量浓度为100~200 mg/L时,Y-2、F-3菌株较同系列其他菌株发酵启动时间较早、发酵速度较快。

表5 SO2浓度对不同酵母菌株发酵启动和结束时间的影响
综上,对初步筛选出来的8株酿酒酵母菌株进行4个耐受性试验发现,菌株Y-2和F-3在400 g/L葡萄糖下能够快速启动发酵,同时能够耐受酒精体积分数16%、柠檬酸质量浓度20 g/L、SO2质量浓度200 mg/L。因此,可以挑选菌株Y-2和F-3作为优良酿酒酵母菌株进行下一步试验。
2.3 酿酒酵母菌株发酵条件优化
由表6可以看出,当初始温度25 ℃、葡萄糖质量浓度200 g/L、pH值 4.0时,发酵后酒精度达到10.5% vol,残糖量为5 g/L,符合果酒发酵理化指标,发酵效果比较好。当pH值过高或者过低时,发酵酒精度不达标。葡萄糖质量浓度大于250 g/L时,发酵结束后残糖量过高,果酒缺乏酒香味,口感不足。发酵温度为20 ℃时,酒精度不达标,残糖量过高,不适合酿造果酒;随着温度逐渐升高,苹果酒的酒精度也逐步升高,但当温度升高到30 ℃时,酒精度反而开始下降,并且带有异味。葡萄糖初始浓度为200 g/L时,酿造的苹果酒酒精度较高,酒香比较浓郁,酒体澄清透明;但当初始葡萄糖质量浓度过高时,酵母菌发酵起始时间延长,主发酵过后剩余糖较多,酒体稍差,而且口感微涩,有异味。
综合分析,在初始温度25 ℃、葡萄糖质量浓度200 g/L、pH值 4.0条件下,酿造的苹果酒质量比较好,酒精度高,经过滤后的苹果酒,酒体澄清透明,没有沉淀物质,酒质优,清新爽口,具有清新的果香味和浓郁的酒味。
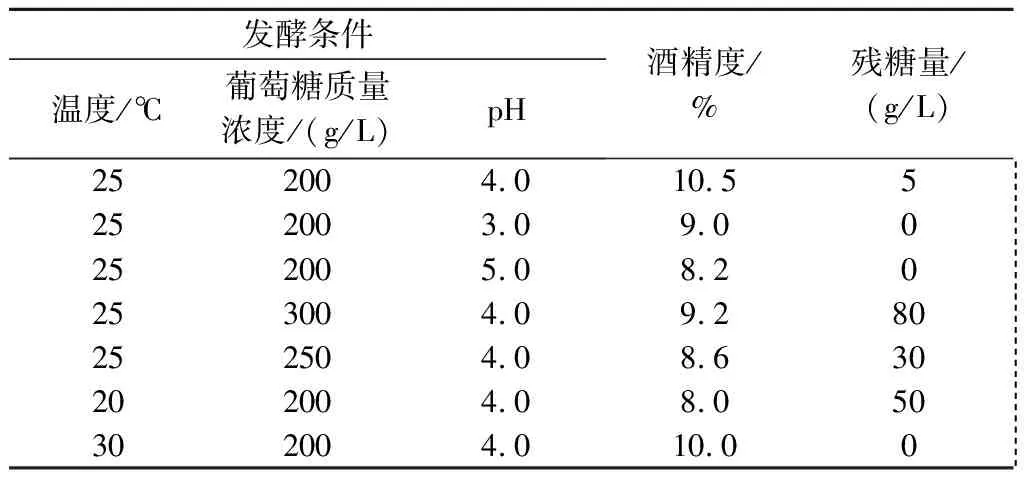
表6 主发酵结束后不同发酵条件下的酒精度与残糖量
3 结论与讨论
本研究从河南省本土果园土壤、果实及表皮等分离得到酿酒酵母,进行初步筛选,得到发酵启动时间较早、发酵速度较快、发酵气味较好的36株菌株。进一步对这36株酿酒酵母菌株进行发酵试验,获得发酵性能较优的8株酿酒酵母,对这8株酿酒酵母进行耐性试验发现,菌株Y-2和F-3在400 g/L葡萄糖下能够快速启动发酵,同时耐20 g/L柠檬酸和200 mg/L SO2。工业化葡萄酒酿造过程中酒精度一般为10% vol~13% vol[16],如果所试菌株在此酒精度范围时均能够持续发酵,说明其具有较好的酒精耐受能力。本研究筛选出酿酒酵母菌株Y-2和F-3具有较好的酒精耐受力,在酒精体积分数16%时仍能快速启动发酵。本研究对筛选出的耐受性较高的Y-2、F-3菌株进行理化指标和感官评定,确定其最优发酵条件为:葡萄糖质量浓度200 g/L、温度25 ℃、pH值4.0。菌株Y-2和F-3发酵性能优良可以作为酿酒的开发菌株。
