猪圆环病毒2型的分离鉴定及其全基因组序列分析
2018-08-02赵宝磊刘运超张改平
汪 磊,赵宝磊,冯 华,刘运超,魏 蔷,张改平*
(1.河南农业大学 牧医工程学院,河南 郑州 450002; 2.河南省农业科学院 动物免疫学重点实验室/农业部动物免疫学重点实验室,河南 郑州 450002)
猪圆环病毒(Porcine circovirus,PCV),属于圆环病毒科(Circoviride)圆环病毒属,是一种无囊膜的单股环状负链DNA病毒,是目前发现的最小的动物病毒之一[1]。猪圆环病毒是世界养猪业的重要病源之一,分为圆环病毒1型(PCV1)和圆环病毒2型(PCV2)。PCV2具有致病性,是引起仔猪断奶后多系统衰竭综合征(PMWS)的主要病原,感染该病毒后可导致猪群产生免疫抑制,造成与其他病毒如猪繁殖与呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)等病原的并发混合感染加重病情,使疾病诊断和治疗更困难[2],给养猪业造成重大的损失。
PCV病毒基因组全长 1 766~1 768 bp,PCV2含11个开放的阅读框(Open reading fame,ORF),其中ORF1、ORF2是2个重要的开放阅读框。ORF1全长904 bp,主要编码与病毒复制有关的蛋白质(Replication associated protein,Rep)。ORF2全长702 bp或705 bp,主要编码病毒衣壳蛋白(Capsid protein,Cap),Cap蛋白是病毒的结构蛋白,60个Cap蛋白组成病毒的衣壳。此外,Cap蛋白也是PCV2主要的靶抗原,具有较强免疫原性,能够诱导机体产生中和抗体,是目前猪圆环病毒新型诊断技术与基因工程疫苗研发的重要抗原,也是PCV2型疫苗研究的热点[3]。有研究表明,PCV1和PCV2的ORF1基因比较保守,同源性高达85%,氨基酸同源性在86%以上,两者之间的变异较小,2种病毒之间存在交叉反应;但是PCV1和PCV2的ORF2基因同源性只有66%,氨基酸同源性仅为64%,变异较大,因此可以利用ORF2的序列对PCV的亚型进行鉴定[4]。目前,PCV2主要分为PCV2a、PCV2b、PCV2c 3个基因亚型,通过对PCV2分子流行病学和遗传变异的研究,PCV2a主要集中于2003年之前在世界各地暴发感染,但2003年PCV2b成为主要流行的基因型[5-6]。
本研究从河南省不同地区猪场的疑似PMWS病料组织中分离出PCV2毒株,采用PCR方法检测鉴定,并通过生物信息学软件分析该毒株的遗传进化,旨在分析河南地区PCV亚型和基因突变趋势,为疫病防控和疫苗研究提供指导。
1 材料和方法
1.1 材料
疑似PMWS的病料(河南省不同地区猪场采集的淋巴结、肺脏、肝脏等)、无PCV污染的PK-15细胞、PCV2鼠源单抗6A5和pMD18-T载体由河南省农科院动物免疫学重点实验室保存;DH5α感受态细胞、琼脂糖等购自宝生物工程(大连)有限公司;DMEM培养基、无支原体胎牛血清(FBS)购自索莱宝公司;AEC显色试剂盒、病毒DNA提取试剂盒、胶回收试剂盒和质粒快速提取试剂盒购自天根公司;T4 DNA连接酶、Premix ExTaqDNA聚合酶、DNA Marker购自TAKARA公司;HRP标记羊抗鼠IgG购自于北京博奥森有限公司。
1.2 DNA提取
将收集到的淋巴结、肺脏和肝脏等病料组织在无菌条件下剪碎,用含有双抗的PBS液进行充分研磨,制成20%~50%悬液并装入冻存管内,放入-80 ℃冰箱反复冻融3次,取出后用8 000 r/min转速离心10 min,取上清进行分装,每管200 μL,-80 ℃保存备用。取分装的上清液200 μL,加入4 μL蛋白酶K和200 μL蛋白裂解液并混合均匀,放入56 ℃水浴2.5 h,提取DNA后用30 μL无菌水溶解,放于-20 ℃保存备用。
1.3 引物设计与合成
根据GenBank中PCV2b的基因组序列,利用Oligo 6.0设计2对引物P1/P2和P3/P4(表1),并由上海生工生物工程有限公司合成。合成P1/P2主要用来扩增PCV2的Cap端基因序列和病料中PCV2的PCR检测,P3/P4主要用来扩增PCV2的非Cap端基因序列,两者扩增的片段拼接即可得到全长片段。

表1 PCV2的PCR检测引物和全基因组扩增引物
1.4 病毒PCV2的检测
用P1/P2引物对提取的DNA进行PCR扩增,即特异性PCR鉴定。PCR反应体系20 μL:ExTaqDNA聚合酶10 μL,上下游引物各1 μL,DNA模板2 μL,灭菌超纯水6 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,共32次循环;最后72 ℃延伸10 min。以超纯水代替模板设置阴性对照。反应结束后,PCR产物用1%的琼脂糖凝胶电泳检测。
1.5 PCV2分离与鉴定
1.5.1 PCV2的分离 将检测为阳性的病料上清液200 μL用灭菌的0.22 μm滤器过滤,经氯仿室温处理10 min后,接种PK-15细胞;37 ℃培养1 h后,弃掉培养基,用PBS洗涤细胞3次,加入细胞维持液放于37 ℃继续培养60 h,反复冻融3次后12 000 r/min离心10 min收获病毒,之后接种到PK-15细胞,按上述操作进行传代。针对每一代收获的细胞都以P1/P2 为引物,以PCV2为阳性对照,同时设立未接毒的PK-15细胞为阴性对照,进行PCR检测。
1.5.2 PCV2的鉴定 将收获的病毒用单层过氧化物酶试验(IPMA)进行鉴定。将病毒接种到在96孔细胞板上培养的PK-15细胞,37 ℃培养48~60 h;弃去培养基,用PBS洗涤3次,晾干;用冰乙醇于-20 ℃下固定细胞30 min,用PBS洗涤3次,晾干;用 0.2% Tritonx-100/PBS和3% H2O2的混合液,37 ℃孵育10 min,PBS洗涤3次,晾干;加封闭液37 ℃封闭1 h,PBS洗涤3次,晾干;加入鼠源PCV2单抗6A5(1∶500)每孔50 μL,37 ℃孵育45 min,PBS洗涤5次,晾干;加入HRP标记的羊抗鼠IgG(1∶1 000)每孔50 μL,37 ℃孵育40 min,用PBS洗涤5次,晾干;AEC显色10 min,PBS洗涤3次,晾干;80%甘油封底,显微镜下观察。
1.6 PCV2基因组扩增及同源性分析
1.6.1 特异性PCR鉴定 将1.5中收获的病毒提取DNA,分别用引物P1/P2和P3/P4进行PCR扩增。反应结束后,PCR产物用1%的琼脂糖凝胶电泳检测。
1.6.2 PCR产物的连接及转化 通过胶回收试剂盒回收目的DNA片段,用T4 DNA连接酶将回收产物与pMD18-T载体连接,构建重组质粒。10 μL连接体系如下:纯化的DNA片段3 μL,T4 DNA连接酶2 μL,pMD18-T载体1 μL,T4 DNA连接酶缓冲液4 μL。放于4 ℃连接槽中连接24 h。将10 μL连接产物加入40 μL DH5α感受态细胞中,混合均匀后冰浴30 min;放入42 ℃水浴进行热激60 s,之后立即放到冰水中3 min;在超净工作台内加入950 μL无菌LB液体培养基,放于37 ℃摇床温和振荡1 h;3 000 r/min离心5 min;弃去900 μL上清后重新悬浮;小心将悬浮液均匀涂布于LB固体培养基(AMP+)上,将涂好的平皿倒置于37 ℃细菌培养箱中培养24~36 h。
1.6.3 重组质粒的鉴定与PCV2基因组序列分析 筛选出阳性菌落扩大培养并提取质粒,利用PCR对重组质粒进行扩增,并用琼脂糖凝胶电泳检测。PCR反应体系和程序按照1.4中的方法设置,将扩增结果为阳性的质粒送上海生工生物工程有限公司测序,采用MegAlign软件对测序结果与GenBank上的PCV2基因组全长进行比对分析,并构建系统进化树。
2 结果与分析
2.1 病料PCV2的检测
处理病料的上清液经过DNA提取、PCR扩增及琼脂糖凝胶电泳检测,结果表明,在11份疑似PMWS患猪的病料组织中,可以扩出目的片段为702 bp的PCV2特异性条带的组织样品总共有7份(图1),PCV2检出率为63.6%。

M:DNA Marker DL2000;1—11:不同病料提取DNA的PCR扩增产物;N:阴性对照图1 病料组织中PCV2的PCR扩增
2.2 PCV2的分离培养
从检测结果为阳性的7份组织病料中筛选出阳性值较高的第9号病料,研磨后离心得到上清液,将其接种到PK-15细胞上,并连续传代。用引物P1/P2检测收获的每一代细胞,均能扩出特异性PCV2条带(图2),说明分离到的PCV2能够在PK-15细胞上增殖,将其命名为zmd-20161022。

M:DNA Marker DL2000;1—11:每一代细胞中PCV2的PCR扩增产物;N:阴性对照;P:阳性对照图2 每一代细胞中PCV2的PCR扩增
2.3 PCV2的IPMA鉴定
将扩增至第11代的PCV2接种于96孔板上的PK-15细胞,37 ℃ 培养60 h后,利用IPMA进行检测(图3),在接种PCV2的PK-15细胞中均能出现特异性红色染色(A),阴性对照的细胞上没有出现特异性染色(B)。

A:感染PCV2的PK-15细胞;B:未感染的PK-15细胞对照图3 IPMA检测感染PCV2的PK-15细胞
2.4 PCV2基因序列扩增及重组质粒的鉴定
对收获的病毒进行DNA的提取,利用引物P1/P2和P3/P4分别进行PCR扩增,电泳结果显示在702 bp和1 067 bp左右的位置出现目的电泳条带(图4),对获得的重组质粒进行PCR扩增和电泳检测,结果显示,扩增结果与预期的结果相一致。
2.5 PCV2分离株基因序列测定与分析
采用MegAlign软件对测序结果进行拼接,Cap段和非Cap端的序列拼接得到全基因组序列,该毒株序列全长为1 767 bp。与GenBank上的PCV2基因组全长进行比对,发现分离得到的zmd-20161022毒株PCV2核苷酸序列与PCV1(AY184287)同源性为76.8%,与国内报道的PMWS相关PCV2(AF381175)同源性为95.2%,与国内3株PCV2商品苗毒株(AY686763、HM641752、HM038034)同源性为95.2%~98.3%。与加拿大报道的第一例引起PMWS的PCV2(AF027217)同源性为95.3%,与基因登录号为HM038030.1的同源性最高为98.6%(图5)。其中对分离株PCV2的ORF2片段序列进行进化树分析发现,zmd-20161022毒株ORF2序列与HM038030.1的同源性最高,被鉴定为PCV2b-1c型,属于PCV2b的一种亚型(图6)。
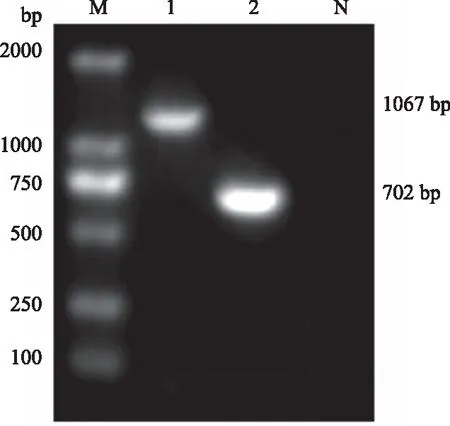
M:DNA Marker DL2000;1:引物P3/P4扩增PCV2;2:引物P1/P2扩增PCV2;N:阴性对照图4 PCV2的PCR扩增结果
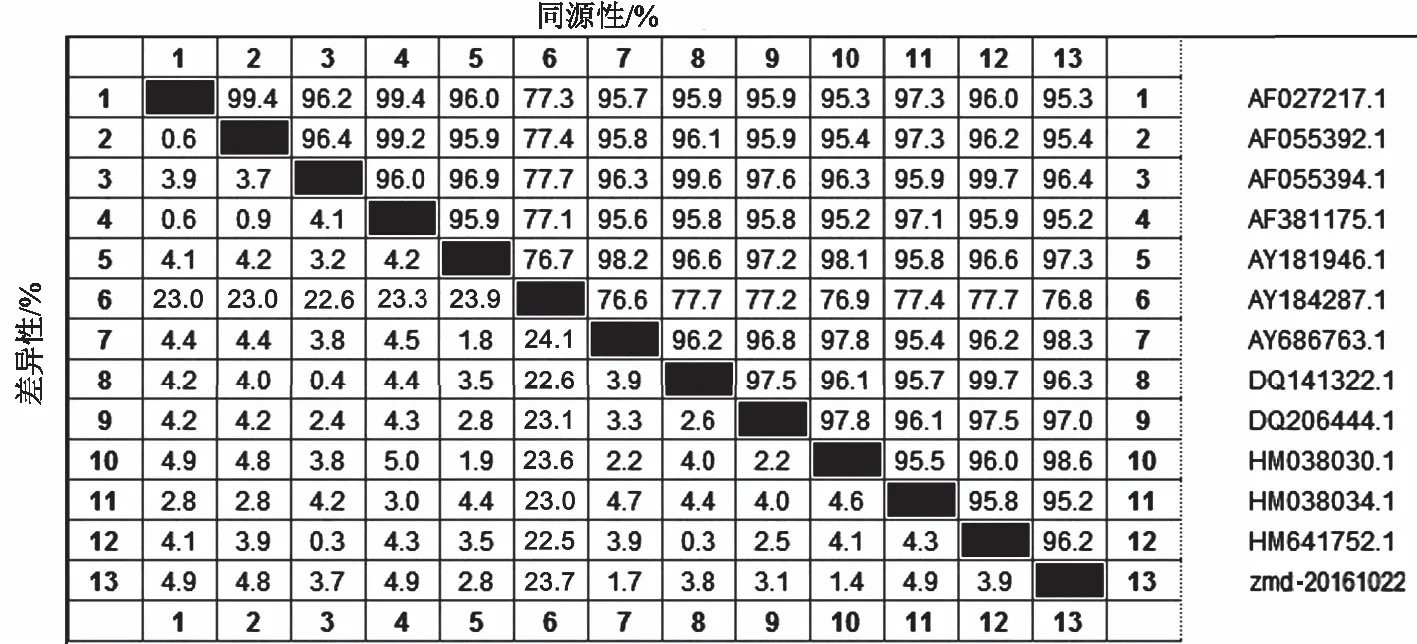
图5 PCV2分离株全基因组核苷酸序列比较
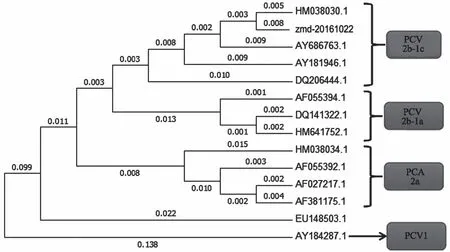
图6 PCV2分离株ORF2核苷酸序列的系统进化树
3 结论与讨论
近来年,PCV2在世界范围内传播,给养猪业造成了巨大的经济损失,我国是一个养猪大国,因而对该病的研究具有重要的意义。本研究从河南省的不同地区猪场采集了11份疑似PMWS患猪的病料组织,通过对病料进行病毒的分离鉴定,结果显示PCV2阳性的样品有7份,PCV2检出率为63.6%。由于PMWS常由PCV2和其他病毒共同感染引起[7],例如CSFV、PRRSV、PRV等猪类易感病毒,所以采集到病料可能含有除PCV2以外的病毒。在接种PK-15细胞前使用氯仿对组织研磨液进行处理,目的就是清除PRRSV、CSFV、PRV等含有囊膜的病毒[8]。由于PCV2的增殖主要借助于细胞分裂期S期所产生的蛋白质,因此可以将PCV2与PK-15细胞同步接种,这样当PK-15细胞进入分裂期的S期,可以给PCV2的增殖提供更多可以促进PCV2复制的多聚酶[9]。从检测结果为阳性的病料中挑选阳性值较高的zmd-20161022接种到PK-15细胞上进行分离培养,并采用PCR和IPMA鉴定分离的毒株,结果显示,分离的毒株能够与保存的猪阳性血清发生特异性反应,说明分离的毒株具有制作灭活疫苗的潜力。
近年来国内外报道,PCV2的流行株逐渐变得复杂化、多元化[10],因此,养殖场可以根据当地 PCV2 流行情况,有针对性地选择疫苗。有研究对2001—2009年全国各地区分离到的136份PCV2进行遗传进化分析,在2001—2005年分离得到的PCV2中,PCV2a基因型占92%,但是从2005—2009年分离得到的PCV2基因型中,PCV2b型占有很大比例。董林等[11]研究表明,从2005年以后我国猪圆环病毒主要流行株已经由PCV2a逐渐转变为PCV2b,PCV2b是近年来国内流行株的优势基因型。有学者对2011—2012年我国华北地区PCV2进行序列分析发现,PCV2的变异趋势是从PCV2a到PCV2b-1c[12-13]。同时对2005—2011年河南地区PCV2流行情况的研究证实,PCV2b在河南省属于流行毒株[14]。PCV2基因组中碱基的缺失和替换对于病毒的进化也是非常重要的,由于 ORF2基因在各个亚型中的同源性相对较低,存在不同的变异,因此研究人员常常通过对ORF2进行分析来了解PCV2的流行病学[15]。同时ORF2 基因编码含有免疫原性的病毒结构蛋白(Cap),可自我装配病毒样颗粒,并含有病毒中和抗原表位区域,已成为PCV2疫苗研发的主要候选基因之一。
本研究从疑似PMWS病料中分离得到PCV2毒株,通过全基因组测序和对ORF2序列分析得知所分离的zmd-20161022毒株属于PCV2b的一种亚型PCV2b-1c型,证明该亚型毒株已成为河南省主要流行株;此外,通过研究分离毒株的遗传变异特征,为河南省PCV2的诊断、防控和疫苗的研发奠定了良好的基础。
