H1N1亚型猪流感病毒3种谱系三重RT-PCR检测方法的建立与应用
2018-08-02兰德松侯振中
兰德松,魏 澍,侯振中
(1.东北农业大学 动物医学院,黑龙江 哈尔滨 150030; 2.农业部动物疫病病原生物学重点实验室,黑龙江 哈尔滨 150030; 3.辽宁省动物疫病预防控制中心,辽宁 沈阳 110164; 4.辽宁省动物医学研究院,辽宁 沈阳 110164)
猪流感(Swine influenza,SI)是一种猪的常见急性和高度接触性呼吸道传染病,由猪流感病毒(Swine influenza virus,SIV)感染猪而发生。猪流感是长期以来危害养猪业的重要疫病之一,尤其在集约化养殖场中广泛存在,根除极为困难。猪群单纯感染SIV具有感染率高但死亡率低的特点,但SIV感染猪只后易造成其呼吸道上皮损伤,继而造成其他细菌或病毒易于侵入猪体内,造成继发感染或混合感染,导致感染猪群猪只死亡率升高,带来巨大的经济损失[1]。目前,在流感研究领域,猪已被广泛证实为流感病毒的“混合器”及新亚型流感病毒毒株产生的“活载体”。当猪只同时感染2种以上不同种类或亚型流感病毒毒株时,不同流感病毒可在其呼吸道上皮细胞内进行增殖和重配,产生新的重配毒株且具有明显的选择优势,传播能力显著增强,危害也显著增加[2-6]。历史上人流感大暴发与SIV有着密不可分的联系,如1957年、1968年和2009年暴发的人流感疫情均由猪身上产生的重组流感病毒引起[3],因而其公共卫生学意义重大。
目前,在世界范围内猪群中流行的SIV主要为H1N1(包括古典型H1N1、类禽型H1N1以及2009年暴发的甲型H1N1)、H1N2(包括不同基因型)、H3N2(包括类人型或类禽型H3N2、重组H3N2)等亚型[6-7]。其中,H1N1亚型SIV又分为古典型 (Classical swine H1N1,CS H1N1)、类人型(Human-like H1N1,Hu H1N1)、类禽型 (Avian-like H1N1,aH1N1)和2009年在人群中大流行的甲型H1N1 (2009 pandemic H1N1,pdm/09 H1N1) 4个谱系[8],近年来,通过血清学监测及病原分离鉴定的结果显示,我国猪群中流行的SIV优势亚型毒株为H1N1亚型,包括pdm/09 H1N1、CS H1N1和aH1N1[5-6,9-10],偶尔也有Hu H1N1感染猪群的报道[11-12]。通过SPF鸡胚分离病毒是当前流感病毒检测最灵敏可靠的“金标准”方法,尤其是对病毒含量低的样本,通过鸡胚接种增殖病毒进行病毒分离鉴定无疑是最有效的方法,但对于大量样本的大批量检测,该方法耗时费力,对实验室生物安全条件的要求也高,普通实验室很难开展该项工作。PCR方法是一种目前公认的进行病毒鉴定的可靠手段,国内已有学者建立了鉴别诊断不同亚型SIV的PCR方法[13-15],在SIV检测和流行病学调查中发挥了重要作用,但尚未建立当前在我国猪群中流行的主要优势毒株H1N1亚型pdm/09 H1N1、CS H1N1和aH1N1等3种主要谱系SIV的多重RT-PCR鉴别检测方法。为此,本研究针对H1N1亚型3种谱系pdm/09 H1N1、CS H1N1和aH1N1 SIV的HA基因特异性序列,设计了3套特异性引物,建立了H1N1亚型三重RT-PCR鉴别诊断方法,为开展猪群中流行的H1N1亚型SIV感染及流行情况的调查研究提供技术支撑。
1 材料和方法
1.1 试验材料
1.1.1 毒株、鸡胚 aH1N1、pdm/09 H1N1毒株由辽宁省动物医学研究院实验室分离并保存;CS H1N1亚型SIV病毒核酸、不同亚型SIV标准抗原和血清均由哈尔滨兽医研究所猪流感研究室提供;H5、H7和H9亚型流感病毒、PRRSV和CSFV核酸为购自匹基生物公司相应试剂盒中的核酸阳性对照品;9~11日龄SPF鸡胚购自辽宁益康生物股份有限公司。
1.1.2 主要试剂及仪器 M-MLV反转录酶、dNTP(2.5 mmol/L)、RNase Inhibitor、DTT(0.1 mmol/L)、Premix ExTaq试剂盒、DL2000 DNA Marker均购自宝生物(大连)有限公司,病毒DNA/RNA提取试剂购自天隆科技有限公司,Multiskan GO全波长酶标仪为赛默飞世尔科技公司产品,普通PCR仪、电泳仪、Gel Doc XR+型凝胶成像系统为美国伯乐公司产品。
1.1.3 临床样品采集 2012—2017年采集辽宁地区屠宰场和疑似SIV发病猪场猪鼻咽拭子样品3 310份。
1.2 试验方法
1.2.1 引物设计及合成 根据GenBank上登录的SIV的HA基因序列(收录号分别为:GQ259909、FJ789832、JQ319648),设计特异性扩增pdm/09 H1N1、CS H1N1和aH1N1亚型SIV的HA基因的3对特异性引物(表1),引物由上海生工生物工程有限公司合成。

表1 pdm/09 H1N1、CS H1N1和aH1N1亚型SIV的HA基因的引物序列
1.2.2 病毒总RNA 的提取 取已鉴定的H1N1亚型不同谱系SIV尿囊液样品各200 μL,按照核酸提取试剂说明书进行总RNA的提取。
1.2.3 单重和三重RT-PCR方法的建立
1.2.3.1 反转录 反转录引物为Uni12:5′-AGCAAAAGCAGG-3′。反应体系为(25 μL):11.5 μL ddH2O(经DEPC处理)、2 μL dNTP(2.5 mmol/L)、1 μL Uni12 (20 μmol/L)、2.5 μL DTT(0.1 mmol/L)、5 μL 5×Reverse Transcriptase XL Buffer、0.5 μL M-MLV反转录酶、0.5 μL RNase Inhibitor、2 μL总RNA。反应条件为:37 ℃水浴1 h,70 ℃水浴15 min。
1.2.3.2 单重和三重RT-PCR反应体系及条件的优化 通过梯度试验对引物终浓度、模板浓度等反应条件进行优化,确定3种不同谱系单重RT-PCR反应体系为(25 μL):12.5 μL Premix ExTaq,10.5 μL ddH2O,1 μL cDNA,上、下游引物各0.5 μL。三重RT-PCR反应体系为(25 μL):12.5 μL Premix ExTaq,6.5 μL ddH2O,3 μL cDNA混合物(3种谱系各1 μL),3种谱系上、下游引物各0.5 μL(共3 μL)。反应条件为:94 ℃ 3 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。取PCR扩增产物5 μL点样于1 %琼脂糖凝胶孔中,进行电泳鉴定。
1.2.4 三重RT-PCR方法的特异性试验 将3 310份采自辽宁地区屠宰场和疑似发病猪场的猪鼻咽拭子样品处理后进行鸡胚接种,收取尿囊液,进行HA-HI试验[16],鉴定分离得到亚型毒株39株;提取分离鉴定的SIV及H5、H7、H9亚型流感病毒、PRRSV、CSFV核酸,应用本试验建立的三重RT-PCR方法进行检测,对该方法的可靠性和特异性进行验证。
1.2.5 三重RT-PCR方法的敏感性试验 对测定浓度的pdm/09 H1N1、CS H1N1和aH1N1亚型3种谱系SIV的cDNA产物进行10倍梯度稀释至10-5,进行RT-PCR方法的敏感性试验。
1.2.6 RT-PCR方法对临床样品的检测 对采自辽宁地区屠宰场和疑似发病猪场的猪鼻咽拭子样品3 310份,采用鸡胚接种进行病毒分离鉴定;应用本试验建立的三重RT-PCR方法对鉴定的毒株进行pdm/09 H1N1、CS H1N1和aH1N1亚型不同谱系SIV检测,计算RT-PCR方法与病毒分离结果的符合率。
2 结果与分析
2.1 单重和三重RT-PCR方法的建立结果
结果表明,3种谱系单重和三重RT-PCR方法均能特异性地扩增出目的基因,pdm/09 H1N1 RT-PCR方法、CS H1N1 RT-PCR方法和aH1N1 RT-PCR方法均能特异性检测出相应谱系的SIV核酸,分别在476 bp、293 bp和997 bp位置出现目的条带;三重RT-PCR方法能特异性地检测出pdm/09 H1N1、CS H1N1和aH1N1病毒核酸混合物,在相应位置出现目的条带,与预期大小一致(图1)。
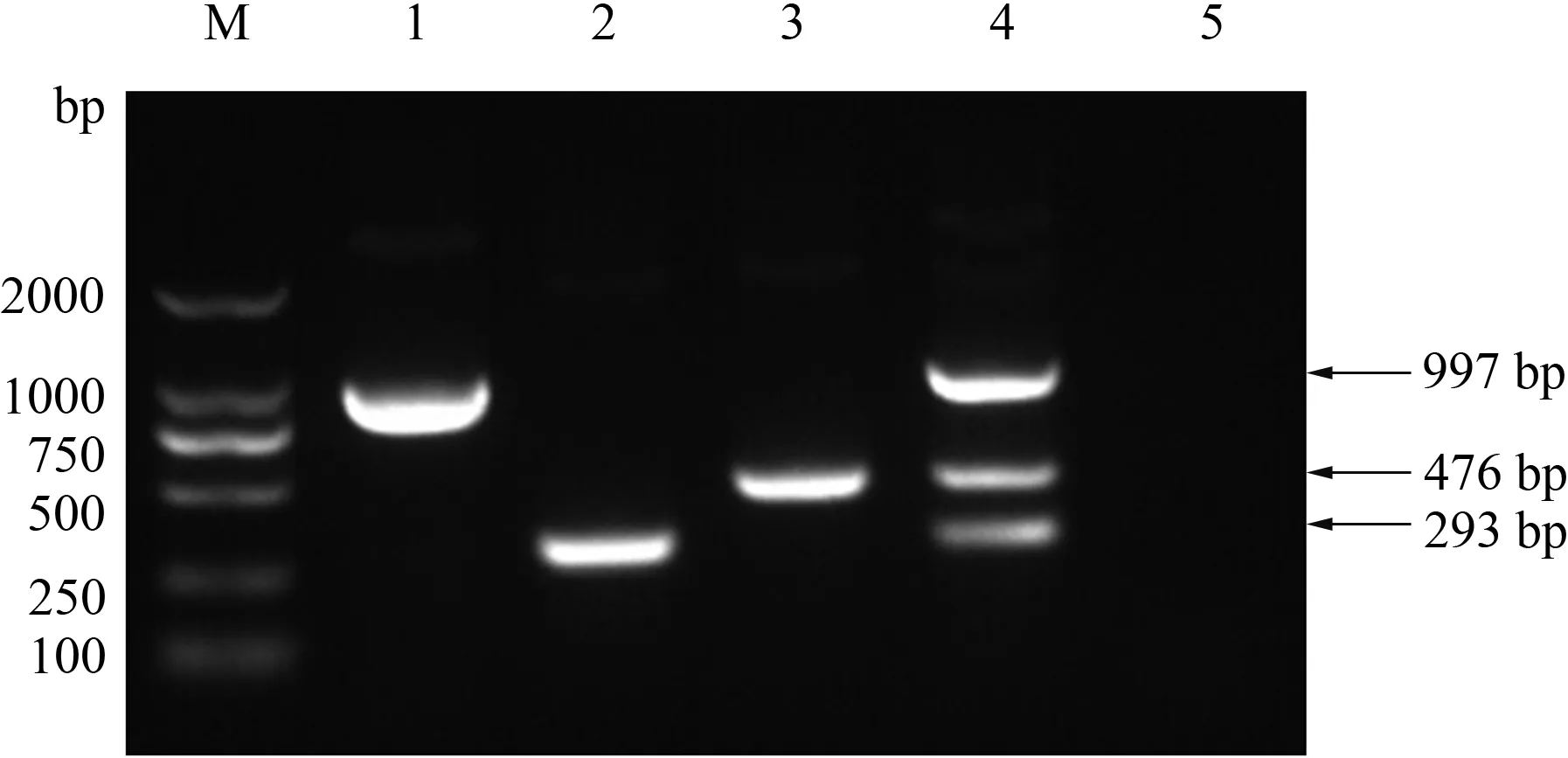
M:DL2000 DNA Marker;1:aH1N1;2:CS H1N1;3:pdm/09 H1N1;4:pdm/09 H1N1、CS H1N1、aH1N1 SIV混合物;5:阴性对照图1 H1N1亚型SIV不同谱系单重和三重RT-PCR电泳结果
2.2 三重RT-PCR方法的特异性试验结果
试验表明,H1N1亚型三重RT-PCR方法能特异性地检测出pdm/09 H1N1、CS H1N1和aH1N1亚型SIV,而与H5、H7、H9亚型流感病毒、PRRSV和CSFV均无交叉反应(图2)。对3个谱系SIV的PCR扩增产物分别进行回收纯化后,经测序进一步确定为目的基因,表明本试验建立的三重RT-PCR方法特异性强。

1:pdm/09 H1N1、CS H1N1、aH1N1 SIV混合物;2:H5亚型流感病毒;3:H7亚型流感病毒;4:H9亚型流感病毒;5:PRRSV;6:CSFV;7:阴性对照;M:DL2000 DNA Marker图2 H1N1亚型SIV三重RT-PCR特异性试验结果
2.3 三重RT-PCR方法的敏感性试验结果
试验结果表明,H1N1亚型SIV三重RT-PCR方法可检测出稀释至10-5的pdm/09 H1N1和CS H1N1模板cDNA,可检测出稀释至10-4的aH1N1模板cDNA(图3);经Multiskan GO全波长酶标仪测定DNA浓度发现,该方法可检测出pdm/09 H1N1、CS H1N1和aH1N1 SIV核酸的极限拷贝量分别为1 460拷贝/μL、1 700拷贝/μL和1 950拷贝/μL。
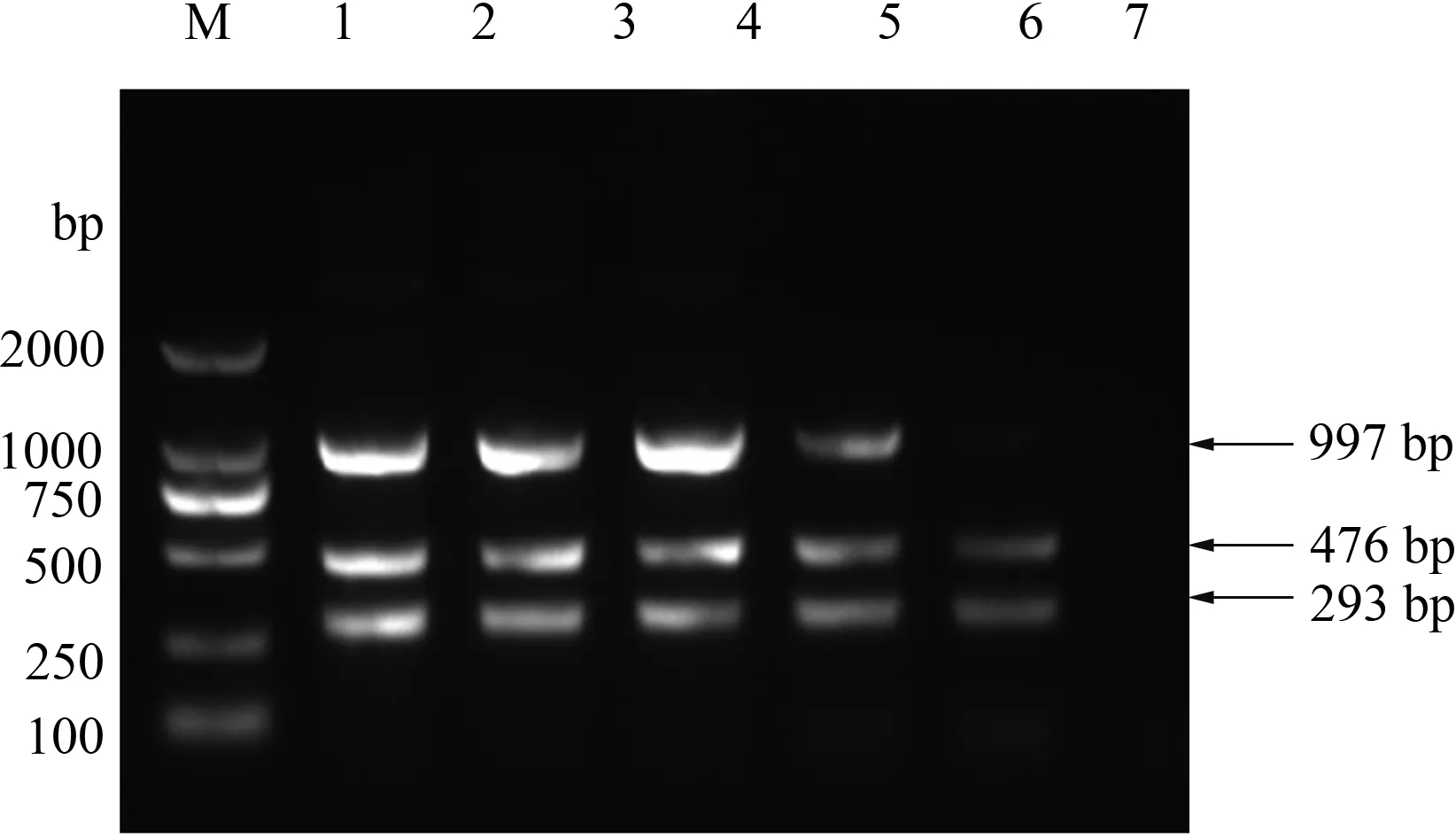
M:DL2000 DNA Marker;1—6:100~10-5的cDNA模板;7:阴性对照图3 H1N1亚型SIV三重RT-PCR敏感性试验结果
2.4 三重RT-PCR方法对临床样品的检测结果
对采自辽宁地区屠宰场、疑似发病猪场的猪鼻咽拭子3 310份,通过鸡胚接种分离到具有血凝活性的样品39份,阳性率为1.18 %。经HI试验鉴定,其中21份样品为aH1N1亚型SIV,10份样品为pdm/09 H1N1亚型,8份为H1N2亚型SIV,未分离到CS H1N1亚型SIV。本研究建立的三重RT-PCR方法对鸡胚分离鉴定为aH1N1亚型阳性SIV的21份样品和pdm/09 H1N1阳性SIV的10份样品的3代尿囊液进行检测发现,结果与鸡胚接种分离鉴定结果完全一致(表2)。
表2 三重RT-PCR与SPF鸡胚病毒分离对临床样品检测结果的比较
3 结论与讨论
自1918年首次报道北美猪群中发生猪流感疫情,至今已经整整100 a,尽管单纯发生SIV感染导致的猪只死亡率并不高,但由于其造成的免疫损伤极易导致其他病毒或细菌的继发感染,进而造成巨大的经济损失;同时由于猪在流感病毒流行、传播中的“中间宿主”及“基因混合器”的特殊地位,猪流感现在已越来越引起人们的重视,多个国家也加强了对猪流感的监测工作。
20世纪70年代以前,监测到猪群中流行的SIV均为CS H1N1,自1979年,比利时首先在猪群中分离到aH1N1病毒,此后,该亚型病毒迅速代替CS H1N1病毒成为欧洲猪群中流行的优势亚型毒株,并一直流行至今[2,17-18]。在我国,Guan等[19]于1993年首次分离到aH1N1亚型病毒,随后,在全国多个省份均发现该亚型病毒。近年来,其已成为我国猪群中流行的优势SIV毒株。另外,aH1N1亚型SIV已具备感染人的能力,2011年江苏[20]以及2012年河北[21]各有1例患病死亡的男童,分别从他们体内分离到的流感病毒经鉴定均为H1N1亚型毒株,在抗原性和遗传性上与欧洲和当前中国猪群中流行的aH1N1亚型SIV关系密切。2009年,pdm/09 H1N1在墨西哥出现并从猪传播到人类,导致全球范围内超过10万人死亡,近年来该型病毒在我国猪群中也广泛存在[9-10,22]。遗传分析表明,该型病毒为三源重配病毒,其HA和NS基因来源于CS H1N1 SIV,NA和M基因来源于aH1N1 SIV,另外4个内部基因来源于北美三源重配流感病毒(禽流感、人流感和猪流感病毒),在疫情暴发前pdm/09 H1N1病毒未曾在猪体内检测到,但是该病毒的前体已在猪群中流行长达17 a之久[23]。
本研究通过对当前流行的SIV优势毒株主要抗原相关基因HA基因序列分析,设计了针对H1N1亚型3种谱系pdm/09 H1N1、CS H1N1和aH1N1的3套特异性引物对,经过优化反应体系和条件,建立了H1N1亚型三重RT-PCR方法,敏感性和特异性试验结果表明,该方法敏感性较高、特异性良好,从核酸提取到电泳检测目的条带,全程大约4 h即可完成,相比单重RT-PCR节省了试剂成本与反应时间。应用本试验建立的三重RT-PCR方法,对通过鸡胚分离病毒获得的SIV临床阳性样品进行检测表明,该方法能有效实现对临床样品中H1N1亚型3种谱系的检测,2种方法的符合率达到100%。但该方法也存在一定的局限性,即检测限较荧光定量RT-PCR偏高10倍左右,难以实现病毒的痕量检出。另外,本方法对临床样品的检测是通过鸡胚接种传代后的尿囊液,其病毒含量较直接采样的鼻咽拭子中高得多,其对临床采集的猪鼻咽拭子中的SIV阳性检出率与鸡胚分离病毒的符合率究竟能达到多大程度,尚需进一步试验验证。
