外源Spd和NO对盐胁迫下玉竹脯氨酸代谢途径的影响
2018-08-02李丹阳闫永庆高梦蕾
李丹阳,闫永庆,殷 媛,王 馨,高梦蕾,王 群
(东北农业大学 园艺园林学院,黑龙江 哈尔滨 150030)
盐渍土对植物种植及生产危害极大,我国可耕地面积的1/4均为盐渍土。因此,探究植物的耐盐机制及缓解盐胁迫有重要意义[1]。脯氨酸(Pro)作为一种重要的渗透调节物质在盐胁迫中起保护蛋白质、生物膜、亚细胞结构以及清除活性氧等重要作用[2-4]。盐胁迫下,植物通过积累Pro避免植物过度失水,保持细胞膜稳定[5]。植物体内Pro代谢途径有2条,分别是以谷氨酸为底物的谷氨酸(Glu)途径和以鸟氨酸为底物的鸟氨酸(Orn)途径。△1-吡咯啉-5-羧酸合成酶(P5CS)是谷氨酸途径中的限速酶,精氨酸酶和鸟氨酸转移酶(OAT)是鸟氨酸途径中的关键酶,脯氨酸脱氢酶(ProDH)是脯氨酸降解酶。李彦等[6]发现,盐胁迫下油菜Pro积累源于OAT活性的增加和ProDH活性的减弱。
多胺是具有生物活性的小分子直链脂肪族含氮碱[7],以游离态存在于植物体中,如腐胺(Putrescine,Put)、尸胺(Cadaverine,Cad)、亚精胺(Spermidine,Spd)等。多项研究表明,Spd能参与调节植物逆境胁迫,抑制活性氧的产生,调节膜理化性质,稳定膜结构,保持细胞膨压等[8]。此外,Spd具有共价阳离子特性,生理活性更强,能提高水分胁迫下白三叶(TrifoliumrepensL.)[9]Pro代谢中的P5CS合成酶和降解酶ProDH活性,增加Pro含量的积累,但对鸟氨酸途径中的OAT活性没有影响。
一氧化氮(Nitric oxide,NO)作为一种广泛存在于植物中的信号分子,参与植物呼吸作用、光形态建成、衰老及各项生理活动[10]。柯学等[11]研究表明,NO通过增强渗透胁迫下烟草(NicotianatabacumL.)悬浮细胞GDH、精氨酸酶和OAT的活性,降低ProDH的活性来提高Pro含量,表明NO是通过参与调控脯氨酸代谢过程来适应渗透胁迫的。 前期研究了100 μmol/L NO供体硝普钠(SNP)对150 mmol/L NaCl浓度下玉竹[Polygonatumodoratum(Mill.)Druce]的氧化损伤有明显缓解作用[12],在此基础上,探索不同浓度外源Spd及其与SNP叠加使用对玉竹渗透调节和脯氨酸代谢途径的影响,揭示玉竹在盐胁迫下的渗透调节机制,为玉竹在盐地的高效利用奠定基础。
1 材料和方法
1.1 试验材料
2017年3月将玉竹根茎从圃地中完整取出,每3根块茎盆栽于高度和直径均为15 cm、底部有孔且有托盘的塑料花盆中,以细沙为基质,每盆细沙体积相同,栽植后的玉竹在东北农业大学园艺试验站智能温室培养。全部材料均以1/2 Hoagland营养液浇灌,培养约40 d,待叶片全部展开时对幼苗做试验处理。
1.2 试验设计
选取上述玉竹幼苗为试验材料,NaCl浓度设为0、150 mmol/L,外源NO由其供体SNP提供,浓度设为0、100 μmol/L,外源Spd浓度设为0、10、100、1 000 μmol/L,如表1。将材料分成1、2、3、4共4个组,每组随Spd浓度的不同,分为4个处理,共16个处理。其中,组1、组2为外源Spd单独添加处理,组3、组4为外源Spd、SNP叠加使用处理。每个处理3个重复,每个重复1盆,共48盆。6月2日进行盐胁迫处理(无盐胁迫组以等量蒸馏水代替),为防止盐激效应,NaCl浓度每天递增50 mmol/L,直至达到150 mmol/L,再以此浓度处理。6月4日开始Spd(0、10、100、1 000 μmol/L)及其与SNP(0、100 μmol/L)的叠加处理。SNP采用叶面喷施,Spd随NaCl处理根灌,每天施用一次,所有处理在7:00—8:00进行。共处理20 d,处理结束后的第2天采集靠近根部的叶片,每个样品取约0.2 g,置于-80 ℃超低温冰箱中备用。

表1 不同处理NaCl浓度及外源Spd、SNP浓度
1.3 测定指标及方法
游离Pro含量参照高俊凤[13]的磺基水杨酸法略加修改。
脯氨酸代谢关键酶活性的测定:OAT活性参照余光辉[14]的方法,P5CS活性参照Hayzer等[15]的方法,精氨酸酶活性参照Alabadí等[16]的方法,ProDH活性参考Kim等[17]的方法稍作改进。
1.4 统计与分析
试验数据用SPSS 17.0进行方差分析及多重比较(LSD),用Excel 2010进行数据处理并作图。
2 结果与分析
2.1 外源Spd和NO对盐胁迫下玉竹叶片Pro含量的影响
由图1A可知,无外源Spd、SNP添加的条件下,150 mmol/L盐胁迫显著增加了玉竹叶片中Pro含量;添加不同浓度的外源Spd时,Pro含量先升高后降低,添加0、10、100、1 000 μmol/L外源Spd时,Pro含量分别为973.1、1 189.1、1 450.0、1 240.0 μg/g,在Spd浓度为100 μmol/L时达到峰值。图1B中,盐胁迫下,同时添加一定浓度的SNP和Spd时,Pro含量与仅添加Spd(SNP=0 μmol/L)时相比增加了5.3%、-8.3%、2.9%、13.7%,增加幅度不明显。上述结果表明,盐胁迫下玉竹叶片Pro含量增加,从而参与渗透调节来抵制逆境,推测外源Spd促进玉竹叶片Pro含量的合成积累,但NO与Spd叠加的效果与Spd相比不明显。
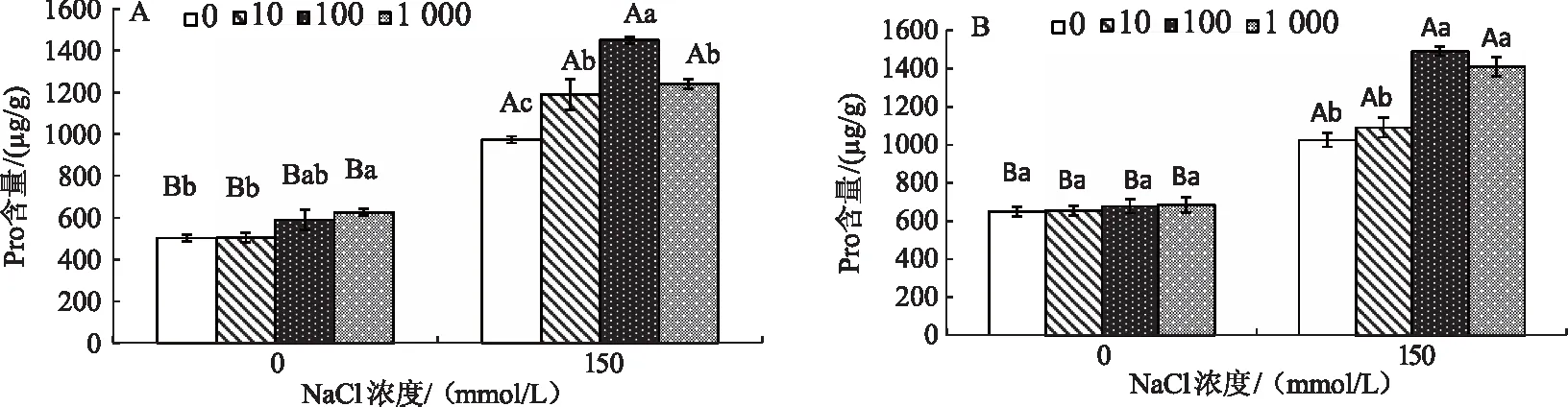
不同大写字母代表组间在0.05水平上差异显著,不同小写字母代表组内在0.05水平上差异显著;0、10、100、1 000分别代表Spd浓度0、10、100、1 000 μmol/L;A:SNP浓度为0 μmol/L;B:SNP浓度为100 μmol/L。下同图1 Spd和NO对盐胁迫下玉竹叶片Pro含量的影响
2.2 外源Spd和NO对盐胁迫下玉竹叶片OAT活性的影响
OAT是鸟氨酸途径中的关键酶,可将鸟氨酸转化为谷氨酸半醛(GSA),进而合成Pro。图2表明,无NaCl胁迫条件下,施加外源Spd和SNP,OAT活性变化并不显著。盐胁迫下,OAT活性迅速上升,且随Spd浓度的升高先升高后下降。图2A中,当NaCl浓度为150 mmol/L时,其活性分别为264.8、327.4、415.7、343.4 U/(g·h),可知当Spd的浓度为100 μmol/L时达到最大值,是Spd浓度为0 μmol/L时的1.6倍,随后下降,但仍高于无外源Spd添加的处理。盐胁迫下仅添加SNP时(图2B),OAT活性比不加SNP处理(图2A)升高了30.7%,而Spd和NO交互时,OAT活性升高了9.4%、7.1%、8.6%。由此可见,一定浓度Spd和SNP均能有效提高OAT活性,推动脯氨酸合成途径的进行,但NO与Spd叠加并不能明显提高对OAT活性增加的幅度。

图2 Spd和NO对盐胁迫下玉竹叶片OAT活性的影响
2.3 外源Spd和NO对盐胁迫下玉竹叶片P5CS活性的影响
P5CS是谷氨酸途径中的限速酶,谷氨酸在P5CS的催化作用下生成GSA,进而生成Pro。由图3可知,盐胁迫下P5CS活性与非胁迫条件相比,变化并不明显。无NaCl胁迫时,单独添加Spd时,P5CS活性缓慢上升,共同添加外源Spd和SNP时,P5CS活性缓慢先升后降,但并不显著。盐胁迫下,两种外源物质对P5CS活性影响也不明显,呈先缓慢上升,后缓慢下降趋势。说明玉竹叶片中P5CS受盐胁迫和两种外源物质的影响很小,谷氨酸途径对玉竹叶片Pro合成的贡献小于鸟氨酸途径。
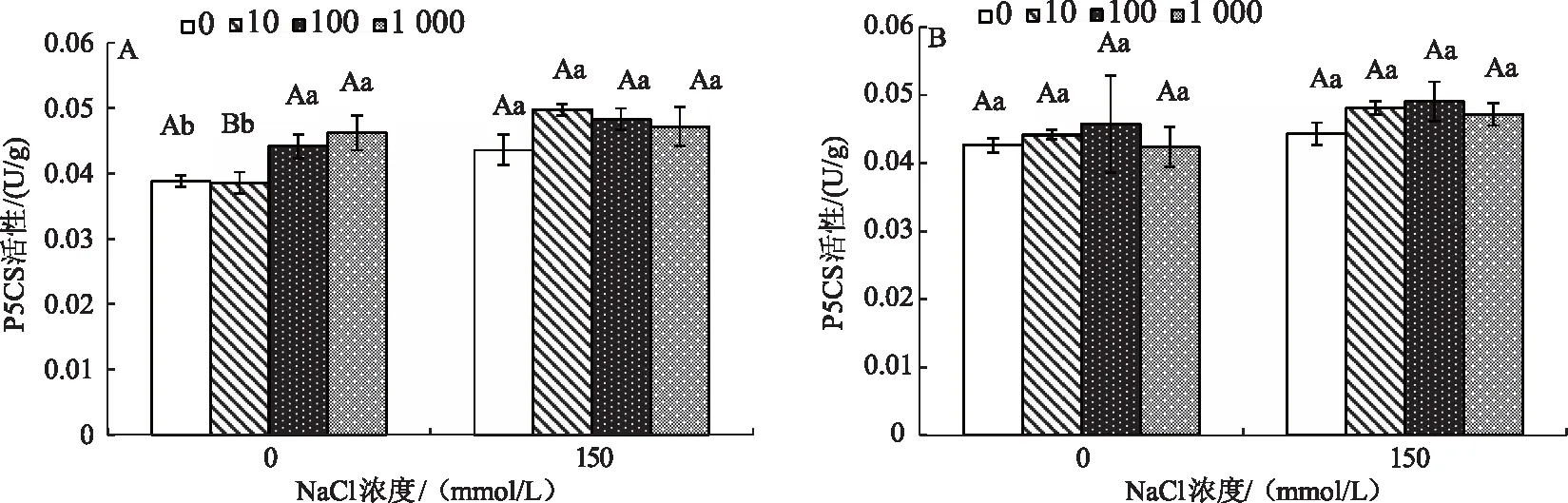
图3 Spd和NO对盐胁迫下玉竹叶片P5CS活性的影响
2.4 外源Spd和NO对盐胁迫下玉竹叶片精氨酸酶活性的影响
在鸟氨酸途径中,精氨酸酶催化精氨酸生成鸟氨酸的转化反应,其控制鸟氨酸的含量,是鸟氨酸的催化酶。由图4可知,无NaCl胁迫时,玉竹叶片内精氨酸酶活性很低,且两种外源物质对精氨酸酶活性基本没有影响。由图4A可知,无外源Spd、SNP添加的条件下,盐胁迫使玉竹叶片精氨酸酶活性由20.2 U/g上升至368.9 U/g。盐胁迫条件下,添加不同浓度外源Spd时,精氨酸酶活性显著提高,且当Spd浓度为100 μmol/L时达到峰值488.0 U/g,是盐胁迫下Spd浓度为0 μmol/L时的1.3倍。当NaCl浓度为150 mmol/L时,精氨酸酶活性呈先上升后降低趋势,但始终高于无Spd时的活性。图4B中,外源Spd和NO交互时,NO缓慢促进了Spd对盐胁迫的缓解作用,但在Spd>1 000 μmol/L时,添加SNP使玉竹叶片精氨酸酶活性显著下降。

图4 Spd和NO对盐胁迫下玉竹叶片精氨酸酶活性的影响
2.5 外源Spd和NO对盐胁迫下玉竹叶片ProDH活性的影响
ProDH是脯氨酸降解反应的限速酶,将Pro降解为P5CS。图5表明,盐胁迫下,玉竹叶片ProDH活性显著下降,以此来减缓Pro的降解。随着Spd浓度的上升,ProDH酶活性呈下降趋势,与无盐胁迫、无外源添加的处理相比,分别下降了16.4、18.1、24.2、26.5 U/g,当外源Spd浓度为1 000 μmol/L时达到最低值(图5A)。由图5B可知,盐胁迫下,玉竹叶片ProDH酶活性随Spd浓度的增加呈先降低后升高趋势,说明外源SNP与一定浓度Spd可以减缓降解途径的进行,加速Pro的积累,但SNP与高浓度外源Spd(1 000 μmol/L)叠加使用时对玉竹叶片的伤害反而大于其缓解作用。
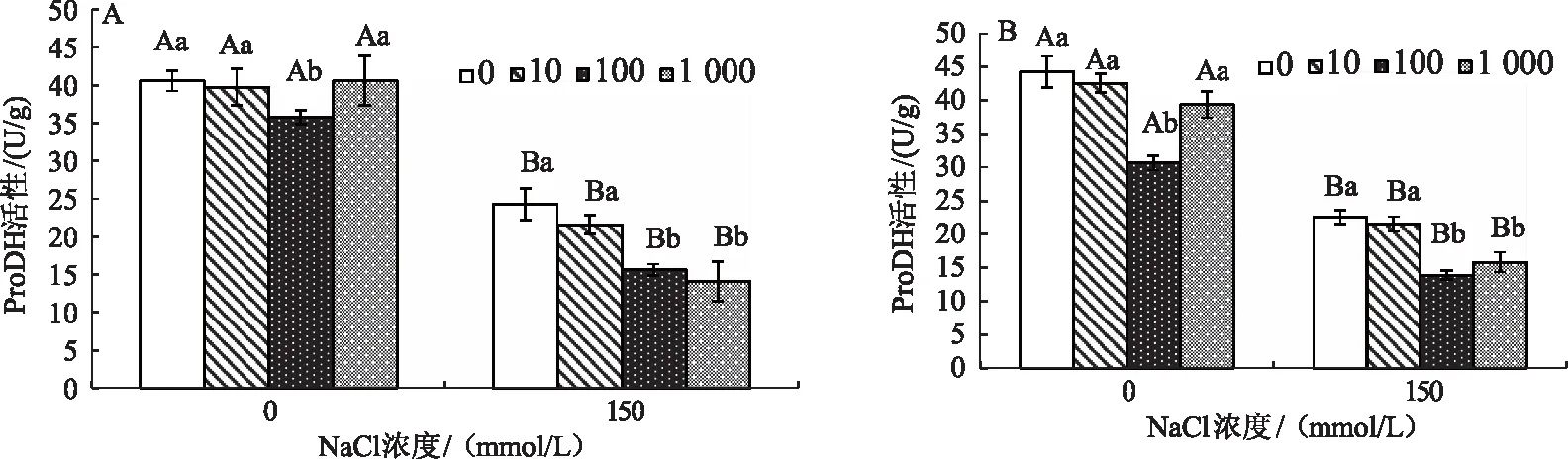
图5 Spd和NO对盐胁迫下玉竹叶片ProDH酶活性的影响
3 结论与讨论
逆境条件下,植物通过调节各个系统来适应或缓解对自身的伤害,而渗透调节是植物防御机制的第一道防线,渗透胁迫下,植物快速积累渗透调节物质来维持植物细胞膨压和生物活性分子构象,Pro是分子透性最大、极易溶于水的相容性渗透剂和抗氧化剂[18],在抗渗透胁迫中发挥重要作用[19]。大量研究说明,盐胁迫下植物Pro含量会快速上升[20],而Pro低速率氧化、蛋白质分解及Pro前体转化为Pro等都会导致Pro积累。也有研究认为,Pro的积累是因为Pro代谢中的关键酶起了作用[21]。高等植物体内Pro合成有两条途径,分别是谷氨酸途径和鸟氨酸途径。夏方山等[22]对盐胁迫下碱地风毛菊的研究发现,Pro合成以鸟氨酸途径为主,对谷氨酸途径中的酶影响不大,与本研究结果一致。Parida等[23]的研究表明,干旱胁迫下棉花(Gossypiumspp)叶片谷氨酸途径中的P5CS活性被激活,Pro含量上升,而鸟氨酸途径中的OAT活性却没有变化,这与本试验研究的结果并不一致,这可能是由于不同植物间存在的差异所致,有待进一步研究。施加外源物质能通过调节Pro含量缓解逆境对植物的伤害[24]。盐胁迫下,外源施加SNP能促进黄瓜[25]幼苗Pro积累,诱导P5CS活性增加,提高幼苗耐盐性。
通常情况下,Pro的积累主要发生在代谢旺盛的部位(包括光合器官和生殖器官),这是植物在盐胁迫下一种生态适应的“保命”政策[26]。叶片是光合作用旺盛的器官,本试验中,盐胁迫下玉竹地上部分Pro含量在盐胁迫下显著升高,合成途径中的关键酶与Pro含量表现出相关性,这是Pro合成途径(鸟氨酸途径)中关键合成酶(OAT、精氨酸酶)和降解酶(ProDH)共同作用的结果。适宜浓度(100 μmol/L)Spd和NO提高了叶片中Pro含量并激活了鸟氨酸途径中的OAT、精氨酸酶活性,同时降低了降解酶活性,从而适应盐胁迫,提高抗性,而谷氨酸途径(P5CS)对Pro积累贡献不大,说明Spd参与玉竹幼苗Pro代谢调控机制,这与余光辉等[27]的研究一致。一方面可能是P5CS受Pro的反馈调节,当Pro含量增加时反馈调节抑制了P5CS活性,而OAT不受Pro的反馈调节。另一方面,P5CS mRNA和δ-OAT mRNA的表达可能与植物体内氮素水平有关,渗透胁迫及低氮条件下,以谷氨酸-脯氨酸途径为主;非渗透胁迫及高氮时,则鸟氨酸-脯氨酸途径占据主导地位[28]。本试验结果可能是因为营养液供应充足,使植物体内氮素水平过高,胁迫时间(20 d)过长,所以激活了鸟氨酸-脯氨酸途径。
盐胁迫下,玉竹Pro含量及OAT、精氨酸酶活性升高,P5CS活性无明显变化,ProDH活性降低。Pro的积累是激活鸟氨酸—脯氨酸途径和降解途径共同作用的结果,适宜浓度Spd能提高Pro含量,增强鸟氨酸途径中的OAT、精氨酸酶活性,降低ProDH活性,NO能缓慢加强Spd的缓解作用,但具体参与调控的机制有待进一步研究。
