锌污染对吊兰根际土壤酶活性的影响
2018-08-02张永兰王友保韦晶晶
张永兰, 尚 璐, 王友保, 韦晶晶
(1.安徽师范大学 生命科学学院,生物环境与生态安全安徽省高校重点实验室,安徽 芜湖 241000;2.池州职业技术学院 园林系,安徽 池州 247000)
我国土壤锌污染问题在近年开始涌现,土壤锌污染报道不断增加。进入土壤中的锌在生物地球化学过程中活性较为保守,迁移和转化时间长。据Allaway估算,在没有外来锌继续加入的情况下,只通过植物吸收使其在土壤中消失的时间约为1000年[1]。土壤被锌污染后,由于其累积性和不可逆转性的污染特点,直接对土壤-植物系统产生危害,并影响到人类健康,严重时使土壤失去自然生产力,成为不毛之地[2-4]。土壤酶作为土壤新陈代谢的主要因素,是最为活跃的土壤有机成分之一,直接影响土壤中进行的生物地球化学过程。有研究论证了影响土壤酶活性的因素主要有:土壤pH、土壤有机质、土壤养分及微生物种类等[5],土壤酶活性可以反映土壤中进行的各种生物化学过程的强度和方向,与土壤肥力密切相关[6-9]。同时,重金属对土壤酶活性抑制或激活作用的表现也比较敏感[10]。所以土壤酶活性是土壤肥力评价的重要指标之一,也是土壤自净能力的重要评价指标之一。在污染土壤的监测和治理工作中,可以将土壤酶活性作为监测土壤重金属污染的重要生物活性指标[10,13]。吊兰(Chlorophytumcomosum)隶属于百合科吊兰属,为常用园林观赏植物,生命力旺盛,繁殖力强,对环境适应力强。本文选取吊兰作为试验材料,进行重金属锌污染条件下的栽培实验,旨在研究重金属锌污染对土壤酶活性的影响,以及吊兰对重金属锌污染土壤的修复效果,为治理和修复重金属锌污染土壤提供参考依据。
1 实验材料与方法
1.1实验材料
供试土壤取自于安徽师范大学后山,土壤类型为黄棕壤,其基本性质:pH为4.775,电导率为107.500μS·cm-1,氧化还原电位为150.000mV,有机质、全氮、全磷含量分别为4.751、0.770和0.949g·kg-1,土壤全锌含量为83.530mg·kg-1。土壤采集后,除去动植物残体、石砾等杂物,于室内通风处风干,磨细后过3mm筛,混匀后备用。
吊兰购自合肥市裕丰花市,预培养一周后,选取生长情况大致相同、叶片饱满、根系丰富的吊兰幼苗作为实验材料。
1.2实验设计
实验以乙酸锌为重金属添加剂,一次性加入不同体积的乙酸锌溶液,并将其与土壤充分混匀,使土壤含锌量分别为200、500、800、1000、1500、2000和2500mg·kg-1,以不添加锌的土壤为对照(CK),共8个处理。将混匀后加有不同锌浓度的土壤分别装入对应的花盆中。每盆装土700g,其中根际300g,非根际400g(根际是用自制的尼龙网袋分开的),预培养4周。实验设栽种吊兰的栽培组和不栽培吊兰的空白组。上述每个处理设3个重复。
1.3植物栽培及取样
土壤经预培养处理后,每盆栽种2株吊兰,分别于栽培当天和栽培后第18天、36天及54天在吊兰的根际、非根际以及空白组中取出适量的土,并置于0~4℃冰箱中保存,用于测量土壤中土壤酶活性。
1.4测定方法
土壤酶活性测定参照关松荫等[14]介绍的方法:过氧化氢酶采用0.1mol·L-1KMnO4滴定法,其活性以1g土壤培养20min后消耗的0.1mol·L-1KMnO4的毫升数表示;蔗糖酶采用Na2S2O3滴定法测定,其活性以1g土壤37℃下培养24h后,所消耗的0.1mol·L-1Na2S2O3的毫升数表示;脲酶采用苯酚钠比色法测定,其活性以24h内1g土壤中NH3-N的毫克数表示;碱性磷酸酶采用比色法测定,其活性以1g土壤37℃下培养2h后,所消耗的酚的毫克数(折算为100g土中P2O5的毫克数)表示。
以上所用容器均用2%HNO3浸泡24h后使用,以避免重金属的各种可能性污染。
1.5数据分析
实验数据分析主要采用的是Microsoft Excel 2003和SPSS 17.0两种软件。利用Microsoft Excel 2003对三个平行样的平均值和标准差等进行计算;使用SPSS 17.0进行不同处理之间的多重比较,以及数据之间的相关性分析。
2 结果与讨论
有研究表明土壤酶活性与土壤微生物、土壤有机质及植物等显著相关。土壤微生物活性与蔗糖酶、脲酶、磷酸酶和过氧化氢酶活性有直接相关关系[15-16],土壤有机质的存在状况和含量会显著影响土壤酶活性,植物主要通过根系分泌物和根系分泌物作用于根际微生物区系而引起对土壤酶活性的影响[17]。
2.1锌污染对土壤酶活性的影响
随着栽培时间的增加,吊兰根际土壤中过氧化氢酶的活性逐渐变大(表1)。这可能是因为在吊兰根际土壤中,随着栽培时间的增加,根际土壤中微生物及有机质的含量增加有关。但随着土壤锌浓度的增加,过氧化氢酶的活性逐渐降低,说明重金属锌对过氧化氢酶活性有抑制作用,且在不同培养时间内,过氧化氢酶活性与重金属锌浓度之间也均达到了极显著负相关关系(表1)。
随着栽培时间的增加,吊兰根际土壤中蔗糖酶、脲酶、磷酸酶活性呈先增后减的趋势,栽培至第36天时三者活性达到最大值,之后有所降低(表2、表3、表4)。可能是在栽培初期,吊兰根际的分泌物刺激了微生物的繁殖,根毛枯死等原因使根际土壤中有机质表现出暂时的增加,从而使几种酶的活性初始表现为增长。但随着有机物质的消耗减少,微生物的活性降低,从而酶的活性出现降低。同时,土壤中的锌对这三种酶也具有一定的低浓度促进,高浓度抑制的现象。但三种酶对锌浓度的敏感程度不一样。与CK组土壤酶活性相比,在土壤锌浓度小于500mg·kg-1时,根际土壤中蔗糖酶的活性随着土壤锌浓度的增加而变大,当土壤锌浓度大于500mg·kg-1时,蔗糖酶活性随着土壤锌浓度的增加而减小;土壤锌浓度为200mg·kg-1时,根际土壤中脲酶和磷酸酶活性有所提高,当土壤锌浓度大于200mg·kg-1时,脲酶和磷酸酶活性随着锌浓度的增大逐渐变小。这种现象的原因可能是低浓度环境下,吊兰的根对锌产生一定的吸附作用,降低重金属的影响,但达到吸附饱和后,则表现出锌对微生物的抑制作用,进而降低土壤酶的活性。
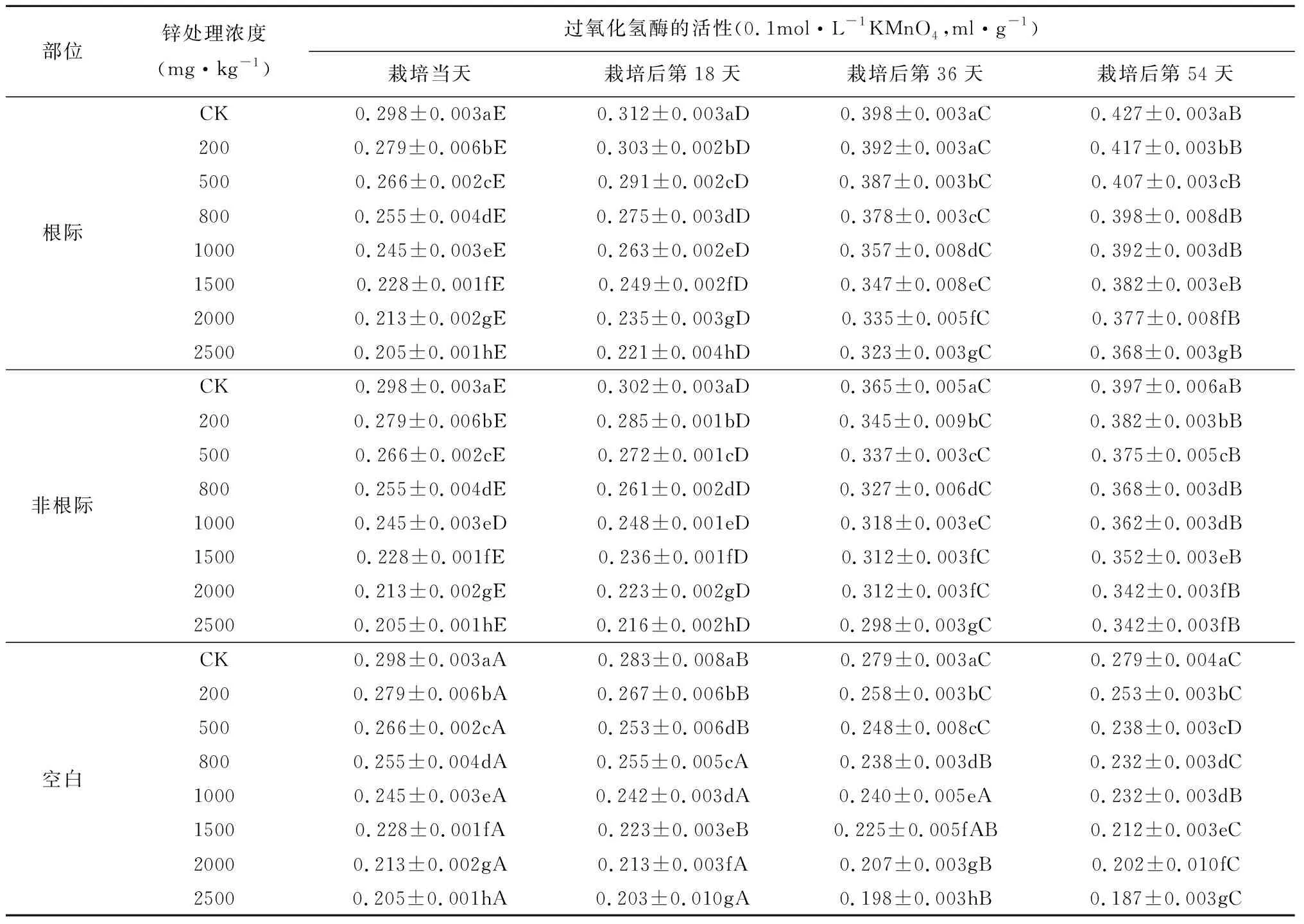
表1 锌污染对土壤中过氧化氢酶活性的影响
注:表格同一列中小写字母表示过氧化氢酶活性在同一时期不同浓度处理下的差异性;同一行中大写字母表示过氧化氢酶活性在同一浓度不同时期下的差异性(p<0.05)。下同
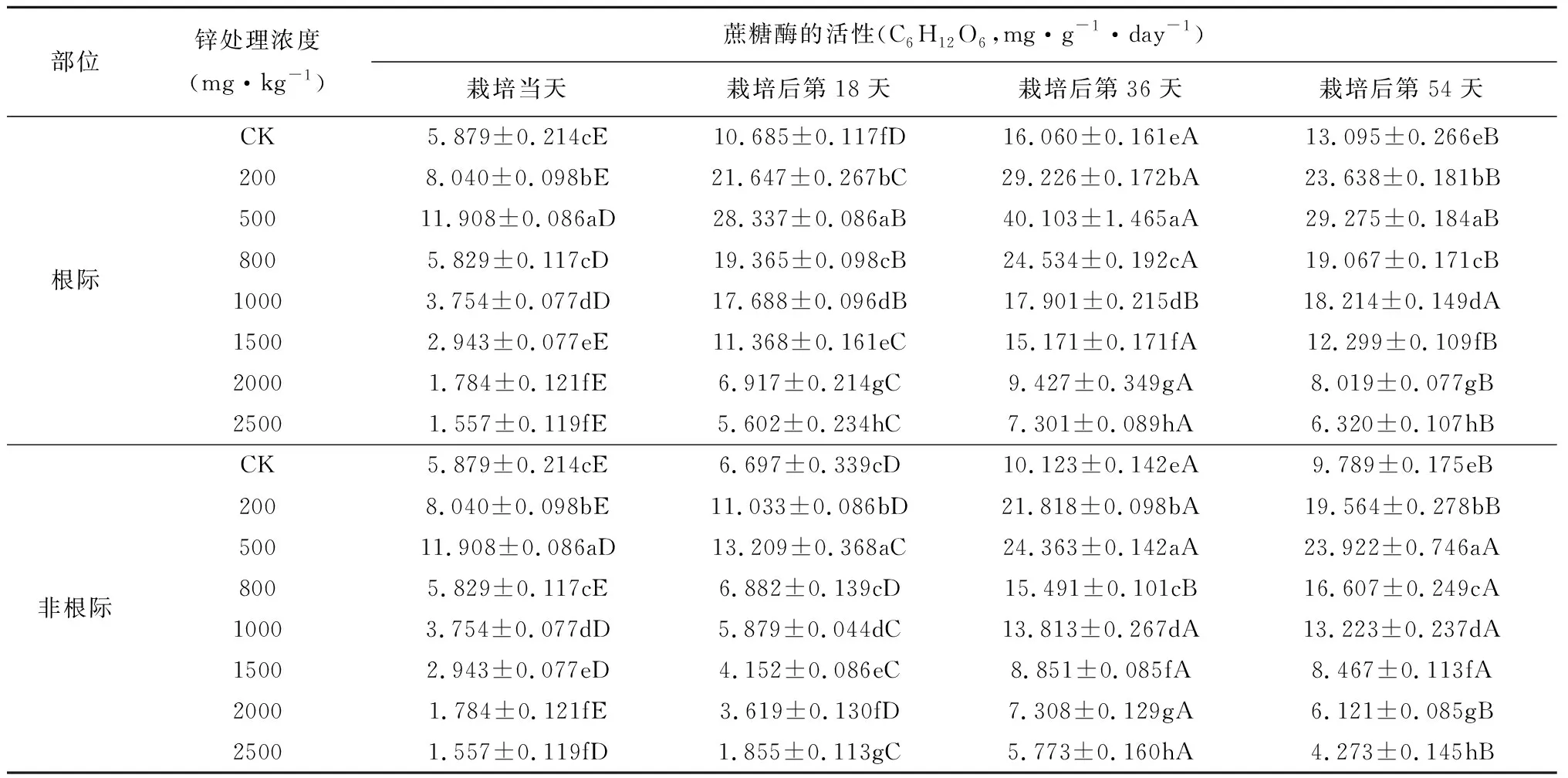
表2 锌污染对土壤中蔗糖酶活性的影响
续表2
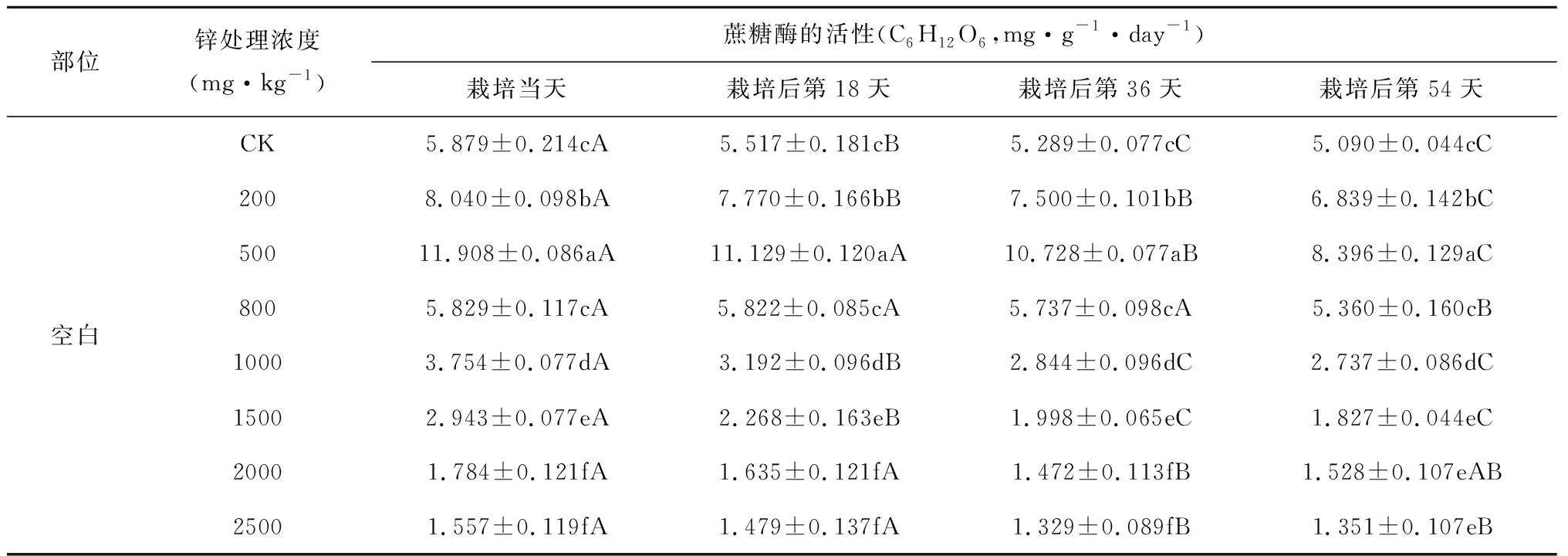
部位锌处理浓度(mg·kg-1)蔗糖酶的活性(C6H12O6,mg·g-1·day-1)栽培当天栽培后第18天栽培后第36天栽培后第54天空白CK5.879±0.214cA5.517±0.181cB5.289±0.077cC5.090±0.044cC2008.040±0.098bA7.770±0.166bB7.500±0.101bB6.839±0.142bC50011.908±0.086aA11.129±0.120aA10.728±0.077aB8.396±0.129aC8005.829±0.117cA5.822±0.085cA5.737±0.098cA5.360±0.160cB10003.754±0.077dA3.192±0.096dB2.844±0.096dC2.737±0.086dC15002.943±0.077eA2.268±0.163eB1.998±0.065eC1.827±0.044eC20001.784±0.121fA1.635±0.121fA1.472±0.113fB1.528±0.107eAB25001.557±0.119fA1.479±0.137fA1.329±0.089fB1.351±0.107eB
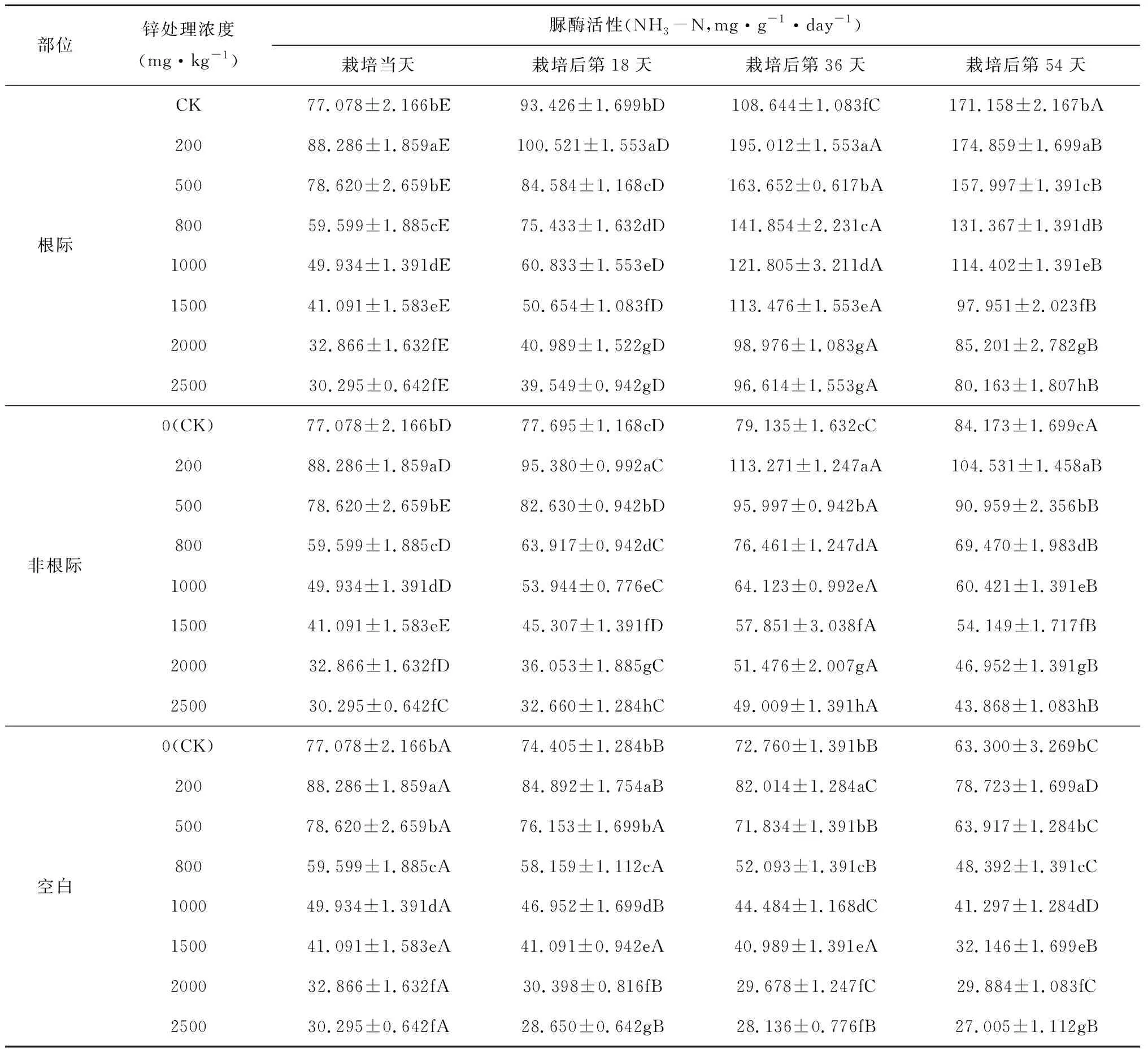
表3 锌污染对土壤中脲酶活性的影响

表4 锌污染对土壤中磷酸酶活性的影响
比较栽培吊兰的实验组与不栽培吊兰的空白组,以及吊兰根际与非根际环境可以发现,几种土壤酶活性均表现为吊兰根际土壤酶活性>非根际土壤酶活性>空白组土壤酶活性,且这种差异性在吊兰生长的不同时期均表现显著(p<0.05,如表5所示)。非根际土壤、空白组土壤中过氧化氢酶、蔗糖酶、脲酶和磷酸酶活性随土壤锌浓度的变化趋势与吊兰根际环境的变化趋势相似;非根际土壤中几种土壤酶活性随栽培时间的变化趋势也与根际环境的变化趋势相似。而空白组土壤中过氧化氢酶、蔗糖酶、脲酶和磷酸酶活性随栽培时间增加而逐渐减小,这说明种植吊兰可以有效降低锌污染对土壤酶活性的影响,提高土壤酶活性。
2.2土壤酶活性与土壤锌浓度和培养时间的相关性分析
从表6中可以看出四种土壤酶活性与栽培时间及土壤锌浓度之间的相关性显著。从影响系数可以看出根际与非根际土壤中,土壤酶活性与栽培时间之间呈正相关,而空白组土壤中酶活性与栽培时间之间呈负相关,土壤酶活性与土壤锌浓度之间呈负相关,且栽培时间对土壤酶活性的影响系数要大于土壤锌浓度对土壤酶活性的影响系数。这和培养时间增加后,土壤酶获得了一定的修复有关。
3 结 论
3.1根际土壤中酶活性随栽培时间的增加而变大,蔗糖酶、脲酶、磷酸酶活性在栽培至第36天时达到最大值,随后有所下降;非根际土壤中酶活性随栽培时间的变化趋势与根际土壤的变化趋势相似;空白组土壤因受重金属锌影响且没有吊兰修复,其土壤酶活性随栽培时间的增加逐渐降低。根际土壤中酶活性>非根际土壤中酶活性>空白组土壤中酶活性。
3.2根际土壤中过氧化氢酶活性随土壤锌浓度的增加逐渐降低,脲酶、磷酸酶活性在土壤锌浓度为200mg·kg-1时达到最高值,而蔗糖酶则在土壤锌浓度为500mg·kg-1时达到顶峰。非根际土壤、空白组土壤中酶活性随土壤锌浓度的变化趋势与吊兰根际土壤的变化趋势相似。
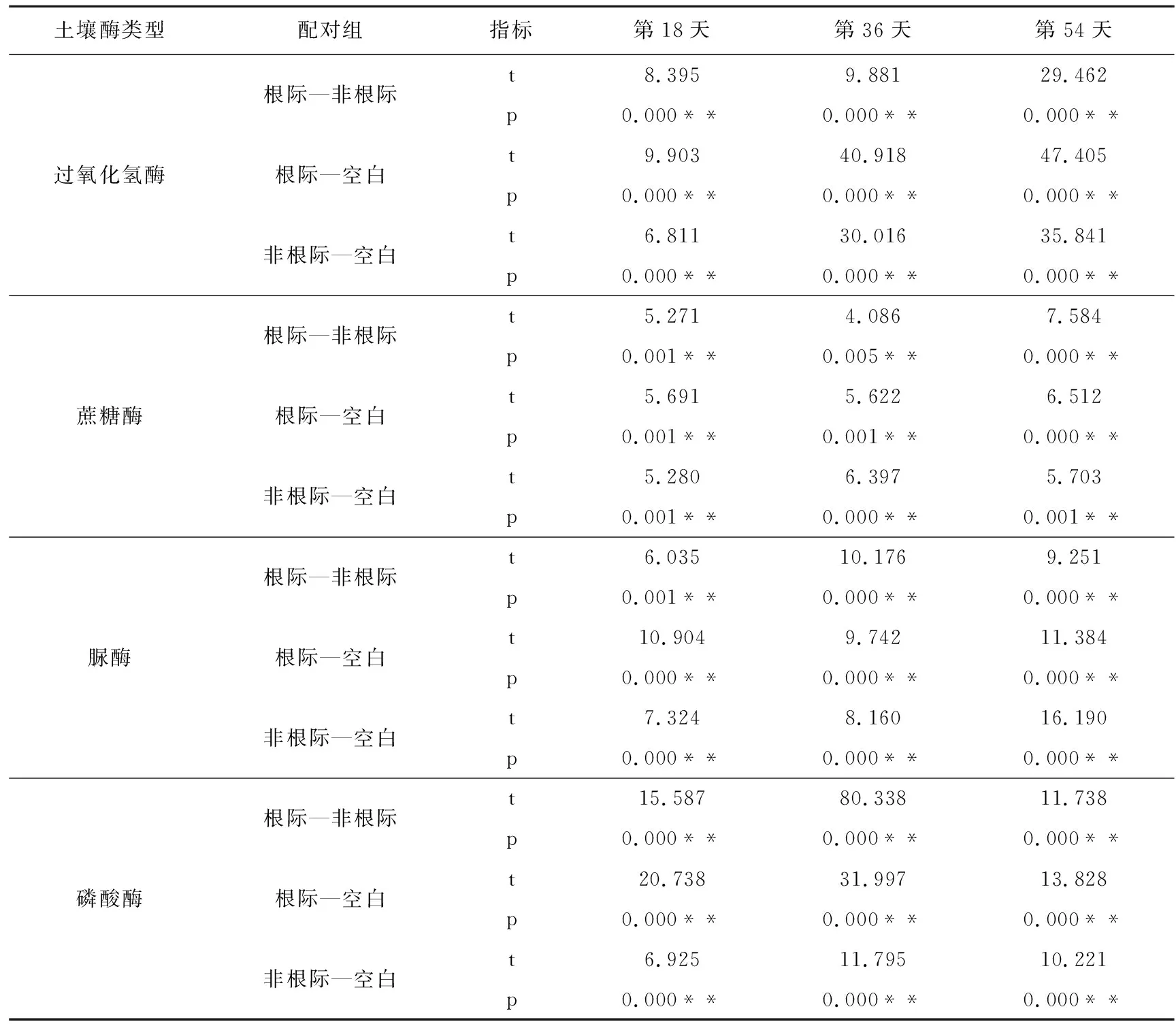
表5 根际土壤、非根际土壤、空白组土壤中土壤酶活性配对t检验
注:*代表p<0.05,差异性显著;**代表p<0.01,差异性极显著

表6 土壤酶活性与栽培时间及土壤锌浓度的多元线性回归分析
注:1:x1代表吊兰栽培天数;2:x2代表土壤锌浓度;3:*代表p<0.05,相关性显著;4:**代表p<0.01,相关性极显著
