枸杞多糖对小鼠结直肠癌肿瘤生长的抑制作用及对血管形成机制的影响
2018-08-01蒋正财陈统
蒋正财,陈统
温州医科大学附属第二医院肿瘤外科,浙江 温州 325000
结直肠癌(Colorectal cancer,CRC)是我国常见恶性肿瘤之一,2015年我国CRC患病人数男性新增21.57万,女性新增16.06万,死亡人数男性为11.11万,女性为8万[1]。近年来,抗血管治疗无论在基础研究还是临床应用中都取得了一定的成果,如贝伐单抗是美国食品药品管理局批准的一线治疗CRC的重组人源化单克隆抗体,但靶向肿瘤血管药物却存在价格昂贵、容易出现不良反应及耐药等缺点,而我国传统医药治疗肿瘤具有多靶点的特点,以及价格低廉、毒副作用小的优势,可弥补此方面的缺陷。本课题组前期实验结果表明枸杞多糖(LBP)可抑制肝癌模型小鼠血管内皮生长皮子(VEGF)的表达[2],LBP是否具有抑制CRC肿瘤血管形成的作用,其具体作用机制需要进一步探讨。
1 材料与方法
1.1 实验动物与细胞 6~8周SPF级SD大鼠2只,雌性,体质量(200±20)g,由南方医科大学实验动物中心提供,合格证号:SCXK(粤)2016-0041。6~8周SPF级Balb/c小鼠16只,雄性,体质量(20±2)g,由南方医科大学实验动物中心提供,合格证号:SCXK(粤)2016-0041,实验动物饲养于室温20~26℃、相对湿度40%~70%的环境中,昼夜明暗光照时间(12 h明/12 h暗)。小鼠CRC结直肠癌细胞株(CT26)细胞和人真皮微血管内皮细胞(HDMEC)由温州医科大学附属第二医院实验室保种。
1.2 药物、试剂与仪器 LBP(质量分数为60%,生产批号:K140828)购于中国西安开来生物工程有限公司,CD31抗体购于Abcam公司,免疫组化抗兔二抗购于中国北京中杉金桥生物技术公司;PCR引物由中国英潍捷基公司合成,DAB购于美国CST公司;matrigel购于美国BD公司,SYBR Green Mix和逆转录试剂盒购于Takara公司。二氧化碳培养箱(美国Thermo公司);超净工作台(苏州净化);白光拍摄显微镜(日本奥林巴斯)。
1.3 建立小鼠结直肠癌模型 把小鼠随机分为对照组和实验组,每组8只,将对数期生长的CT26细胞按照每只小鼠2×105个/0.2 mL接种于小鼠左侧腋前皮下。4天后可看到肿瘤长出,开始给药,依据课题组前期研究基础[3~4],LBP给药浓度为50 mg/kg,腹腔注射,每2天给药1次;游标卡尺测量肿瘤的长短径,每2天检测1次,绘制肿瘤生长曲线,共给药12天。在给药结束后,脱臼处死小鼠,肿瘤剥离后称重,放入体积分数为10%甲醛溶液固定24 h,常规脱水石蜡包埋、病理制片。
1.4 免疫组化染色 常规脱蜡-切片肿瘤组织,PBS洗3次,每次5 min,柠檬酸钠修复液(pH 6.0)高温高压热修复8 min,自然冷却后放入3%H2O2甲醇溶液37℃浸泡30min,PBS再洗3次,每次5 min,组织上加10%BSA封闭,加一抗CD31置于4℃过夜。将组织切片从封闭盒中拿出,PBS洗3次,每次5 min,于组织上加上二抗辣根过氧化物酶山羊抗兔二抗37℃孵育1 h,然后PBS洗3次,每次5 min,DAB显色10 s,流水冲掉,苏木素复染30 s流水冲洗,接着常规脱水,最后于组织上滴加适量中性树胶,盖上盖玻片,自然晾干。
1.5 大鼠动脉环实验 6~8周龄SD雌性大鼠,用乙醚麻醉后脱臼处死;将大鼠浸泡于75%酒精中2 min,放入原代细胞房操作台中,打开胸腔,沿脊柱剪下大鼠胸主动脉;将血管置于大的细胞培养皿中,放入无菌PBS洗3遍,除去血液;用精密剪、精密镊剥离干净血管周围结缔组织,用精密剪将血管剪成1 mm高圆环;在细胞传代房间超净台中,提前于4℃预冷枪头、48孔板,在冰上把matrigel 100 μL加入48孔板中,避免气泡,轻轻拍打48孔板使其分布均匀,把48孔板放入37℃细胞培养箱中15 min使matrigel凝固;用精密镊将剪好的血管环放入凝固的matrigel中,使其位于中央,再加入matrigel 100 μL,避免气泡,将48孔板放入37℃细胞培养箱中15 min使matrigel凝固。根据预实验,LBP药物浓度为500 μg/mL及1000 μg/mL两个浓度,用EBM培养基配制,500 μL/孔,每天观察血管生长情况,8天后,向48孔板中加入4%多聚甲醛固定液,室温固定30 min后拍照。
1.6 CCK 8细胞增殖实验 将CT26和HDMEC对数生长期细胞消化计数,以2000个/孔接种于96孔板中,第2天弃掉培养基,LBP药物浓度设计为0、50、100、200、500、1000 μg/mL,用培养基稀释后,每孔100 μL加入,48 h后,每孔加入10 μL CCK8,细胞培养箱孵育2 h后,酶标仪450 nm测量每孔吸光度。
1.7 QPCR检测HDMEC细胞脑组织特异性血管生成抑制因子1(B AI1)基因的表达 培养HDMEC细胞,对数期生长的细胞汇合度达到90%,消化,计数,按1.0×105个/孔铺6孔板。第2天,弃掉培养基,用EBM培养基配置500 μg/mL和1000 μg/mL的枸杞多糖用药组,对照组加入相同体积的EBM培养基,培养48 h。48 h后,弃掉培养基,PBS洗3次,弃掉PBS;RNA提取、逆转录严格按照试剂盒说明书进行,cDNA用DEPC稀释8倍后,按照试剂盒说明进行操作分析。BAI1引物序列为,上游引物:5'-CAGAGGAGCAGGTGGACAGAGAAAG-3',下游引物:5'-TCAGGA GACAGTGGAAGCAGCG-3'。
1.8 统计学方法 肿瘤组织血管密度采用Image pro plus软件对结果进行处理得出数据,血管环周长用ipp软件计算。所有数据采用GraphPad Prism 5.0软件进行作图。计量资料以(±s)表示,两组间比较采用独立样本t检验。
2 结果
2.1 LBP对CT 26小鼠结直肠肿瘤生长的影响 见图1。LBP用药组CT26 CRC小鼠肿瘤重量为(0.31±0.04)g小于对照组(0.63±0.06)g(P<0.05)(图1B);绘制肿瘤生长体积曲线,发现LBP可抑制小鼠肿瘤的生长(P<0.05)(图1A)。
2.2 LBP对肿瘤组织血管生成的影响 见图2。LBP用药组血管数(31.6±2.45)条/视野明显少于对照组(42.3±3.28)条/视野(P<0.05),表明LBP可抑制肿瘤血管的形成。
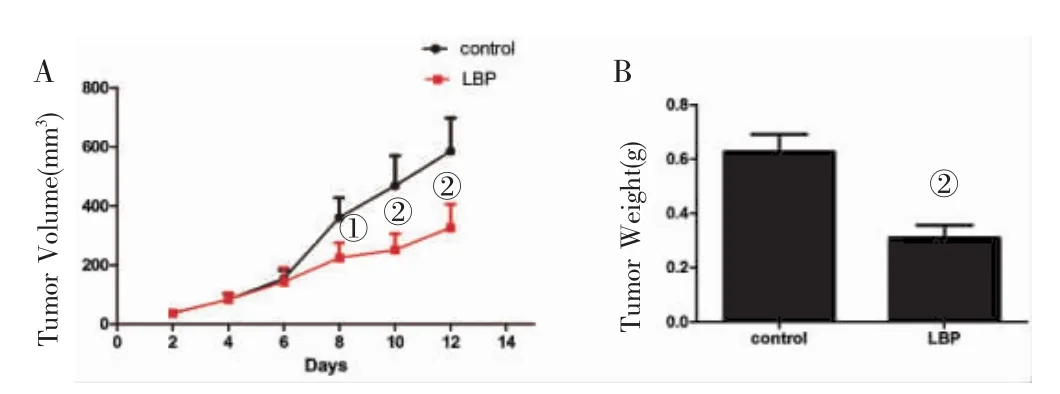
图1 LBP对CT 26小鼠结直肠癌肿瘤生长的影响
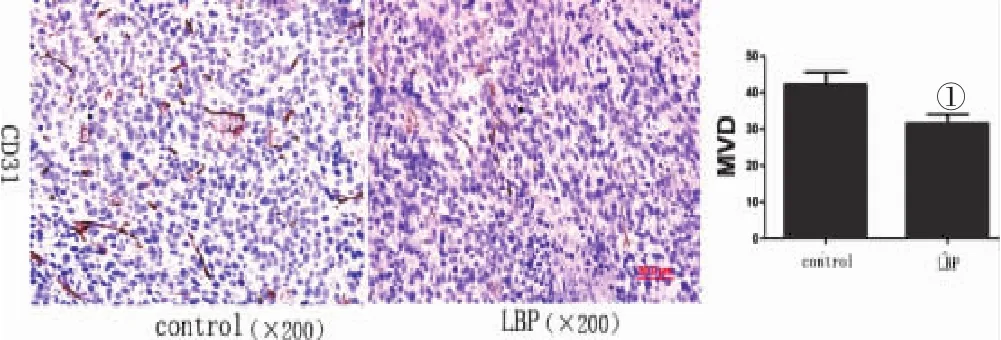
图2 LBP对肿瘤组织血管生成的影响
2.3 LBP对大鼠动脉环血管形成的影响 见图3。观察动脉环周围新生成的血管数量,LBP用药剂量分别在500 μg/mL和1000 μg/mL时血管数明显少于对照组,表明LBP对大鼠动脉环血管形成具有抑制作用,且与浓度相关。
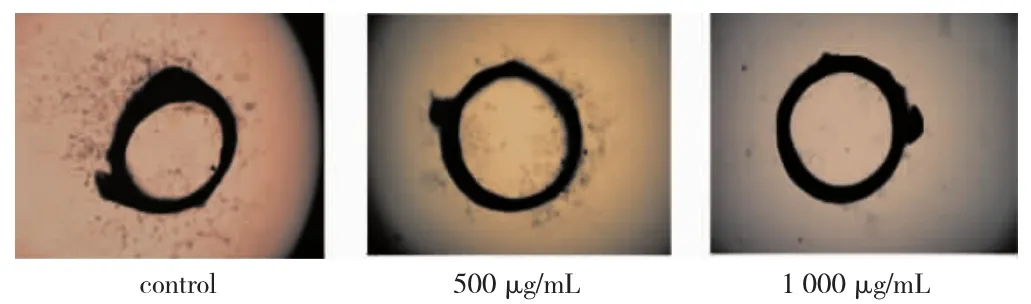
图3 LBP对大鼠动脉环血管形成的影响(×60)
2.4 LBP对CT 26及HDMEC细胞增殖的影响 见图4。LBP药物浓度设定在0~1000 μg/mL之间,随着浓度的增加,LBP对小鼠CRC CT26细胞(图4A)及HDMEC细胞(图4B)增殖均无明显的影响。
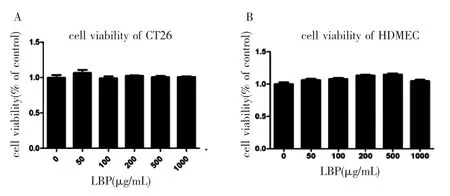
图4 LBP对CT 26及HDMEC细胞增殖的影响
2.5 LBP对HDMEC内皮细胞B AI1表达的影响 见图5。与对照组比较,LBP 500 μg/mL及1000 μg/mL处理HDMEC后,BAI1 表达上调(P<0.01)。
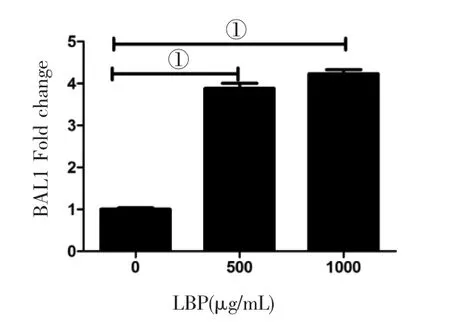
图5 LBP对HDMEC内皮细胞B A I1表达的影响
3 讨论
恶性肿瘤侵袭与转移是治疗失败的主要原因,血管形成为肿瘤细胞提供了丰富的氧及营养物质,为促进其恶性生物学行为创造了条件[5]。抗血管生成药物通过切断恶性肿瘤细胞的养分补给,并阻断侵袭转移的血行通道,使肿瘤细胞静止于休眠状态,因此,以抑制肿瘤血管形成为目的生物治疗受到广大研究者关注。
研究证实许多中药具有抗血管作用,例如蜂毒素、去甲斑蝥素、蟾毒灵三种抗肿瘤中药对人体肝癌细胞HepG2细胞及人脐静脉内皮细胞ECV304细胞的生长均有不同程度抑制作用,在一定范围内呈浓度和时间的依赖性,鸡胚绒毛尿囊膜实验证实三种药物不同浓度均能抑制肿瘤血管形成[6]。潘子民等[7]研究发现人参皂苷Rg3可通过下调肿瘤VEGF2 mRNA及蛋白的表达量,阻滞肿瘤血管生成。中医药治疗肿瘤具有多靶点的特点,以及价格低廉、毒副作用小的优势,可弥补靶向抗肿瘤血管治疗方面的缺陷,从而为肿瘤的治疗开辟更好的途径。
课题组前期实验结果表明LBP可抑制肝癌模型小鼠VEGF的表达[2],同时发现LBP可抑制自发乳腺癌小鼠肿瘤生长及减少肿瘤间质血管形成[4]。本研究在体内实验中,采用CT26结直肠癌小鼠肿瘤模型,LBP整体给药情况下,与对照组比较,LBP对结肠癌小鼠肿瘤的生长亦具有一定的抑制作用,采用免疫组织化学检测发现肿瘤间质血管在用药后明显减少。进一步通过大鼠动脉环实验发现LBP可抑制血管形成;但体外细胞培养,CCK8细胞增殖实验却没有发现LBP对小鼠结肠癌细胞CT26及HDMEC增殖的抑制作用,说明LBP对肿瘤生长的抑制作用与直接杀伤肿瘤细胞或者抑制血管内皮细胞的增殖无明显的关系,有可能是通过一些复杂的体内微环境因素抑制了内皮细胞的功能和血管的形成。BAI1特异性表达在脑组织内,属于G蛋白偶联受体的B家族,具有抑制血管生成作用[8]。QPCR检测LBP可促进BAI1表达上调,其抑制血管形成机制是否是通过上调BAI1表达实现的,还需要进一步探明。由于中药抗肿瘤作用具有多靶点的特征,其体内抑制肿瘤生长及抑制血管形成的具体机制需要深入研究。
