海南省温郁金炭疽病的病原鉴定
2018-08-01郑妃庆谢昌平
马 瑞, 徐 刚, 郑 樊, 郑妃庆, 谢昌平
(海南大学热带农林学院,热带作物种质资源保护与开发利用教育部重点实验室, 海口 570228)
温郁金CurcumawenyujinY.H.ChenetC.Ling作为我国应用最广的药用植物之一,已有1 000多年的种植历史,属姜科姜黄属草本植物,原产于浙江瑞安,是著名的“浙八味”之一[1]。其根茎中挥发油和姜黄素类化合物含量高,有效成分可以预防和治疗癌症,除此之外,在保肝、抗氧化、抗炎症等方面也有着良好的效果[2]。
近年来,海南省开始引进种植温郁金,随着栽培面积的不断扩大,病害也日益突出,尤其是新发现的炭疽病蔓延迅速,其主要危害温郁金的叶片,产生褐色的病斑,造成叶片卷缩和枯死,重病区发病率达到90%以上,严重影响了温郁金的产量和药理品质,造成了巨大的经济损失,准确鉴定病原种类对了解病害流行规律及有效控制病害发展非常重要。
目前国内外已报道的温郁金病害有白绢病[3]、根腐病[4]、枯萎病[5]、叶斑病[6]和叶枯病[7-10],本试验于海南省的温郁金种植基地采集炭疽病叶片,通过对病原菌的分离纯化、形态观察、致病性测定以及多基因序列分析,最终确定其病原菌,以期为该病害的防治提供理论依据。
1 材料与方法
1.1 材料
材料来源:于2016年9月在海南省海口市、澄迈县和临高县的温郁金种植基地采集具有典型发病症状的温郁金炭疽病叶标本。
试剂:真菌总DNA提取试剂盒E.Z.N.A.®Fungal DNA Mini Kit,美国OMEGA Biotek公司;2 × MasterMix,北京博迈德生物技术有限公司;2000 marker,北京博迈德生物技术有限公司;引物,北京六合华大基因科技有限公司广州分公司。
仪器:BX51研究系统显微镜,日本奥林巴斯株式会社;G1000基因扩增仪,杭州博日科技有限公司;600+电泳仪,北京君意东方电泳设备有限公司;WD-9413B凝胶成像分析仪,北京市六一仪器厂。
1.2 方法
1.2.1 病原菌的分离与纯化
采用组织分离法分离病原菌[11],取发病典型的病叶,在病健交界处切取大小为5 mm×5 mm的组织块,先用75%乙醇浸数秒后,再用0.1%升汞表面消毒1~2 min,然后用无菌水冲洗3次,将其转移到PDA平板上,于28℃恒温培养箱中光照培养。待菌种产孢后,采用琼脂平板稀释纯化法[12]进行纯化,将纯化的菌株转入试管斜面保存。
1.2.2 柯赫氏法则验证
选取长势一致的健康温郁金植株,用75%乙醇对叶片进行表面消毒后,用无菌水冲洗干净,用灭菌针刺伤叶片,切取直径5 mm的菌饼接种在叶片伤口处,每个叶片贴接4个菌饼,并外加浸有无菌水的纸巾保湿,再用喷湿的保鲜袋套住,置于自然环境下培养,以接种PDA培养基作为空白对照。每处理5次重复,共接种10株。每天观察发病情况,对发病叶片进行病原菌的重分离。
1.2.3 病原菌形态特征的观察
将直径为5 mm的菌饼接种到PDA平板中央,置于28℃恒温光照培养箱内培养。每天观察菌丝的生长情况及菌落形态,培养10 d后,挑取培养物在显微镜下观察分生孢子盘及分生孢子,记录其形态特征并测量分生孢子大小。附着胞的诱发采用玻片萌发法[13],配制一定浓度(大约1×104个/mL)的孢子悬浮液,吸取少量滴在洁净的载玻片上,保湿皿保湿置于28℃下培养,48 h后观察附着胞的形态特征。
1.2.4 病原菌多基因分子鉴定
在纯培养5 d后的病原菌菌落边缘打孔,挑取适量菌饼转接至100 mL马铃薯葡萄糖液体培养基(PD)中,28℃下180 r/min振荡培养5 d。将菌丝体用3层灭菌纱布过滤,去除液体培养基,并用灭菌水冲洗菌丝体2~3次,采用OMEGA试剂盒提取病原菌的基因组DNA。分别对病原菌的核糖体内转录间隔区(internal transcribed spacer,ITS)、肌动蛋白基因(actin,ACT)、β-微管蛋白基因(β-tubulin,TUB2)、几丁质合成酶A基因(chitin synthase A,CHS-1)、3-磷酸甘油醛脱氢酶基因(glyceraldehydes-3-phosphate dehydrogenase,GAPDH)和组蛋白基因(histone3,HIS3)进行PCR扩增。PCR反应体系总体积为50 μL,包括DNA模板2 μL,正反向引物各2 μL(10 μmol/L),2×MasterMix 25 μL,以ddH2O 补足至50 μL。反应程序为:94℃预变性5 min;94℃变性30 s,各引物按相应的退火温度退火45 s(表1),72℃延伸1 min,共30个循环;最后72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测,获得与预期大小一致的核苷酸片段后,送至北京六合华大基因科技有限公司广州分公司纯化和测序。将测序获得的6个基因序列提交GenBank数据库,获得序列号,并从GenBank数据库中下载同时含有ITS、ACT、TUB2、CHS-1、GAPDH和HIS3基因的炭疽属模式菌株及其他菌株序列作为参考序列,将各菌株基因按照ITS-ACT-TUB2-CHS-1-GAPDH-HIS3的顺序首尾拼接,用MEGA 7.0软件的“W”功能比对并手工校正后,选择邻接法(neighbor-joining,NJ)构建系统发育树,以自展法(bootstrap)进行检测,共循环1 000次。
2 结果与分析
2.1 田间病害症状
温郁金炭疽病主要为害叶片,偶见为害叶鞘。田间发病多从中下层叶片开始(图1a),发病初期叶片或叶鞘出现水渍状的淡黄色椭圆形病斑(图1b,c),随后逐渐扩大为圆形、卵圆形或不规则形,边缘深褐色,微具轮纹,中心灰白色至灰褐色,病斑外环绕黄色晕圈(图1d,e)。病斑正面有许多轮生状黑色小点,即病原菌的分生孢子盘(图1f)。病斑可在叶片的任何部位发生,严重时多个病斑联合成片,造成叶片卷缩和枯死。
表1扩增温郁金炭疽病病原菌不同序列所用的引物
Table1Primersusedinthisstudy

基因Gene退火温度/℃Annealing temperature引物Primer name引物序列(5'-3')Primer sequenceITS55ITS1ITS4TCCGTAGGTGAACCTGCGGTCCTCCGCTTATTGATATGCACT58ACT-512FACT-783RATGTGCAAGGCCGGTTTCGCTACGAGTCCTTCTGGCCCATTUB259T1βt2bAACATGCGTGAGATTGTAAGTACCCTCAGTGTAGTGACCCTTGGCCHS-159CHS-79FCHS-354RTGGGGCAAGGATGCTTGGAAGAAGTGGAAGAACCATCTGTGAGAGTTGGAPDH59GDFGDRGCCGTCAACGACCCCTTCATTGAGGGTGGAGTCGTACTTGAGCATGTHIS355CYLH3FCYLH3RAGGTCCACTGGTGGCAAGAGCTGGATGTCCTTGGACTG

图1 温郁金炭疽病的田间症状和人工接种的症状Fig.1 Symptoms of Curcuma wenyujin anthracnose in the field and after artificial inoculation
2.2 病原菌的分离
从海南省海口市、澄迈县和临高县的温郁金种植基地采集具有典型发病症状的温郁金叶片20片,通过病原菌的分离共得到6个显微形态一致的疑似病原菌,将菌株分别进行编号并用于后续试验。
2.3 柯赫氏法则验证
将分离得到的6个菌株分别接种到健康的叶片上,7 d后针刺法接种的植株都出现了与田间自然发病一致的症状:叶片上病斑呈黄色水渍状,渐变成近圆形,边缘暗褐色,有明显的黄色晕圈,后期病斑中心呈灰白色,内轮生许多小黑点(图1g,h)。对这些病斑组织再次进行病原菌分离,获得与原接种菌株形态特征一致的菌落和分生孢子,符合柯赫氏法则;而对照组植株均未发病(图1i),也未分离到病原菌。由此确定,分离得到的菌株是引起温郁金炭疽病的病原菌。
2.4 病原菌的形态特征
病原菌在PDA培养基上形成圆形、平坦、边缘整齐的菌落,菌落初期为白色,气生菌丝绒毛状,2 d后可见菌落底部墨绿色小点(分生孢子盘),之后菌落逐渐由白色变为深橄榄绿色,15 d后菌落表面产生淡黄色至浅橙色的分生孢子堆(图2 a, b)。载孢体盘状,多聚生,黑色,顶端不规则开裂。刚毛散生于载孢体上,数量较多,暗褐色,顶端较尖,色淡,具有2~4个隔膜,基部平齐。分生孢子新月形,基部微钝,顶端稍尖,无色,单胞,内部含有1个油球,大小为(21.6~28.8)μm×(3.0~5.7)μm(图2c,d)。附着胞棒形或椭圆形,全缘褐色,极少数为不规则形,大小为(6.68~18.87)μm×(4.95~9.05)μm(图2e,f)。病原菌形态特征与郁金炭疽菌Colletotrichumcurcumae(Syd.) E.J. Butler & Bisby形态特征基本一致[14-15]。

图2 病原菌菌落、分生孢子及附着胞形态特征Fig.2 Morphology of the colony, conidium and appressorium of the pathogen
2.5 病原菌多基因系统发育分析
由于分离获得的6个菌株在PDA培养基上的培养性状和形态特征一致,因此,选取菌株TJ0709作为代表菌株进行分子鉴定。对病原菌TJ0709的ITS、ACT、TUB2、CHS-1、GAPDH和HIS3基因进行扩增,分别得到542、265、740、275、290和380 bp的片段(图3)。序列克隆测序后,与参考基因进行比对,系统发育树显示,病原菌TJ0709与郁金炭疽菌C.curcumae模式菌株(IMI 288937)聚为一个进化枝,并且支持率为100%(图4)。结合病原菌形态特征和多基因系统发育树,鉴定温郁金炭疽病病原菌为郁金炭疽菌C.curcumae。

图3 病原菌TJ0709菌株的PCR产物Fig.3 PCR products of the pathogen TJ0709 with six primer pairs
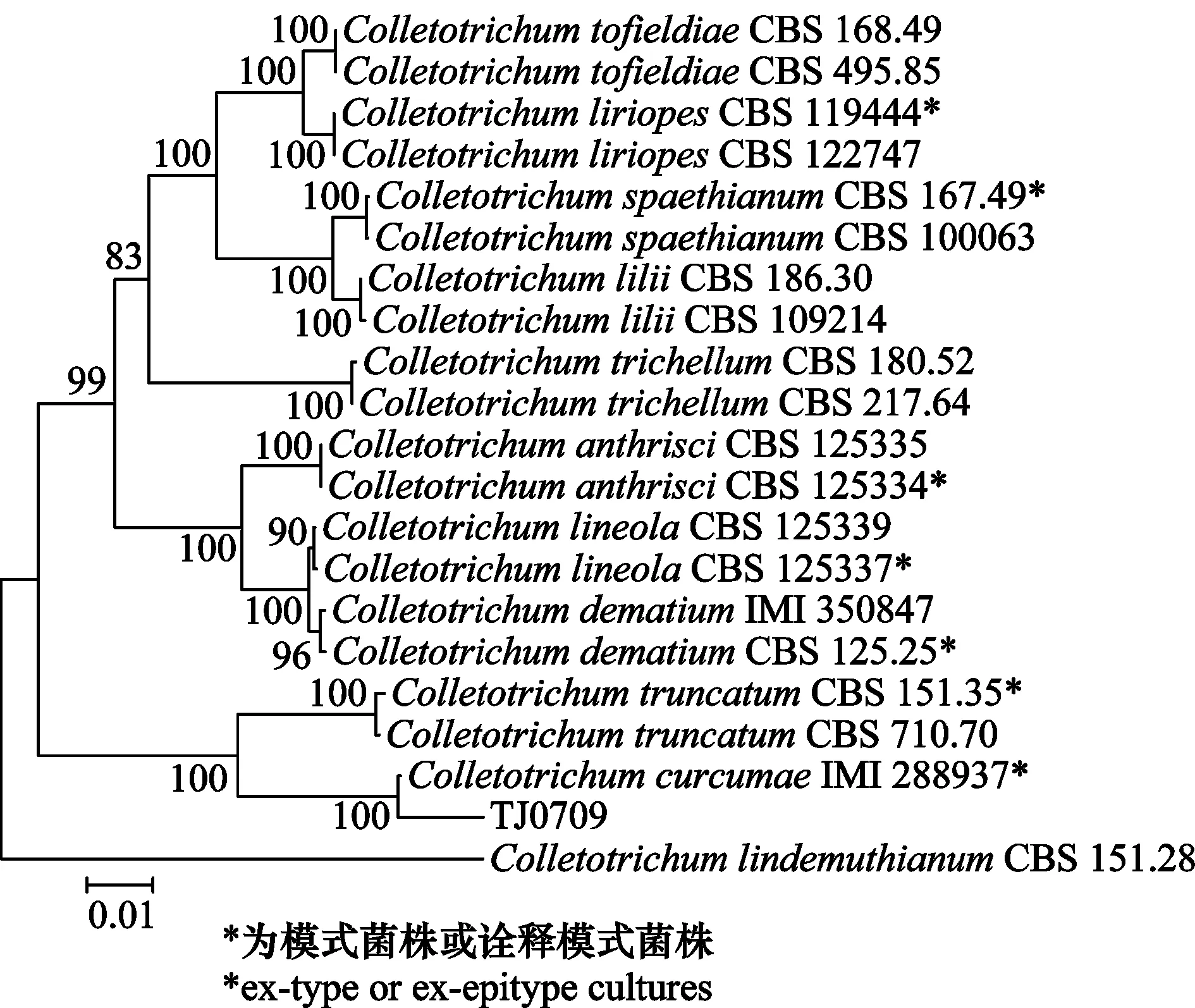
图4 基于ITS、ACT、Tub2、CHS-1、GAPDH和HIS3 基因合并序列构建的温郁金炭疽病菌系统发育树Fig.4 Phylogenetic tree of Curcuma wenyujin anthracnose pathogen based on concatenated sequences of ITS, ACT, Tub2, CHS-1, GAPDH and HIS3 genes
3 讨论
本研究通过对采自海南省海口市、澄迈县和临高县的温郁金炭疽病叶片进行病原菌的分离纯化,将分离菌株进行室外活体接种可使温郁金发病,回接病叶再分离,可得到与原分离菌形态特征一致的菌株,经柯赫氏法则验证分离菌株即为温郁金炭疽病的病原菌。通过对病原菌的形态观察,发现其与郁金炭疽菌Colletotrichumcurcumae(Syd.) E.J. Butler & Bisby形态特征基本一致,对病原菌的ITS、ACT、TUB2、CHS-1、GAPDH和HIS3基因进行联合分析,系统发育树结果显示,病原菌与郁金炭疽菌C.curcumae模式菌株(IMI 288937)聚为一个进化枝,并且支持率为100%,其他分支中,同种菌株间也以非常高的支持率聚在一起,结合形态学特征和多基因系统分析结果鉴定温郁金炭疽病的病原菌为郁金炭疽菌C.curcumae,与Li等[6]报道的广西温郁金叶斑病的病原一致,两种病害症状相同,但鉴于病原菌为炭疽属真菌,笔者认为将该病害称为温郁金炭疽病更为合适。郁金炭疽菌C.curcumae是一种比较特殊的炭疽菌,目前国内外对其报道较少,Palarpawar和Ghurde曾报道过其寄主有姜黄、尾桴草、百慕大、芋和茄属植物[16],Damm等运用ITS、ACT、TUB2、CHS-1、GAPDH和HIS3基因进行联合分析,对形态上极难区分的草本植物上分离的炭疽菌属真菌区分开来,并将郁金炭疽菌C.curcumae归类为平头炭疽菌复合种[15]。由郁金炭疽菌C.curcumae引起温郁金炭疽病在海南尚属首次发现。
温郁金的主要叶部病害还有叶枯病,该病害与温郁金炭疽病的不同在于发病位置主要集中在叶尖和叶缘,初期叶尖最先变黄,形成黄褐色的不规则病斑,随后逐渐扩大并沿主叶脉向上蔓延,导致叶片枯萎下垂,病斑上不会出现黑色小点。Qian等[10]报道了浙江省温郁金叶枯病的病原菌为拟康宁木霉Trichodermakoningiopsis,Chen等[7]对海南省温郁金叶枯病进行了病原鉴定,认为其病原菌为弯孢霉Curvulariaclavata,并研究了其生物学特性及室内药剂筛选。近几年海南省温郁金叶枯病的发病率已经降低了很多,而温郁金新病害炭疽病有逐渐加重的趋势,并且已成为制约海南省温郁金生产发展的重要因素,常成片发病,重病区发病率达到90%以上,造成了巨大的经济损失。据调查,温郁金炭疽病在夏季雨季过后发病最为严重,说明高温高湿的条件有利于病害的传播。因此,在海南夏秋多雨季节,应避免温郁金种植基地通风不良、密植或浇水过多的情况发生,除此之外,农事操作中,要注意尽量避免伤口,防止病菌的侵入,开展针对温郁金炭疽病的抗病品种选育和无病种苗繁育工作,改进栽培措施,筛选高效防治药剂,从而有效控制温郁金炭疽病的发生和蔓延。
