不同发酵条件对瓜类细菌性果斑病菌感染 西瓜种子的影响
2018-08-01徐秀兰赵子婧宋顺华宫国义张海军
徐秀兰, 芦 钰, 赵子婧, 吴 萍, 宋顺华, 宫国义, 张海军
(1. 北京市农林科学院蔬菜研究中心, 农业部华北地区园艺作物生物学与种质创制重点实验室,农业部都市农业(北方)重点实验室, 北京 100097; 2. 中国农业大学植物保护学院, 北京 100193)
瓜类细菌性果斑病(bacterial fruit blotch,也称果腐病)是由西瓜嗜酸菌Acidovoraxcitrulli(曾命名Pseudomonaspseudoalcaligenessubsp.citrulli;Acidovoraxavenaesubsp.citrulli)引起的,可造成西甜瓜减产甚至绝收的毁灭性病害[1-2]。病原菌A.citrulli还可侵染哈密瓜、南瓜、西葫芦、丝瓜、苦瓜、黄瓜等多种葫芦科作物[3-4]。自20世纪90年代细菌性果斑病在美国的西瓜种植田大暴发以来,近20年该病在全球多个国家迅速传播。瓜类细菌性果斑病传播迅速,主要与A.citrulli通过种子传带(seed transmission)和日益频繁的国际种子贸易相关[5]。目前果斑病在我国北京、山东、新疆、东北、江苏、海南等多个省市及地区均有危害,不仅给我国的西甜瓜生产造成严重的损失,也对西甜瓜制种业带来了很大冲击[6]。
A.citrulli可附着在种子表面,并可长期存活于种皮下外胚乳层。制种田田间病害监控、种子检测、种子处理是病害防控的首要环节。我国西瓜种子采收过程中,往往采用发酵方法脱去种子上连带的果胶,然而发酵过程对西瓜嗜酸菌的种子感染是否有影响还未见研究报道。本文主要通过控制不同的发酵时间和温度,研究果斑病菌在发酵过程中对西瓜种子的感染情况,揭示发酵时间和温度条件对种子带菌的影响,从而指导病害防控。
1 材料与方法
1.1 菌株培养
菌株:Acidovoraxcitrulli(编号:Xu 3-14)分离自北京顺义西瓜发病幼苗,REP-PCR分型为I型。菌株悬浮于15%甘油,保存在-80℃冰箱中。菌株活化培养采用PF培养基(蛋白胨20 g/L,琼脂15 g/L,甘油10 mL/L,1 mol/L 磷酸氢二钾14 mL/L,1 mol/L 硫酸镁 24 mL/L),于28℃培养箱中培养24~48 h。
1.2 西瓜种子发酵与接种
从制种田挑取健康成熟西瓜果实(品种:‘京欣’),果皮清洗消毒后,纵切,掏取种子,放入灭菌的烧杯。每个烧杯放入300 粒种子,100 mL西瓜汁。用摇培24 h的A.citrulliXu 3-14配制菌液,每个烧杯接种Xu 3-14菌液1 mL,其终浓度为106cfu/mL,对照为不接菌的发酵液,设置发酵培养温度分别为20℃和30℃,4个重复。烧杯放入摇床以60 r/min低速发酵培养,分别在发酵12、24、36、48、60 h时取样测量发酵液pH,并取1 mL发酵液进行梯度稀释,涂布于PF培养基上进行分离培养,检测A.citrulli菌量。分别在24、48、60 h时随机选取100粒种子,冲洗3次,室温自然晾干48~72 h,作为种子带菌检测的样本。
1.3 西瓜种子带菌检测
对不同发酵温度、不同发酵时间取出的种子进行种子带菌分析。分别检测种子外部和内部带菌量(分为种皮内部带菌率及种仁带菌率)。种子外部带菌量的检测方法:将待检种子(50粒/重复,4个重复)浸入20 mL磷酸钾缓冲液(80.2 mmol/L K2HPO4, 19.2 mmol/L KH2PO4, pH 7.4)中,使用脉冲振荡样品前处理器(HKM shockmixer-1)以93次/s速度振荡15 s,随后以28℃,120 r/min条件摇培4 h,取出后再次剧烈振荡15 s,将浸提液转移到灭菌的50 mL离心管中,8 000 r/min离心10 min,弃上清,将沉淀重新溶于1 mL 灭菌水中,作为原液。对原液进行梯度稀释,分别吸取10-3、10-4、10-5稀释液各100 μL,涂板于PF和半选择性培养基mEBB培养基上[7-8]。28℃培养3~5 d后,根据菌落形态挑选疑似菌落进行PCR鉴定。种子内部带菌率通过单粒检测进行测定,共检测100粒种子:对待检种子进行外部消毒(1%次氯酸钠浸泡5 min后用灭菌蒸馏水冲洗2遍),使用灭菌镊子将种皮与种仁分离、分别收集到1.5 mL离心管中,加入300 μL磷酸钾缓冲液,利用旋涡振荡器充分振荡15 s后,随后以28℃,120 r/min条件摇培4 h,取出后再次剧烈振荡15 s,浸提液直接进行涂板及分子检测。A.citrulli菌落在PF培养基上很小,呈圆形,淡黄色,菌落表面光滑;在mEBB培养基培养3~4 d后形成直径约为1~2 mm的菌落,呈圆形,培养4~5 d后,菌落继续扩大并形成橄榄绿色的中心。菌落纯化经PCR确认,并计数推算种子外部带菌量及种子内部带菌率。
1.4 西瓜出苗发病检测
对不同发酵温度下发酵不同时间的种子(50粒/重复,4个重复)进行出苗检测。以灭菌的细沙为发芽基质,25℃恒温条件培养3 d后,继而在25℃培养8 h,20℃培养16 h,保持培养箱湿度>70%。培养第5天起,每天观察子叶是否有水浸状病斑出现,出现症状后记录发病数量,为避免在高湿条件下幼苗之间的病害传播,及时将发病株取出进行荧光定量PCR检测确认。
1.5 培养菌落及病株的荧光定量PCR检测
将种子带菌检测分离培养到的典型菌落用无菌水制成108cfu/mL菌液(OD600=0.15),放入-20℃冻融后取1 μL作为反应模板。另取发病苗病健交界部位组织,放入无菌水中研磨,振荡,取1 μL作为反应模板。以A.citrulliXu 3-14为阳性对照,配制不同浓度梯度菌悬液作为PCR反应模板,以Cq值为x轴,荧光值为y轴绘制标准曲线。阴性对照为无菌水。荧光定量PCR引物和探针序列[9]为BOXAACF: GCG TAT GAG TCC CG AAG AA AT; BOXAACR2: GCA TGC CTT GTA TTC AGC TAT; AAC probe: 6-FAM-CCG AAA TCC GTA TTG GAC GGA TCG AA-BHQ1。扩增体系为25 μL,包括:2×Probe Master Mix 12.5 μL;AAC probe (20 μmol/L) 0.30 μL;BOXAACF (20 μmol/L) 0.35 μL;BOXAACR2 (20 μmol/L) 0.35 μL;灭菌H2O 10.5 μL;样品模板1 μL。反应扩增条件:95℃ 3 min;95℃ 15 s、60℃ 20 s,40个循环;40℃ 5 min。反应使用Roche罗氏LightCycler®480II仪器进行,使用仪器配套软件进行数据分析。判定Cq≤35为阳性样品,Cq>35为阴性样品。
1.6 试验设计与数据分析
整个试验重复2次。数据采用SAS 8.1和Minitab 17软件进行方差及相关性分析。
2 结果与分析
2.1 不同发酵条件下发酵液pH与A.citrulli菌量的变化
在西瓜发酵过程中,不同温度条件下(20℃, 30℃),发酵液的pH变化趋势一致。发酵液初始pH为6.5,发酵36 h内pH迅速降低,而后降低趋于缓慢。然而低温条件下发酵液的pH显著高于高温条件下的发酵液。发酵60 h,发酵液pH降低到4.0(图1)。不同温度条件下,发酵液中A.citrulli菌量变化则呈现先上升后下降的变化趋势,菌量均在发酵24 h后达到峰值1010cfu/mL,24 h后菌量呈现下降趋势(图2),发酵60 h菌量降低到106cfu/mL。不接菌的发酵液中未检测出A.citrulli。
2.2 不同发酵条件下西瓜种子带菌检测结果
种子外部检测结果表明,随着发酵时间的延长,不同温度条件下的种子外部带菌量均呈现逐渐下降趋势(表1)。两个发酵温度下,发酵24 h的种子外部带菌量均达到了108cfu,而发酵48 h和60 h的种子外部带菌量均大幅下降,降到了105cfu 左右。然而种子内部的病菌感染率只有在30℃发酵温度下有显著增高。20℃发酵条件下种皮带菌率维持在10%左右。此外,30℃发酵条件下,随着发酵时间的延长种仁带菌率略有上升,两个温度条件下相比,24 h种仁感染率较为接近,平均为1.35%;而48 h时30℃下种仁带菌率显著增高到5.5%,20℃条件下在60 h也接近5%。根据梯度涂板稀释培养菌落数计算,内部种皮的平均带菌量为1.2×103cfu/粒,种仁的带菌量为1.5×103cfu/粒。不接菌发酵液对照种子未检测出A.citrulli。

图1 不同发酵温度条件下西瓜发酵液pH的动态变化Fig.1 Kinetic changes in pH values of the watermelon fermentation liquid in 60 hours under different temperatures
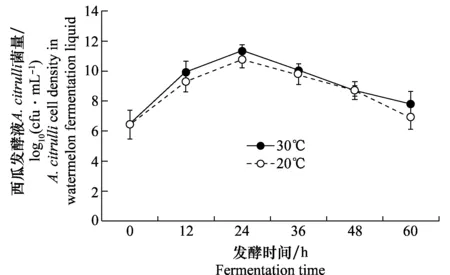
图2 不同发酵温度条件下西瓜发酵液中Acidovorax citrulli菌量的动态变化Fig.2 The kinetic changes in the bacterial cell density of Acidovorax citrulli in watermelon fermentation liquid in 60 hours under different temperatures

发酵时间/hFermentation time种子外部带菌量/log10(cfu·mL-1)Bacterial amount on the exterior of seeds20℃30℃内部种皮感染率/%Infestation rate in the interior of seed coat20℃30℃种仁感染率/%Embryo infestation rate20℃30℃24(8.6±0.3)a(7.9±0.2)a(10.8±3.6)a(9.6±1.7)b(1.4±0.9)a(1.3±0.8)a48(7.7±0.1)b(6.9±0.7)b(13.2±4.1)a(15.8±0.8)a(1.4±0.9)a(5.5±0.9)a60(4.6±0.3)c(5.0±0.7)c(10.3±1.6)a(13.8±1.8)a(4.8±2.5)a(4.1±2.2)a
1) 同一列中具有相同字母的数值表示在0.05水平差异不显著。
Values followed with the same letter listed in the same column indicate no significant difference at 0.05 level.
2.3 不同发酵条件下西瓜种子的幼苗发病率
在不同发酵温度下发酵不同时间的种子出苗后均有不同程度的发病(图3),但发病率差异不显著,均在10%左右。20℃条件下,在同等发酵时间取出的种子发病率相较于30℃略低。在30℃条件下,发酵48 h后,种子发病率达到峰值,为11.7%,而在20℃条件下,种子发病率的最高值发生在发酵60 h后,为10.1%。结果表明西瓜种子发酵过程中,发酵液混入微量A.citrulli菌情况下,会导致西瓜幼苗发病,发病率接近10%。虽然20℃条件下发病率略低,发酵温度对种子出苗发病率的影响并不显著。不接菌发酵液对照种子幼苗生长正常,无发病。
2.4 发酵条件与种子内外感菌程度的相关性分析
两次独立试验结果趋势一致,综合分析,发现西瓜种子发酵过程中发酵温度对于A.citrulli感染种子没有显著影响,而发酵时间对种子外部带菌量有显著影响。发酵温度、时间对种子内部带菌和出苗发病率没有显著影响,温度与时间的互作也不显著(表2)。
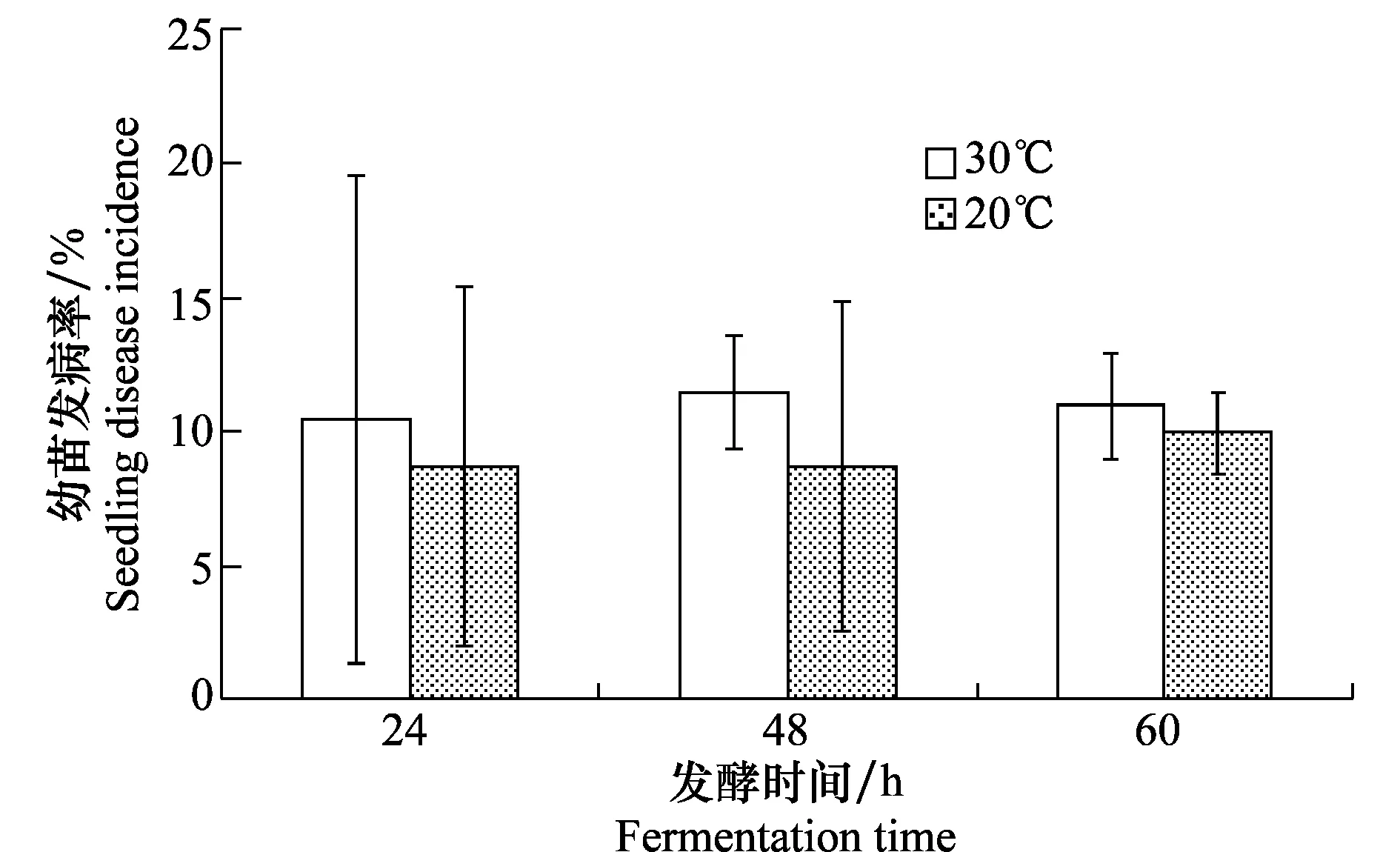
图3 不同发酵时间、温度条件下收获的西瓜种子 出苗发病率比较Fig.3 Disease incidence of watermelon seedlings germinated from the seed harvested under different fermentation times and temperatures

影响因素FactorP值 P value种子外部带菌量Bacterial amount on theexterior of seed种皮内部带菌率Infestation rate in theinterior of seed coat种仁带菌率Embryo infestation rate出苗发病率Seedling disease incidence发酵温度0.233 60.910 00.656 10.393 3发酵时间<0.000 1*0.866 70.459 70.670 9发酵时间×发酵温度0.133 80.840 40.849 50.908 1
1)*表示显著(P<0.05)。
*indicates significant difference (P<0.05).
对发酵液pH、发酵液菌量、种子外部带菌量、种子内部带菌率和出苗发病率各个指标之间的相关性进行分析,发现发酵液pH、发酵液中的菌量和种子内部带菌量有显著相关性(P<0.05)。其中发酵液pH与发酵液菌量的相关系数较高(R2=0.843,图4),回归曲线显示发酵液pH偏低时(5.0~6.0)适宜A.citrulli生长,而pH低于4.0时A.citrulli生长有停滞消亡的趋势。
3 讨论
本项研究首次比较系统地监测了不同温度条件下,西瓜发酵过程中发酵液中西瓜嗜酸菌的增殖动态,分析了不同发酵条件对种子感染病菌的影响。研究表明,发酵液中西瓜嗜酸菌迅速增殖,并在发酵24 h时可以侵染至种子内部种皮与种仁,发酵温度对A.citrulli侵染种子的影响不大。

图4 发酵液pH与发酵液Acidovorax citrulli菌量的 相关回归曲线Fig.4 Regression analysis between pH value and Acidovorax citrulli cell density in fermentation liquid
已有研究报道认为A.citrulli感染西瓜种子的途径有两类:(1)发病果实引起种子带菌。Rane和Latin[10]发现田间自然发病与人工接种后表现症状的果实采收的种子种皮和内部胚可携带病菌,而无症状表现的果实采收的种子则没有传带A.citrulli。(2)不发病潜伏感染的果实也可产生带菌的种子。近年来美国Walcott研究组发现:温室条件下接种花的雌蕊柱头,虽然果实不表现症状,但果瓤和种子均带菌[11-13]。通过以上研究推断通过雌花的柱头感染A.citrulli是田间产生无症状果实,造成种子内部带菌,引起病害流行的原因。然而值得注意的试验细节是花接种的浓度在107~109cfu/mL,在田间无病害症状表现或病害大规模流行的情况下,这样高浓度的菌量落到雌蕊的几率很小,在这样的制种田间采收到的带菌种子,其实际感染源有待讨论。
然而西瓜种子除了在发育过程中会受到感染以外,也有可能在采收和制种过程中受到感染。从西瓜果实取出果瓤和种子后,一般经24 ~ 48 h发酵,清洗,干燥的过程。制种者将包裹着种子的瓜肉堆积,通过发酵,使西瓜果肉与种子彻底脱离,便于种子的收集,也有利于种子内部代谢,便于种子萌发[14]。然而西瓜采收过程中,易混入土壤,杂草或潜伏感染的果实。虽然Hopskin等[15]报道认为发酵使 pH降低,并不适合病原菌生存,本项研究也发现发酵液的pH逐渐降低,然而发酵前期A.citrulli快速繁殖,大大增加了对健康西瓜种子的感染几率,不仅是种子外部的附着,也伴随着内部种皮与种仁的侵染。发酵24 h后种皮内部带菌率10%,种仁带菌率1%,由此推测病菌通过气孔,种脐进入种子内部。
现有种子处理方式,无论物理方法或是化学方法,主要针对种子外部携带真菌及细菌,对于种子内部带菌目前没有十分有效的种子处理方法。发酵作为西瓜种子采收的步骤增加了细菌性果斑病的感染几率,为了从初侵染源防控这一重要的检疫性病害的种子传带,建议在发酵过程中使用果胶酶以缩短发酵时间,或者加入适当的化学药剂杀菌。
