诱导小麦抗叶锈病生防细菌的筛选、鉴定 及其防效评价
2018-08-01陈立杰王媛媛朱晓峰刘晓宇范海燕段玉玺
徐 爽, 陈立杰, 王媛媛, 朱晓峰, 刘晓宇, 范海燕, 段玉玺
(沈阳农业大学植物保护学院, 沈阳 110866)
小麦叶锈病由Pucciniatriticina引起,是世界小麦生产上的主要病害之一,发生严重时可使小麦减产40%以上[1]。在我国主要麦区曾发生4次中度以上的小麦叶锈病大暴发,给小麦生产带来严重的产量损失[2-3]。近年来该病害在我国呈现扩大发展的趋势,2012 年在甘肃、河南、陕西、安徽和四川等地小麦叶锈病大面积发生[4],2015年和2016年黄淮麦区小麦叶锈病也较往年发生提前了近一个月[5]。
小麦叶锈病的防治方法多以选用抗病品种和化学防治为主[6]。化学杀菌剂的使用易使病原菌产生抗药性,污染环境,危害生态平衡[7]。而具有防效好、无毒性、无污染等特点的生物防治也成为学者们的研究热点[8]。利用生防菌防治小麦条锈病已有报道。Pang等[9]和Li等[10]研究表明恶臭假单胞菌Pseudomonasputida和枯草芽胞杆菌Bacillussubtilis均可抑制锈菌的夏孢子侵染,并诱导小麦抗条锈病。但对小麦叶锈病的生物防治报道却不多[11]。因此,利用生防菌诱导防控小麦叶锈病具有十分重要的意义。
生防菌可诱导植物产生诱导抗病性,进而起到防治病害的作用。利用植物根际促生菌(plant growth promoting rhizobacteria,PGPR)诱导植物防控植物病害在国内外已被广泛报道,Chowdappa等[12]用枯草芽胞杆菌B.subtilis和哈茨木霉Trichodermaharzianum诱导番茄对晚疫病产生抗性;Yoshioka等[13]用棘孢木霉T.asperellum诱导水稻对细菌性叶斑病产生抗性。芽胞杆菌作为重要的生防因子,利用其诱导植物产生抗病性的研究也有很多。项鹏等[14]发现简单芽胞杆菌B.simplexSneb545可诱导大豆抑制大豆孢囊线虫Heteroderaglycines的入侵;Niu等[15]发现蜡样芽胞杆菌B.cereus可诱导番茄产生防御反应,抵抗灰霉菌Botrytiscinerea的侵染。
本研究通过大田初步筛选试验获得3株抗小麦叶锈病的生防细菌,室内测定其促生作用和防治效果,获得最优菌株Sneb1462,进一步对Sneb1462菌株进行鉴定和田间防效试验验证,探讨其作为生防菌株防治小麦叶锈病的应用潜力。
1 材料与方法
1.1 供试材料
3株细菌菌株Sneb1197、Sneb1289、Sneb1462经过大田筛选获得,由沈阳农业大学北方线虫研究所提供。小麦品种‘新春20’和病原菌叶锈菌P.triticina由沈阳农业大学植物免疫研究所李天亚老师提供。
1.2 试验方法
1.2.1 细菌发酵液制备
牛肉膏蛋白胨琼脂培养基(NA):酵母浸膏 1 g,蛋白胨 5 g,牛肉浸膏3 g,蔗糖 10 g,蒸馏水1 000 mL,pH 6.8~7.0。
将供试的3株细菌菌株接种在NA培养基上进行纯培养,28℃下培养3 d。将纯化的细菌菌株接种于装有NA液体培养基的三角瓶,置于恒温振动培养箱中(28℃,165 r/min)摇瓶发酵3 d。将菌悬液用无菌水稀释至1.0×108cfu/mL备用。
1.2.2 小麦种子处理
小麦种子用75%乙醇表面消毒30 s,无菌水冲洗 5次[9]。将50 g小麦种子与1 mL菌悬液混匀进行种子处理,以空白培养基处理为对照。
1.2.3 细菌菌株对小麦种子萌发的影响
在培养皿中放入无菌滤纸,无菌水润湿,分别将20粒经细菌菌悬液包衣的小麦种子均匀分布于培养皿(d=10 cm)中。以空白培养基包衣为对照。共4组处理,每个处理5次重复。恒温培养箱中(25℃,相对湿度100%)培养,2 d时观察记录发芽率,测量其芽长与根长。
发芽率=(发芽种子数/供试种子总数)× 100%。
1.2.4 细菌菌株对小麦苗期生长的作用
将灭菌的土壤(V土∶V沙=1∶1)混匀,装入规格为21 cm×21 cm塑料花盆中。将细菌菌悬液处理后的小麦种子播种于花盆中,每盆20粒。以空白培养基处理为对照,共4组处理,每个处理5 次重复。在日光温室中正常培养30 d 时,每个处理随机选取10株小麦植株,保持根系完整,用自来水将植株根部泥土冲洗干净,吸水纸吸干,测量单株小麦的株高、地上部分以及地下部分鲜重。
1.2.5 细菌菌株对小麦叶锈病的盆栽防效试验
分别将浓度为1.0×108cfu/mL的3株细菌菌悬液处理后的小麦种子播种于塑料花盆中,每盆20粒小麦种子,以空白培养基处理为对照,共4组处理,每个处理5次重复,在日光温室中正常培养。待小麦长至一叶一心期,每盆留下15株长势一致的小麦植株,进行小麦叶锈菌P.triticina喷雾接种,菌悬液浓度为1.0×105孢子/mL,接种量每盆10 mL,黑暗保湿12 h以上。接种后10 d,每个处理随机调查20株发病情况,并计算其发病率和严重度。病害严重度参照李振岐等[2]的方法,依据病叶上锈菌夏孢子堆所占据的面积与叶片总面积的百分比来确定病级,用分级法表示,设1%、5%、10%、20%、40%、60%、80%和100%八级,其他百分比值分级归于各自在上述分级值区间的最大值那一级,叶片未发病,记为“0”。调查时目测估计每片调查叶片的发病严重度,计算公式如下:
平均严重度=∑(各严重度级别×各级病叶数)/调查叶片总数;
发病率=(发病的叶片数/调查的叶片总数)× 100%。
1.2.6 细菌Sneb1462对小麦叶锈病的田间防效试验
田间小区设计:以边长2 m的正方形区域为一个处理小区,每个小区含5垄。每垄播种10 g经菌株Sneb1462处理的小麦种子,以空白培养基处理为对照,共2组处理,每个处理设3次重复,小区周围设保护行。30 d时, 每个处理的各个重复小区均随机选取10株苗,测量其株高,并进行叶锈菌接种,接种后10 d调查病害严重度(方法同上)。在成熟期时,每个处理随机选取30株小麦植株,测量穗长、穗重。
1.2.7 细菌Sneb1462的鉴定
形态特征观测:在NA培养基上观察菌落形态及其培养性状,参考东秀珠等[16]所描述的方法进行革兰氏染色、芽胞染色,透射电子显微镜(JEM100CX-Ⅱ)下观察鞭毛着生方式。
16S rDNA测序:采用细菌基因组DNA提取试剂盒(天根)提取本试验细菌的基因组DNA。通用引物27F(5′-AGAGTTTGATCATGGCTCAG-3′)和1492R(5′-ACGGTTACCTTGTTACGACTT-3′)扩增细菌的16S rDNA序列。PCR产物凝胶电泳纯化进行测序(金唯智)。测序结果经BLAST系统序列比对分析,利用MEGA 6 软件构建系统进化树。
生理生化特征反应:参照东秀珠等[16]的方法进行检测。
1.3 数据统计分析
本研究中所有数据均采用SPSS 20.0软件进行统计分析,室内盆栽试验结果采用Duncan氏方差分析,田间试验结果采用配对样本t检验分析。
2 结果与分析
2.1 细菌菌株对小麦种子萌发的影响
为获得促生抗病优良的菌株,本试验采用Sneb1197、Sneb1289和Sneb1462细菌菌株菌悬液处理小麦种子,测定它们对种子萌发的影响。结果(表1)表明,3个菌株都对小麦种子萌发具有促进作用。Sneb1462菌株促生效果尤为显著,小麦发芽率达99%,显著高于空白对照,其芽长和根长均与空白对照差异显著,分别提高了13.8%和9.3%。
表1不同菌株浸种处理对小麦种子萌发的影响1)
Table1Effectsofsoakingseedswithdifferentstrainsonthegerminationofwheatseeds

处理Treatment发芽率/%Budding rate芽长/cmBud length根长/cmRoot lengthSneb1197(97.00±4.47)a(1.41±0.07)b(2.29±0.05)abSneb1289(99.00±2.24)a(1.47±0.10)ab(2.32±0.12)abSneb1462(99.00±2.24)a(1.57±0.11)a(2.47±0.10)aCK(93.00±5.70)b(1.38±0.05)b(2.26±0.04)b
1) 表中数据为平均值±标准差。同列数据后不同字母分别表示在0.05水平差异显著(Duncan氏法)。下同。
Data in the table are mean±SD. Different letters in the same column indicate significant difference at the 0.05 level by Duncan’s test. The same below.
2.2 细菌菌株对小麦苗期生长的作用
温室条件下测定了不同菌株发酵液对小麦苗期生长的促生作用(表2)。结果表明,3株菌株菌悬液处理的小麦植株株高和地上部鲜重与对照相比无显著差异。但细菌Sneb1462菌悬液处理的小麦根长和地下部鲜重与空白对照差异显著,分别提高了30.19%和29.03%,说明细菌Sneb1462菌悬液促进了小麦苗期根部的生长(图1)。
表2不同菌株浸种处理对小麦苗期生长的作用
Table2Effectsofsoakingseedswithdifferentstrainsonthegrowthofwheatseedlings

处理Treatment株高/cmHeight根长/cmRoot length地上部鲜重/gAbove-ground fresh weight地下部鲜重/gFresh root weightSneb1197(19.63±0.95)a(19.07±1.31)ab(1.42±0.15)a(0.79±0.09)abSneb1289(18.29±0.79)a(18.07±1.13)bc(1.37±0.27)a(0.82±0.05)aSneb1462(19.66±0.33)a(20.74±1.03)a(1.46±0.15)a(0.80±0.02)aCK(17.00±1.17)a(15.93±0.63)c(1.25±0.11)a(0.62±0.04)b

图1 Sneb1462促进小麦根部生长Fig.1 Wheat root growth promoted by strain Sneb1462
2.3 细菌菌株对小麦叶锈病的盆栽防效
盆栽防效试验结果表明,Sneb1197、Sneb1289和Sneb1462菌悬液处理的小麦植株的叶锈病发病率(图2 a)和严重度(图2 b)均显著低于空白对照。其中菌株Sneb1462处理对小麦叶锈病防治效果最好(图3),发病率为53.82%,严重度为10.27%,分别比对照处理降低27.54%和49.90%,说明菌株Sneb1462菌悬液能诱导小麦产生抗性,减少叶锈病菌的侵染。

图2 不同菌株浸种处理对小麦叶锈病发病率(a)和严重度(b)的影响Fig.2 Effects of soaking seeds with different strains on the incidence (a) and severity (b) of wheat leaf rust
2.4 细菌Sneb1462对小麦叶锈病的田间防效
依据室内盆栽试验结果,获得一株最优细菌菌株Sneb1462进行田间防效验证试验。结果显示在田间叶锈病发病程度上,菌株Sneb1462菌悬液处理的病害严重度为26.26%,与空白对照相比,降低了38.60%(图4)。菌株Sneb1462菌悬液处理的小麦植株的株高和穗重也显著高于对照,分别提高16.44%和34.98%(表3)。穗长与对照相比差异不显著。

图3 盆栽试验Sneb1462对小麦叶锈病的防治效果Fig.3 Control effects of the strain Sneb1462 on wheat leaf rust in pot experiments
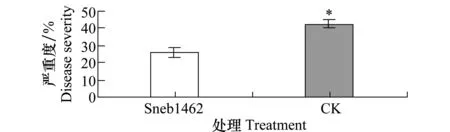
图4 Sneb1462浸种处理对小麦叶锈病田间防治效果Fig.4 Control efficacy of wheat seeds soaked with Sneb1462 on wheat leaf rust in the field

图5 Sneb1462对小麦叶锈病的田间防治效果Fig.5 Control effects of strain Sneb1462 on wheat leaf rust in field experiments

处理Treatment株高/cmHeight穗长/cmSpike length穗重/gSpike weight千粒重/gTKWSneb1462(34.77±2.23)*(9.76±0.51)(2.74±0.09)*(46.43±0.87)CK(29.86±3.66)(8.84±0.55)(2.03±0.22)(45.13±1.93)
1) 表中数据为平均值±标准差。*表示经配对样本t检验在P<0.05水平差异显著。
Data in the table are mean±SD. *:Indicates significant difference atP<0.05 level by paired samplesttest.
2.5 细菌Sneb1462的鉴定
经盆栽试验和田间防效试验,筛选出一株促生效果及对叶锈病防效优良的细菌菌株Sneb1462。在NA培养基上Sneb1462菌落表面光滑,呈乳白色,有黏性(图6a)。菌体为杆状,单个或排列分布,大小为(1.2~2.3)μm×(0.3~0.7)μm。芽胞呈椭圆形,胞囊膨大,中生到端生。革兰氏染色为阳性,透射电镜放大2.5×103倍观察,鞭毛为周生(图6b)。

图6 菌株Sneb1462的菌落(a)及其鞭毛(b)的透射电镜形态Fig.6 The shapes of colonies of strain Sneb1462 (a) and its flagellum (b) under transmission electron microscope
PCR扩增产物经测序后获得菌株Sneb1462 16S rDNA部分序列(MG132172)。通过MEGA 6软件构建系统发育分析结果显示,其DNA序列与多黏类芽胞杆菌P.polymyxa相似度达100%,在系统发育树中也与其属于同一分支(图7)。

图7 基于16S rDNA序列构建的部分类芽胞杆菌属Paenibacillus spp.的系统发育树Fig.7 Phylogenetic tree of some Paenibacillus spp.based on 16S rDNA sequences
菌株Sneb1462生理生化特征显示(表4),Sneb1462可以利用葡萄糖、D-木糖、L-阿拉伯糖、蔗糖、甘油等作为碳源;其硝酸还原反应、V-P反应、水解淀粉、接触酶等反应均为阳性,柠檬酸盐利用、H2S产生、氧化酶等反应为阴性;在耐盐性方面,该菌株不能在含盐5%、10%培养基上生长。而且鉴定结果与东秀珠等[16]描述的多黏类芽胞杆菌P.polymyxa的生理生化特征一致,综合16S rDNA序列分析和生理生化鉴定结果,将菌株Sneb1462鉴定为多黏类芽胞杆菌P.polymyxa。
表4菌株Sneb1462的生理生化测定
Table4PhysiologicalandbiochemicalcharacteristicsofstrainSneb1462

特征 CharacterSneb1462特征 CharacterSneb1462葡萄糖 Glucose+V-P 反应V-P test+D-木糖 D-Xylose+水解淀粉 Starch hydrolysis+L-阿拉伯糖 L-Arabinose+氧化酶 Oxidase-蔗糖 Sucrose+接触酶 Catalase+乳糖 Lactose+厌氧生长 Anaerobic growth+甘油 Glycerol+耐盐性 NaCl tolerance甘露醇 Mannitol+ 1% NaCl+柠檬酸盐利用 Utilization of citrate- 2% NaCl+H2S产生 H2S production- 5% NaCl-硝酸还原反应 Deoxidize nitrate+ 10% NaCl-
3 讨论
本研究采用透射电镜观察、16S rDNA序列分析及生理生化反应特征等方法,将Sneb1462菌株鉴定为多黏类芽胞杆菌P.polymyxa。室内防效试验结果表明,经多黏类芽胞杆菌Sneb1462处理的小麦,其叶锈病的发病率和严重度与对照相比降低27.54%和49.90%;田间试验显示,其病害严重度降低了38.60%,并对小麦促生增产都具有显著效果。田间试验叶锈病的严重度低于室内试验,可能是由于田间环境复杂,温湿度、土壤pH、含水量等不同生态条件以及微生物区系等因素均对其有影响[14]。
在以往关于生防菌的研究中,多采用以生防菌菌悬液灌根或叶片涂抹喷施的方法进行筛选和防效评价试验[17-19]。在本研究中,通过多黏类芽胞杆菌Sneb1462对小麦种子进行处理,发现也能诱导小麦对叶锈病产生抗性。因此,利用有益微生物进行种子处理防控病害将是一种新型的植保措施,具有重要的研究意义。
植物根际促生菌(PGPR)是可以参与植物的固氮和溶磷反应,产生及调节植物体内激素水平,促进植物的生长发育,直接或间接对病原物产生抑制作用[9, 20],增加农作物产量的有益微生物,其作为重要的生物防治资源不容忽视。植物根际促生菌的研究主要集中于芽胞杆菌属和假单胞菌属细菌,其中多黏类芽胞杆菌就是一种重要的植物病害生防菌和根际促生菌[21]。
多黏类芽胞杆菌诱导植物抗病性的研究已有报道。Du等[22]研究发现多黏类芽胞杆菌NSY50菌悬液灌根处理可以诱导黄瓜抗枯萎病,并显著提高黄瓜的生物量;Ryu等[23]报道通过包埋处理将多黏类芽胞杆菌E681定殖于芝麻根部,可以诱导其对猝倒病产生抗性,并促进芝麻生长。此外,童蕴慧等[24]报道采用多黏类芽胞杆菌W3菌悬液及其滤液进行叶片涂抹处理可以诱导番茄产生系统抗性,增强番茄植物对灰霉病菌侵染的抵抗力,并能提高番茄产量。本研究中发现,在温室和田间条件下,采用多黏类芽胞杆菌Sneb1462进行种子处理可诱导小麦产生对叶锈病菌的抗性,显著降低其严重度,同时也对小麦的促生增产有显著作用。
Liu和Kim等[25-26]已测定了多黏类芽胞杆菌全基因组序列,几个具有生防促生功能的相关基因被发现。上述针对多黏类芽胞杆菌生物防治的研究多采用叶面涂抹喷施或灌根处理的方法,种子处理却很少见报道。本研究中,多黏芽胞杆菌Sneb1462诱导小麦抗叶锈病及促生增产作用机理尚不明确,还有待进一步研究。
