胎盘蛋白14增强调节性T细胞诱导滤泡调节性T细胞比例增加的作用及机制研究
2018-08-01林丽慧
林丽慧 陈 瑾 唐 梅
(海南西部中心医院妇产科,儋州 571700)
不明原因复发性流产(Unexplained recurrent spontaneous abortion,URSA)是引起继发不孕的重要因素,免疫系统功能异常是引起URSA的主要原因之一[1]。调节性T细胞(Treg细胞)是机体的重要免疫抑制细胞,能够通过分泌免疫抑制因子,抑制机体异常细胞免疫反应[2]。大量的研究发现URSA的发生与患者体内Treg细胞数量减少有紧密关系,Treg细胞移植可以有效治疗机体免疫系统对自体组织器官的异常攻击[3-5]。滤泡调节性T细胞(Tfr细胞)是体液免疫的主要抑制细胞,最新的研究发现Treg细胞能促进Tfr细胞的增殖[6]。因此Treg细胞被认为是URSA主动免疫治疗的重要靶标。胎盘蛋白14(PP14)是一种子宫内膜合成的糖蛋白,在维持妊娠中发挥着重要作用[7]。研究发现PP14具有显著的免疫抑制作用,协助胎盘的免疫豁免[8]。然而PP14对Treg细胞的影响及其进一步调控Tfr细胞目前国内外还未见报道。
1 材料与方法
1.1试剂 PP14购于Abcam公司;人淋巴细胞分离液购于天津TBD公司;RPMI1640基础培养基和胎牛血清购于Hyclone公司;CD4、CD25、CXCR5、Foxp3、CTLA-4和HLA-G流式抗体购于BD公司; IL-10和TGF-β的ELISA试剂盒购于欣博盛生物科技公司;IL-10和TGF-β中和抗体购于Abcam公司;Treg细胞分选试剂盒购于BD公司。
1.2方法
1.2.1细胞分离和培养 收集健康献血志愿者的外周血,将其与PBS进行1∶1混合,之后缓缓加入到淋巴细胞分离液的上层,2 000 r/min离心 20 min,用吸管吸取白膜层,PBS清洗3次后,置于含有10%胎牛血清的RPMI1640培养基中培养。
1.2.2Treg细胞的检测 淋巴细胞分离后分两组,对照组和PP14组(培养基中加入10 μg/ml的PP14[9]),置于细胞培养箱中培养48 h后,收集细胞,1 000 r/min离心5 min,之后加入CD4、CD25、CTLA-4和HLA-G的抗体,室温避光孵育15 min,PBS清洗3次后破膜,加入Foxp3抗体,室温避光孵育15 min,PBS清洗3次后流式检测CD4+CD25+Foxp3+Treg细胞的比例及其表面CTLA-4和HLA-G的表达。
1.2.3Treg细胞分选 我们采用试剂盒中的磁珠分选淋巴细胞中Treg细胞。人淋巴细胞分离液分离出外周血中的淋巴细胞,之后置于15 ml离心管中,加入4 ml PBS重悬;通过间接法标记出带有磁性的非CD4+T细胞,同时加入PE-CD25抗体;将离心管置于磁力架上,静置5 min后,吸取上层的细胞,置于另一个离心管中;加入抗PE的磁珠,室温孵育1 h,之后将离心管置于磁力架上,静置5 min后,弃上清;PBS反复清洗3次后将分离出的Treg细胞置于含有10%胎牛血清的RPMI1640培养基中培养。
1.2.4ELISA检测 实验分组同前,PP14刺激 48 h后,使用Treg细胞分选试剂盒分选出Treg细胞,继续培养48 h,收集培养上清,2 000 r/min离心10 min,吸取上清液,采用ELISA方法检测上清中IL-10和TGF-β的浓度,操作严格按照说明书进行。
1.2.5共培养实验 我们采用Transwell小室进行Treg细胞和淋巴细胞的共培养实验。实验分为几组:对照组(单纯的淋巴细胞)、共培养组(上室为对照组淋巴细胞中分选的Treg细胞,下室为淋巴细胞)和PP14组(上室为PP14组淋巴细胞中分选的Treg细胞,下室为淋巴细胞),共培养48 h后,收集下室的细胞,加入CD4和CXCR5的抗体,室温避光孵育15 min,PBS清洗3次后破膜,加入Foxp3抗体,室温避光孵育15 min,PBS清洗3次后流式检测淋巴细胞中CD4+CXCR5+Foxp3+Tfr细胞的比例。
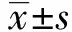
2 结果
2.1PP14促进Treg细胞比例的升高 流式的结果显示对照组CD4+CD25+Foxp3+Treg细胞的比例为(0.060 97±0.008 94)%,PP14组Treg细胞的比例为(0.137 30±0.013 37)%,两组之间差异具有显著的统计学意义(t=4.748,P=0.009 0),这说明PP14可以促进Treg细胞比例的增加,增强机体的免疫抑制能力。见图1。
2.2PP14对Treg细胞表面的免疫抑制分子没有显著作用 流式结果显示对照组CTLA-4和HLA-G的平均荧光强度分别为62.23±4.134和7.550±1.078,PP14组分别为62.47±5.705和8.227±1.097,两组之间没有显著的统计学差异(t=0.108,P=0.918 6;t=0.439,P=0.682 8),这些结果说明PP14对Treg细胞表面的免疫抑制分子没有显著作用。见图2。
2.3PP14促进Treg细胞分泌免疫抑制分子 ELISA的结果显示对照组Treg细胞培养上清中IL-10和TGF-β的浓度分别为(6.663±1.181)ng/ml和(1.400±0.379)ng/ml,PP14组的浓度分别为(31.070±3.380)ng/ml和(6.800±0.608)ng/ml,两组差异均具有显著统计学差异(t=6.817,P=0.002 4;t=7.537,P=0.001 7)。这些结果说明PP14可以促进Treg细胞分泌免疫抑制分子,进一步促进免疫抑制功能的发挥。见图3。
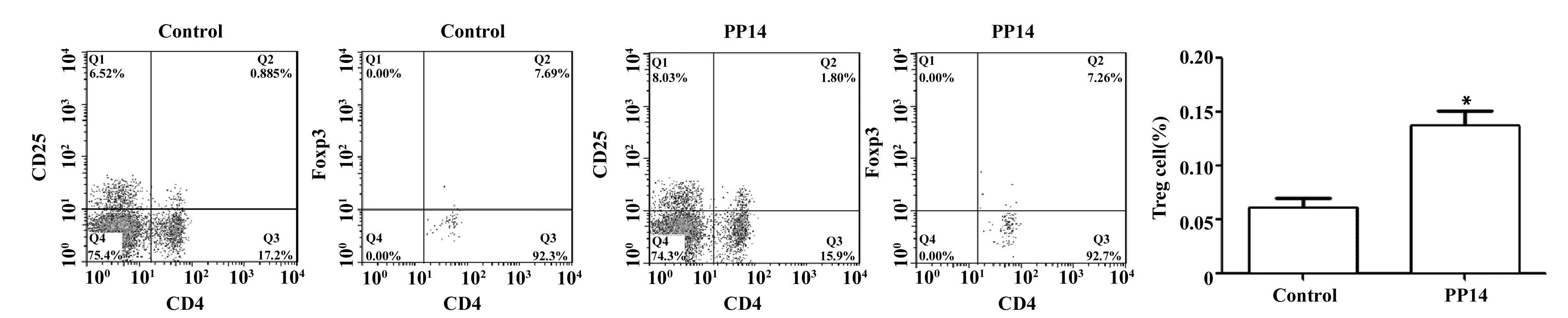
图1 PP14促进Treg细胞比例的升高Fig.1 PP14 increased proportion of Treg cellsNote:n=6,VS control,*.P<0.05.
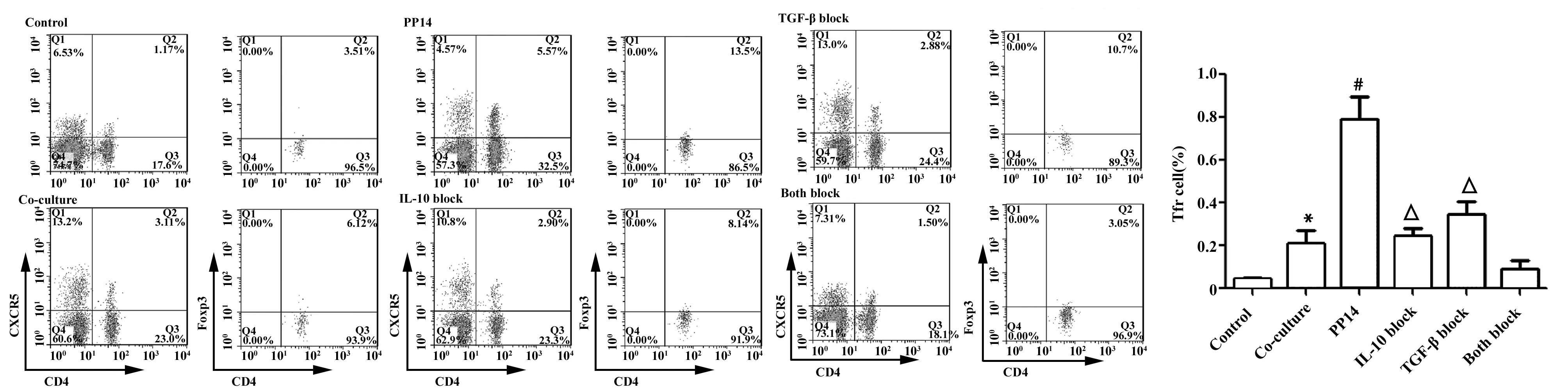
图4 PP14增强Treg细胞诱导Tfr细胞比例增加的作用Fig.4 PP14 enhanced proportion of Tfr cells induced by Treg cellsNote:n=6,VS control,*.P<0.05;VS co culture group,#.P<0.05;VS PP14 group,△.P<0.05.
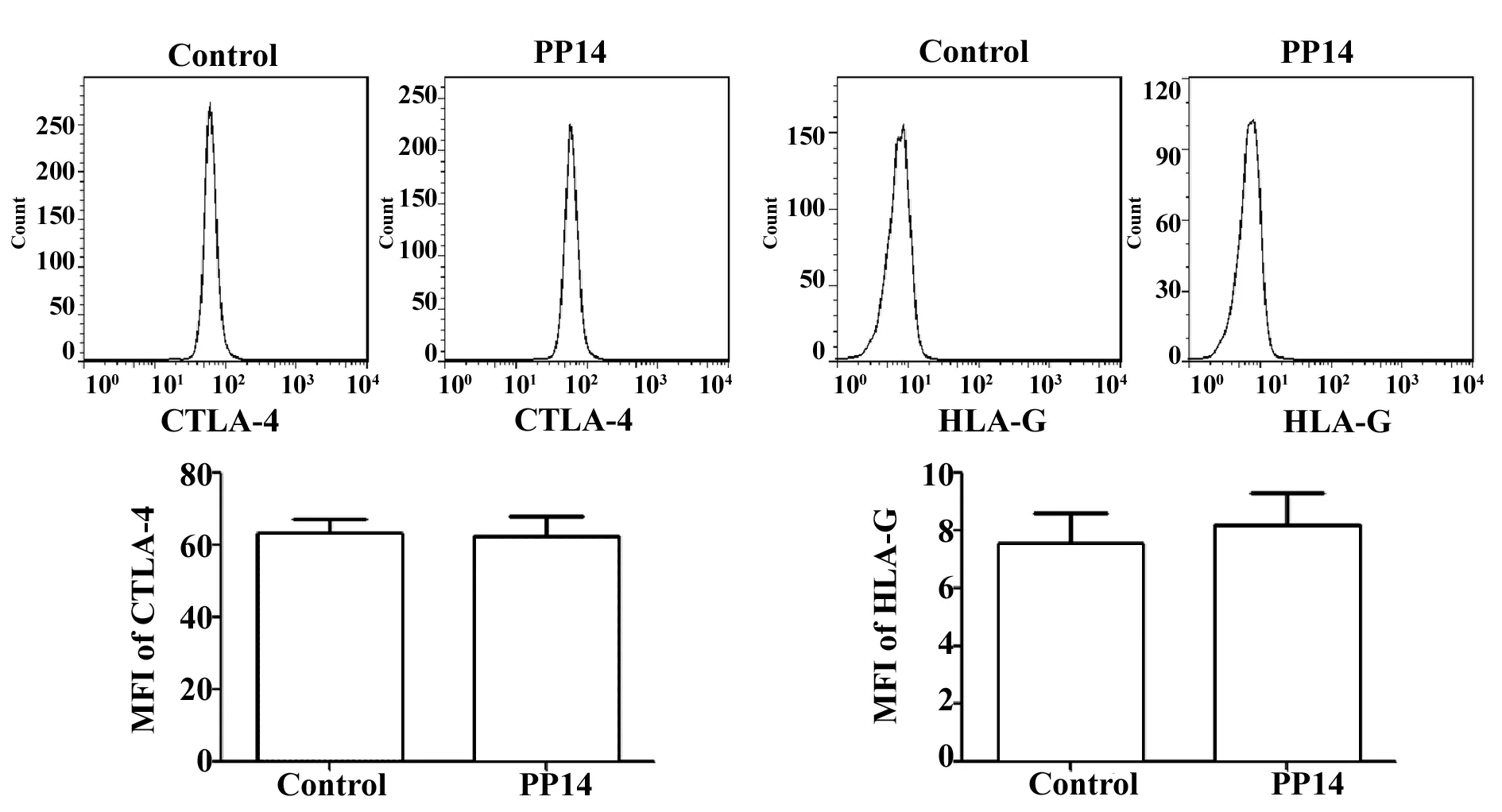
图2 PP14对Treg细胞表面的免疫抑制分子没有显著的作用(n=6)Fig.2 PP14 had no significant effect on immunosupp-ressive molecules of Treg cells(n=6)

图3 PP14促进Treg细胞分泌免疫抑制分子Fig.3 PP14 promoted Treg cells to secrete immunosuppr-essive moleculesNote:n=6,VS control group,*.P<0.05.
2.4PP14增强Treg细胞诱导Tfr细胞比例的增加 共培养实验的结果显示对照组CD4+CXCR5+Foxp3+Tfr细胞比例为(0.044 0±0.007 94)%,共培养组比例为(0.213 3±0.056 08)%,两组之间差异具有显著的统计学意义(t=2.990,P=0.040 3);PP14能够增强Treg细胞诱导Tfr细胞比例的增加,相对于共培养组,PP14组CD4+CXCR5+Foxp3+Tfr细胞比例增加了2.71倍,差异具有显著的统计学意义(t=4.815,P=0.008 6);IL-10和TGF-β的阻断均能部分阻断这种增强作用,相对于PP14组,IL-10和TGF-β阻断组CD4+CXCR5+Foxp3+Tfr细胞比例分别下降了69.20%和56.54%,差异均具有显著统计学意义(t=4.868,P=0.008 2;t=3.670,P=0.021 4);我们进一步同时加入IL-10和TGF-β的阻断抗体,共同阻断组CD4+CXCR5+Foxp3+Tfr细胞比例为(0.092 33±0.036 01)%,与共培养组相比,没有显著的统计学差异,这说明PP14增强Treg细胞诱导Tfr细胞比例增加主要是通过IL-10和TGF-β介导的。见图4。
3 讨论
复发性流产在育龄期女性的发生率约为1%~5%,其中40%~60%原因不明,称为不明原因复发性流产(URSA)。免疫功能异常是引起URSA的重要原因,调节机体的免疫系统对于URSA的治疗至关重要[10]。Treg细胞是维持机体免疫耐受的重要细胞,在妊娠期可以有效抑制母体对胎儿的同种异体免疫排斥反应,维持正常的妊娠。大量的研究表明URSA的发生与孕妇体内Treg细胞比例下降紧密相关,增加Treg细胞比例可能是治疗URSA的很有发展前景的方法[3-5]。PP14是一种胎盘蛋白,具有显著的免疫抑制作用[11]。我们的研究发现PP14能够诱导Treg细胞的增殖,促进Treg细胞分泌免疫抑制分子,进而可能在调控URSA异常免疫反应中发挥着显著的治疗作用。B细胞介导的体液免疫在URSA的发生和发展中同样发挥着关键性的作用。Tfr细胞是体液免疫的负向调节细胞,能够通过抑制Tfh细胞和IL-21的分泌,而抑制B细胞增殖和分化为浆细胞[12]。Treg细胞与Tfr细胞紧密相关,Treg能够通过细胞表面抑制性分子或者分泌免疫分子,诱导Tfr细胞的增殖[13]。我们的研究发现PP14能够显著增强Treg细胞诱导Tfr细胞比例的增加,IL-10和TGF-β在其中可能发挥着关键性的作用。通过中和性抗体抑制Treg细胞分泌的IL-10和TGF-β,能够显著降低Tfr细胞的比例。
综上,我们的研究发现PP14能够通过IL-10和TGF-β通路,显著增强Treg细胞诱导Tfr细胞比例的增加。在后续的实验中,我们将进一步研究在URSA患者体内Treg细胞和Tfr细胞之间的相关作用,为URSA的治疗提供了一个新的靶点。