Pin1通过抑制Wnt/β-catenin信号参与CKD-MBD的发病①
2018-08-01综述王文赟审校
赵 玉 综述 王文赟 王 静 审校
(西北民族大学医学院,兰州 730000)
肽酰脯氨酰胺同分异构酶(Peptidyl-prolyl cis/trans isomerase NIMA-interacting 1,Pin1)归属于多肽基脯氨酰顺反同分异构酶家族的Pin1型亚家族,是通过酵母杂交确定的对酵母和人类细胞分裂均有作用的功能蛋白,具有高度保守性和特异性。Pin1能够特异性地催化磷酸化的丝/苏-脯氨基酸(Ser/Thr-Pro)基序发生异构,使其底物蛋白构象改变而影响其相关的功能。本文旨在探讨Pin1通过抑制Wnt/β-catenin信号参与慢性肾脏病-矿物质和骨异常(Chronic kidney disease-mineral and bone disorder,CKD-MBD)的发病。
1 Pin1的结构和功能
Pin1功能的特异性主要依赖于其结构的特殊性。Pin1包括两个重要的功能区,即氨基末端(N末端)的色氨酸-色氨酸中心(WW)结构域和羧基末端(C末端)的肽基脯氨酰异构酶(PPIase)结构域。N末端的WW 区,由39个氨基酸残基组成,以两个恒定的色氨酸为特征,形成独特的兜状结构,是一个特异性的磷酸化的Ser/Thr基序的链接区,介导Pin1与底物中磷酸化的蛋白质结合;C末端的PPIase活化区,由120个氨基酸残基组成,此区为Pin1的活化位点,具有RNA聚合酶的功能,WW区与PPIase区由一可变性序列连接共同构成一个双监测机制[1]。当Pin1的底物磷酸化后,WW区与磷酸化的Ser/Thr-Pro基序发生特异性结合,结合后PPIase区便可催化磷酸化的Ser/Thr基序发生构象改变,由顺式变为反式或由反式变为顺式,从而改变底物蛋白质的构象,调节靶蛋白的活性[2]。因此,Pin1参与涉及蛋白质磷酸化和去磷酸化的多种信号通路的调节[3],其作用的蛋白质序列中pSer/Thr-Pro基序的磷酸化是细胞增殖和转化的主要信号转导机制[4]。
2 Wnt/β-catenin信号通路与CKD-MBD
KDIGO指南定义CKD-MBD是指慢性肾脏疾病(Chronic kidney disease,CKD)患者出现实验室检查异常(Ca、P、iPTH、维生素D)、骨骼异常(骨转运、骨矿化、骨骼生长、骨骼力量)及心血管损害和软组织钙化三方面的改变。近年的临床实践及基础研究均表明,骨代谢异常在CKD早期即已出现,其是CKD-MBD发生发展的中心环节,加重心血管疾病,造成CKD骨-肾脏-心脏相互间的损害呈恶性循环发展,加速CKD进展[5]。
Wnt信号在生物进化中极为保守,Wnt族基因及其产物与多种基因的蛋白质产物构成一条极为复杂的蛋白质网络,控制着生物的胚胎发育、细胞命运及组织器官形态的发生,在生物生长、发育、功能和死亡中具有重要作用。Wnt/β-catenin信号是Wnt信号的经典途径,在调节骨和软骨代谢中有重要作用,如刺激干细胞复制、促进软骨细胞成熟、诱导成骨细胞发生、阻碍成骨细胞和骨细胞凋亡等[6-8]。而在CKD-MBD的发病机理中,β-catenin信号的改变是一个早期事件。Sabbagh等[9]研究发现,CKD患者早期既已出现骨骼的合成代谢降低,其体细胞核内的β-catenin减少。与正常人骨骼相比,在早期伴有低转化型(LTO)或高转化型(HTO)骨病的CKD及HD患者中,其骨活检组织中骨细胞表达磷酸化的Ser33/37-β-catenin 数量增多,而作为此信号通路抑制剂的硬化蛋白(Sclerostin,SOST)水平也增高,提示Wnt/β-catenin信号途径在CKD早期既已被抑制[9]。最近研究发现,与非CKD患者相比,CKD患者血清中SOST和Dickkopft-1 (DKK1)的水平明显升高,进一步证明了Wnt/β-catenin信号通路在CKD早期被抑制[10]。在多囊肾疾病和Alport肾病的早期CKD动物模型中,研究者也发现骨细胞核内β-catenin降低,SOST水平增高[11,12]。Sabbagh等[9]用免疫组化方法发现,jck鼠与野生型小鼠相比,其骨细胞表达磷酸化Ser 33/37-β-catenin 的数量显著增多,这一变化贯穿于整个疾病的过程;jck鼠骨细胞表达SOST的数量也明显增加,证实了在CKD-MBD的发病过程中,Wnt/β-catenin信号通路失活。Wnt/β-catenin信号通路被抑制,导致β-catenin所靶向的成骨细胞和破骨细胞相关基因的异常,造成破骨细胞活化,成骨细胞功能障碍,骨相关细胞之间的协调作用失常,最终促进了CKD-MBD骨代谢异常的持续进展。
3 Pin1依赖的丝/苏-脯氨基酸基序磷酸化及异构是调控Wnt/β-catenin信号的重要途径
Pin1增加细胞内β-catenin的稳定性。在乳腺癌组织中Pin1与β-catenin均高水平表达,但在Pin1缺陷小鼠组织中β-catenin水平急剧下降[13]。Pin1通过阻止β-catenin与APC相互作用,避免其在细胞质降解,稳定β-catenin,使其进入细胞核内,启动β-catenin/TGF信号,通过TGF位点激活其下游靶向基因[14]。Pin1过表达,细胞内β-catenin的稳定性明显增加,β-catenin蛋白水平增高,而Pin1低下则造成β-catenin降解增多,β-catenin蛋白水平下降。Pin1与β-catenin的表达密切相关。
β-catenin包含3个丝-脯氨基酸基序,是Pin1的重要底物之一。体外对Hela细胞共转染Pin 1和β-catenin,采用GST-Pull down实验能够证实Pin1与β-catenin之间的相互作用关系。体内免疫共沉淀方法也能证明Pin1与β-catenin结合。对蟾蜍提取物孵育后进行的GST-Pull down试验表明Pin1结合依赖于β-catenin的磷酸化,其作用部位位于β-catenin磷酸化的丝氨酸246-脯氨酸(Ser 246-Pro)序列,该位点与β-catenin结合APC的部位非常接近(图1),APC在控制β-catenin从细胞核到细胞质的定位输出方面具有重要作用。Pin1特异性地结合β-catenin,则破坏了β-catenin与APC的结合,导致β-catenin在细胞质内积聚,促使其入核,诱导β-catenin靶向的下游基因转录[15]。经典的Wnt信号通路β-catenin核定位是关键步骤[16],Pin1与磷酸化蛋白结合及对磷酸化区域进行异构是活化β-catenin所必需的过程,Pin1依赖的丝/苏-脯氨基酸基序的磷酸化及异构是调控Wnt/β-catenin信号的重要途径。Pin1的调节异常能够改变Wnt/β-catenin信号的作用[15,17],最终使得骨细胞特异性Wnt/β-catenin信号的异常造成CKD骨代谢紊乱的发生[9]。
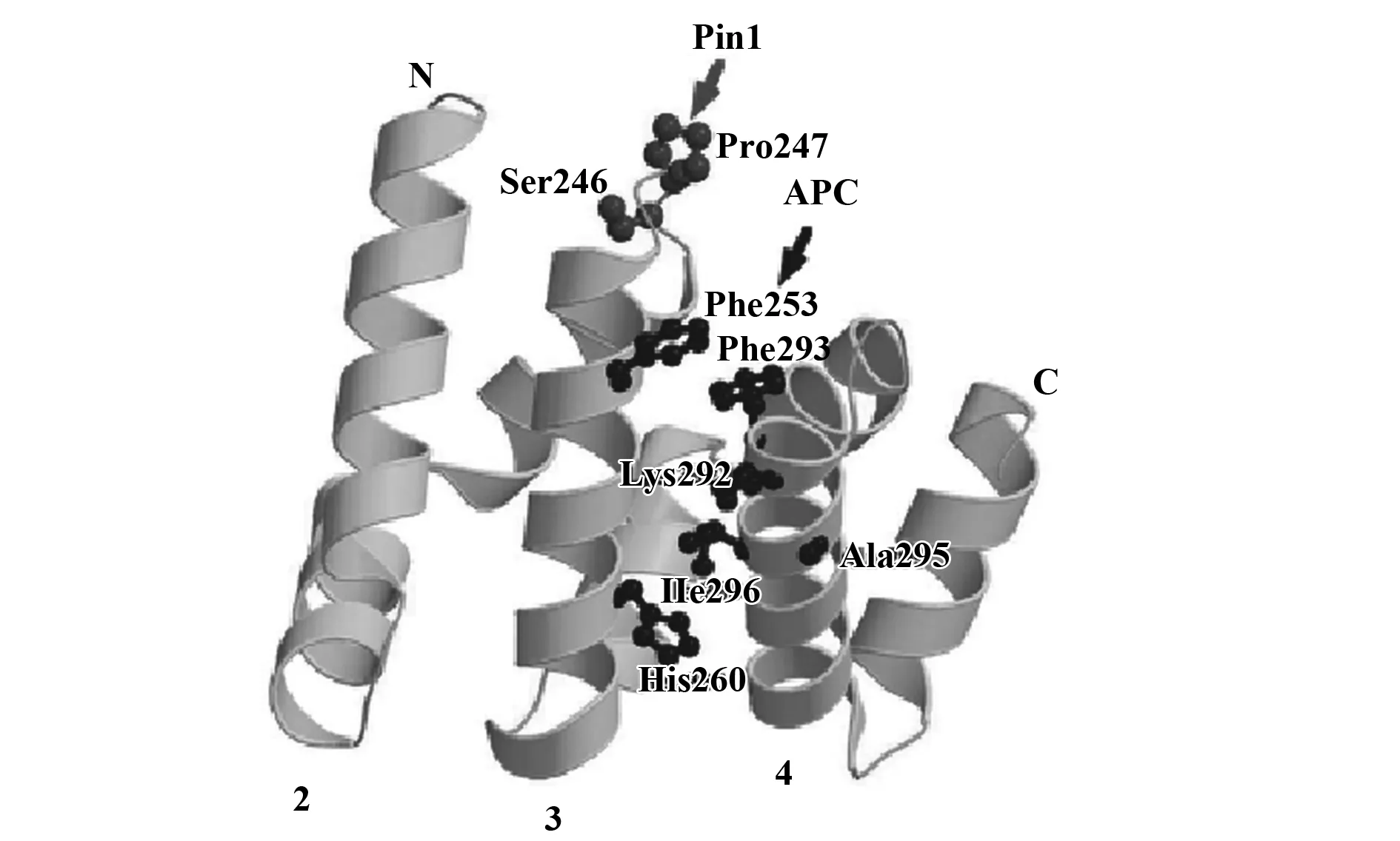
图1 β-catenin结构及其与APC和Pin1的结合位点[15]Fig.1 β-catenin structure and its binding sites for APC and Pin1[15]
4 Pin1对Wnt/β-catenin信号通路的调控异常成为骨代谢障碍等多种疾病发生和发展的重要机制
Pin1的调控异常可见于骨形成不良、肿瘤、阿尔茨海默尔病等多种疾病[18]。体内和体外研究均表明β-catenin与Pin1之间的相互作用是骨形成的关键因素,Pin1的调控是成骨细胞骨形成的重要条件[16,19]。与野生型小鼠相比,Pin1基因敲除小鼠呈现了年龄相关的全身骨量和股骨骨量的丢失,表现出骨代谢障碍[20]。Pin1还通过特异性地维持Runx2的稳定性、成纤维生长因子2(FGF2)的活性等途径,维持骨正常的生长及塑化[21]。在鳞状细胞癌细胞中,Pin1通过调节β-catenin与APC之间的相互作用,激活Wnt/β-catenin途径。Pin1与细胞核内β-catenin的增加和细胞质APC的减少有明显的相关性,而且Pin1及核内β-catenin的水平与肿瘤的分期和肿瘤的大小具有正相关性[17]。可见,Pin1对Wnt/β-catenin信号通路的调控异常是骨代谢障碍等多种疾病发生和发展的重要机制。
5 CKD背景下Pin1出现了异常的改变
研究表明,Pin1与PTH的表达有关。Pin1是稳定PTH mRNA的关键调节子,抑制Pin1的活性或敲除PIN1基因,PTH mRNA编码增加、降解抑制;而PIN1基因过度表达时,PTH mRNA降解增强、编码减弱[22]。 Pin1对PTH mRNA稳定性的调节是通过PTH mRNA 3′-UTR ARE和mRNA衰变因子K同源剪接调控蛋白(K-homology splicing regulatory protein,KSRP)的相互作用实现的。顺反异构化的脯氨酸黏附于KSRP导致其构象发生改变,使其磷酸化的S181位点暴露,Pin1与其相互作用导致KSRP去磷酸化,激活KSRP。活化的KSRP与PTH mRNA相互作用使其降解增加、编码减弱。Pin1低下是SHPT的重要原因,低活性的Pin1使KSRP脱磷酸化作用减弱,活化的KSRP减少,导致KSRP与PTH mRNA的作用减弱,抑制了PTH mRNA的降解,从而增加了PTH mRNA的稳定性,使PTH表达增多[23]。
CKD-MBD的特征性表现之一为继发性甲状旁腺功能亢进(Secondary hyperparathyroidism,SHPT)。国内外对Pin1与CKD-SHPT研究少见,CKD背景下出现的SHPT是否是Pin1异常作用的结果,Pin1是否还参与了CKD-MBD骨代谢及心血管损害的过程,目前仍不明了。我们通过研究Pin1与中国西北汉族人CKD-SHPT的关系发现[24],CKD-SHPT患者Pin1水平明显低下,且与甲状旁腺激素水平呈显著负相关,而且我国汉族人群PIN1基因-667C > T多态性可能与CKD SHPT易感性相关。-667T变异基因型(CT+TT)可能是CKD SHPT的危险因素[24]。动物实验也证实终末期肾脏病小鼠中Pin1酶活性降低[23]。上述结果均表明,Pin1的作用在CKD中表现异常。
综上所述,骨代谢异常是CKD-MBD中心的致病环节,Wnt/β-catenin信号通路被抑制是CKD-MBD骨代谢障碍的重要原因,由于Pin1依赖的磷酸化丝/苏-脯氨基酸基序异构是调控Wnt/β-catenin信号通路的重要途径,且Pin1在CKD中表现异常。我们推测CKD背景下,正是由于Pin1低下,致使Wnt/β-catenin信号通路被抑制,β-catenin所靶向的下游基因,尤其是骨代谢相关基因的转录减少,导致骨生长和塑性过程障碍,出现钙、磷、PTH、FGF-23、Sclerostin、Dkk1、OPG等因子紊乱,加重了心血管及肾脏损害,造成CKD-MBD的持续损伤及快速进展。纠正Pin1的异常稳定Wnt/β-catenin信号可望成为防治CKD-MBD新的手段。
目前,国内外对CKD背景下Pin1的研究尚欠缺。CKD-MBD中心致病环节为骨代谢异常,Wnt/β-catenin信号通路失常是其发生发展的重要机制,β-catenin作为Pin1重要的底物之一,通过其作用稳定β-catenin,促使其入核进行其下游靶向基因的转录。以往的研究及我们的工作均证明了,CKD背景下Pin1存在异常,而Pin1的调节又是维持骨代谢正常进行的重要机制,Pin1在CKD-MBD进展中的作用如何?在CKD背景下,Pin1是否对Wnt/β-catenin信号途径的调节作用出现异常改变,通过造成骨代谢障碍,继而引起心血管损害并加重肾功能损伤进展,造成了CKD-MBD骨-心脏-肾脏之间的持续损伤,推动CKD-MBD进展 ?而对这些问题的诠释,不仅能够进一步深入对CKD-MBD发病机制的了解,同时为其防治提供了新的思路和手段,因此,对于Pin1是否基于对Wnt/β-catenin信号通路的调节异常参与了CKD-MBD的进展的研究,值得期待。