IL-38通过上调CXCL1及IL-8募集中性粒细胞促进转移病灶的形成研究
2018-08-01岳曼朱磊李军
岳 曼 朱 磊 李 军
(武汉市中心医院肿瘤Ⅱ病区,武汉 430025)
肿瘤转移是恶性肿瘤的主要特征,是引起癌症患者死亡的首要因素[1]。肿瘤转移的发生涉及肿瘤细胞及其所处微环境中复杂的信号通路,这些信号通路的激活及相互作用介导了肿瘤的转移、侵袭和在血液/淋巴循环系统中的存活,以及在转移靶部位的生长过程[2]。肿瘤转移是一个复杂的、多因素调控的动态过程,对于肿瘤转移机制的研究将有助于深入了解转移过程,并寻找有意义的治疗靶标,为临床诊断和治疗奠定基础[3]。趋化因子CXCL1(C-X-C motif chemokine ligand 1)又称为黑色素瘤生长刺激因子或生长调节性癌基因α,是一类与细胞相关的ELR+(吸引中性粒细胞及诱导血管新生)CXC族趋化因子[4]。研究表明,CXCL1可结合并激活CXC趋化因子受体2(CXCR2),活化PI3K信号通路,从而介导上皮细胞间质化(Epithelial-mesenchy-mal transition,EMT)的发生[5]。报道指出,CXCL1在多种肿瘤的发生、发展及转移等过程中发挥关键作用[6,7]。人IL-8属于趋化因子CXC(α)亚家族成员,又称CXC趋化因子8[8]。IL-8的细胞来源广泛,生理或病理的多种细胞刺激均可以引发细胞表达IL-8。研究指出,IL-8在肿瘤发生、侵袭和转移中发挥重要作用,阻断IL-8或其受体不但可减轻炎症反应,而且可抑制肿瘤细胞的增殖[9,10]。IL-38是一种新发现的细胞因子,其生物学功能尚未十分明确。IL-38是IL-36的部分受体拮抗剂,可作为IL-36的特异性受体[11]。报道指出,IL-38可抑制Th17细胞产生IL-17和IL-22等炎症介质,也可抑制IL-36γ诱导产生IL-8,发挥抑制炎症反应的作用[11]。据作者所知,目前尚无报道研究IL-38与肿瘤转移之间的关联。本次研究的目的是分析肿瘤患者肿瘤组织中IL-38的表达水平,并探讨其对肿瘤转移病灶形成的影响。
1 资料与方法
1.1资料
1.1.1资料来源 本次研究共纳入2009年1月~2014年12月我院收治的32例转移性肿瘤患者及62例原位癌患者作为研究对象;所有患者中男性41例,女性53例;患者的年龄27~72岁,平均(47.3±12.6)岁。所有患者的原发病灶均经病理证实。所有患者均未经任何治疗。转移性肿瘤患者均为肺转移,转移灶经胸部X线片、CT或MRI证实。所有肺转移性肿瘤患者均为原发肿瘤与肺转移瘤同期发现患者。单个转移病灶5例、多发转移灶27例。单发肺转移瘤23例,肿瘤平均直径(3.2±2.7)cm;双发肺转移瘤9例,肿瘤平均直径(2.5±1.7)cm。肺转移性肿瘤患者中,原发肿瘤为癌的患者共24例,其中结、直肠癌12例,肾癌6例,贲门癌3例,绒癌3例;原发肿瘤为肉瘤的患者共8例,其中纤维肉瘤5例,滑膜肉瘤3例。排除临床资料不完整的患者;排除近期及长期服用影响机体免疫药物的患者;排除长期营养不良患者;排除长期卧床患者;排除伴有全身其他器官器质性疾病患者。另选取43例同期在我院体检中心进行体检的健康人员作为对照;对照组患者中男性19例,女性24例;患者年龄19~78岁,平均(48.7±16.3)岁。纳入研究的患者均告知本研究的目的及方法,所有患者均签署知情同意书,研究获得医院伦理委员会批准。
1.1.2材料与设备 主要试剂包括人IL-38 ELISA试剂盒(美国R&D Systems),IL-38、CXCL1、IL-8抗体(美国Abcam公司),p-MEK、MEK、p-ERK、ERK抗体(美国Santa Cruz公司),β-actin抗体(武汉三鹰生物技术有限公司),LipofectamineTM2000转染试剂(Thermo Fisher),SDS-PAGE试剂(上海碧云天生物技术有限公司),RNA提取试剂盒、反转录试剂盒(美国TaKaRa公司),Realtime-PCR试剂(南京诺唯赞生物科技有限公司),CXCL1及IL-18引物(上海生工生物工程股份有限公司),CXCR2特异性抑制剂(美国Selleckchem公司),IL-18BP(北京中美生物技术有限公司),DMEM培养基、胎牛血清(FBS)(美国Gibco公司),青霉素、链霉素(美国Sigma公司),C57小鼠购自武汉大学实验动物中心,B16F1及B16F0细胞购自美国ATCC公司。主要设备包括CO2培养箱、超净工作台、Tecan酶标仪、Bio-Rad垂直电泳仪,Bio-Rad Western blot化学发光成像系统
1.2方法
1.2.1小鼠模型的建立 取对数生长期的B16F1与B16F0细胞,胰酶消化,1 000 r/min离心收集细胞,加PBS重悬,将细胞密度调整为1×107ml-1。经小鼠尾静脉注射1×106个细胞/只,建立B16F1与B16F0细胞肺转移模型。
1.2.2质粒构建与小鼠分组 构建pCMV-IL-38及pCMV-GFP质粒。用20 μl OPTIMEN培养基稀释1 μl LipofectamineTM2000脂质体。分别用50 μl OPTIMEN培养基稀释1 μg pCMV-IL-38和pCMV-GFP质粒。将质粒与脂质体按1∶2.5的比例混合,室温放置20 min,待用。分别将B16F1和B16F0肺转移小鼠随机分为三组,每组10只,前两组小鼠分别肝脏转染pCMV-IL-38和pCMV-GFP质粒,将制备好的转染液进行肝静脉注射转染,第三组在转染pCMV-IL-38质粒的基础上尾静脉注射CXCL1抑制剂(CXCR2特异性抑制剂)和IL-18抑制剂(IL-18BP)。小鼠肝脏转染4周后处死全部小鼠,分离肺组织,观察转移灶数目。另取部分组织进行生化指标检测。
1.2.3免疫组化染色 将石蜡切片常规脱蜡至水,0.01 mol/L枸橼酸缓冲液(pH6.0)高压锅抗原热修复,加3%H2O2室温避光孵育30 min,PBS洗 5 min×3次。采用SP法检测COX-2、PD-1、CD8及Foxp3水平。即用10%正常非免疫羊血清37℃孵育60 min,滴加一抗工作液4℃冰箱过夜,PBS洗5 min×3次。滴加二抗工作液,37℃孵育60 min,PBS洗5 min×3次。滴加辣根过氧化物酶标记的链霉卵白素,37℃孵育60 min,PBS洗5 min×3次。DAB显色、苏木素复染、脱水、二甲苯透明、中性树胶封片。每个切片随机选取5个视野,显微镜下观察染色阳性细胞所占百分比。
1.2.4Real-time PCR 取小鼠肺组织进行碾磨,严格按照产品说明书的步骤进行总RNA提取、逆转录和PCR,取1 μg RNA反转录成cDNA。CXCL1的上游引物序列:5′-ACTCAAGAATGGTCGCGAGG-3′,下游引物序列:5′-GTGCCATCAGAGCAGTCTGT-3′;IL-38的上游引物序列:5′-CTAGGCATCTTCGTC-CGTCC-3′,下游引物序列:5′-TTCACCCATGGAGC-ATCAGG-3′;内参β-actin的上游引物序列:5′-GACCCAGATCATGTTTGAGACC-3′,下游引物序列:5′-ACGACCAGAGGCATACAGG-3′。PCR循环条件:95℃ 30 s预变性,95℃ 5 s,60℃ 30 s共40个循环。
1.2.5Western blot 取小鼠肺组织进行碾磨,RIPA裂解液(含1%PMSF蛋白酶抑制剂)裂解细胞提取总蛋白,测定蛋白浓度。配置12%的分离胶和5%的浓缩胶,每孔上样80~120 μg蛋白进行SDS-PAGE,转至PVDF膜。经5%BSA封闭后,加一抗4℃孵育过夜。经洗涤,加二抗(凯基生物公司)室温孵育1 h。洗涤后,DBA显色。
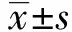
2 结果
2.1患者的基本信息 研究初期共纳入41例转移性肿瘤患者及67例原位癌患者,其中7例临床资料不完整,3例近期服用影响机体免疫的药物,2例长期营养不良患者,1例长期卧床,1例伴有其他器官器质性疾病。最终纳入研究的32例转移性肿瘤患者及62例原位癌患者的基本资料如表1所示,两组患者的年龄、性别等基本资料相比均无统计学差异(P>0.05),具有可比性。
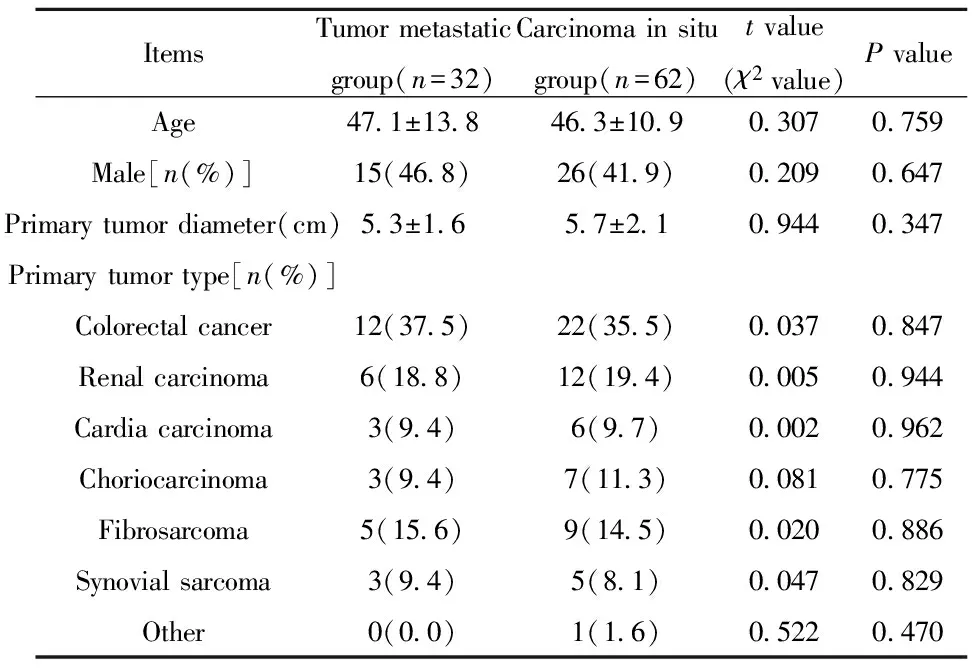
2.2患者的血清IL-38及组织IL-38、CXCL1、IL-8水平分析 如图1所示,ELISA结果表明,肺转移肿瘤患者的血清IL-38水平[(73.2±11.6)pg/ml]显著高于原位癌[(46.1±10.9)pg/ml]及健康者[(15.8±3.5)pg/ml](P<0.05)。免疫组化结果显示,肺转移肿瘤患者肿瘤组织中的IL-38、CXCL1及IL-8水平均显著高于原位癌患者(P<0.05)。
表1患者基本信息对比
Tab.1CompareofbasicdataandserumIL-38levelbetweendifferentgroups
ItemsTumormetastaticgroup(n=32)Carcinomainsitugroup(n=62)tvalue(χ2value)PvalueAge47 1±13 846 3±10 90 3070 759Male[n(%)]15(46 8)26(41 9)0 2090 647Primarytumordiameter(cm)5 3±1 65 7±2 10 9440 347Primarytumortype[n(%)]Colorectalcancer12(37 5)22(35 5)0 0370 847Renalcarcinoma6(18 8)12(19 4)0 0050 944Cardiacarcinoma3(9 4)6(9 7)0 0020 962Choriocarcinoma3(9 4)7(11 3)0 0810 775Fibrosarcoma5(15 6)9(14 5)0 0200 886Synovialsarcoma3(9 4)5(8 1)0 0470 829Other0(0 0)1(1 6)0 5220 470
2.3小鼠模型的建立与分析 小鼠尾静脉注射B16F1与B16F0细胞后所有小鼠均成功建模。肝脏转染IL-38后,B16F1与B16F0细胞在小鼠肺部形成的转移病灶数量均显著多于对照组(P<0.05)。免疫组化结果显示, IL-38转染能显著增加B16F1与B16F0肺转移模型小鼠的肺组织中性粒细胞浸润(P<0.05)。
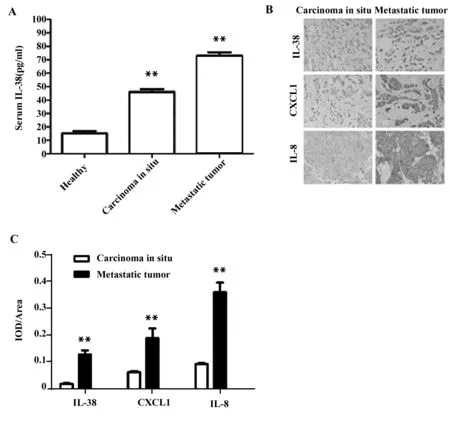
图1 各组IL-38、CXCL1与IL-8表达水平分析Fig.1 Expression of IL-38,CXCL1 and IL-8 in different groupNote:A.Serum level of IL-38;B,C.IHC analysis of IL-38,CXCL1 and IL-8 level in tumor tissue.**.P<0.001.
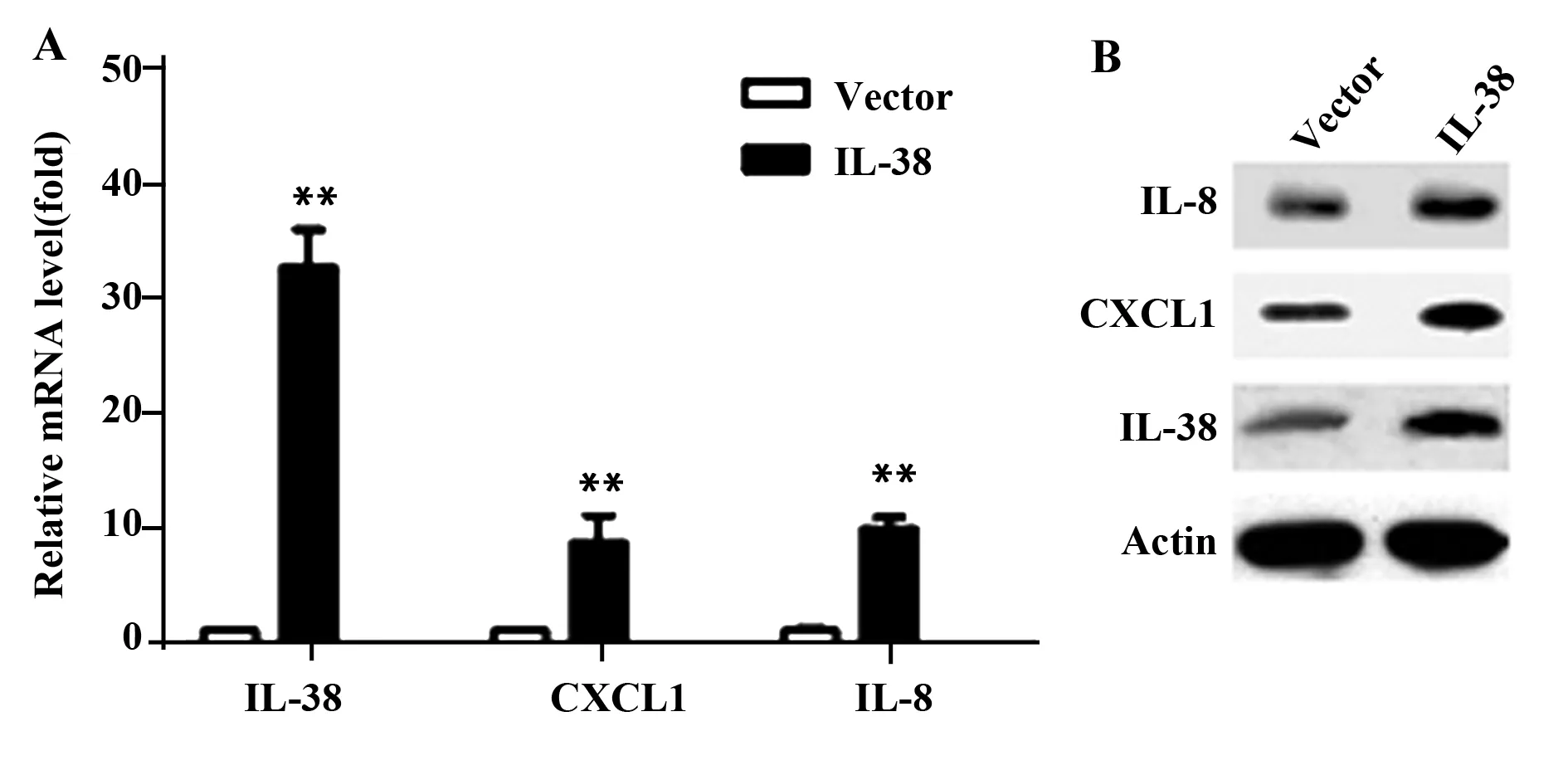
图2 IL-38转染对小鼠肺组织CXCL1及IL-8表达量的影响Fig.2 Effect of IL-38 transfection on expression of CXCL1 and IL-8Note:A.mRNA level of CXCL1 and IL-8;B.Protein level of CXCL1 and IL-8.**.P<0.001 compared with vector transfection group.
2.4IL-38对CXCL1及IL-8的影响 Realtime-PCR结果显示,IL-38转染能显著增加小鼠肺组织中CXCL1及IL-8的mRNA水平(P<0.05)。Western blot结果显示IL-38转染能显著增加小鼠肺组织中CXCL1及IL-8的蛋白水平(P<0.05),如图2所示。同时,给予CXCL1及IL-8抑制剂能显著抑制IL-38引起的小鼠肺部病灶数增加和中性粒细胞浸润(P<0.05)(图3)。
2.5IL-38对MEK/ERK信号通路的影响 Western blot结果显示,IL-38转染能显著上调肺转移小鼠模型肺组织中CXCL1、IL-8的表达及MEK、 ERK的磷酸化水平(P<0. 05), 且给予CXCL1及IL-8抑制剂能显著抑制IL-38对MEK、ERK磷酸化的影响(P<0.05),见图4。
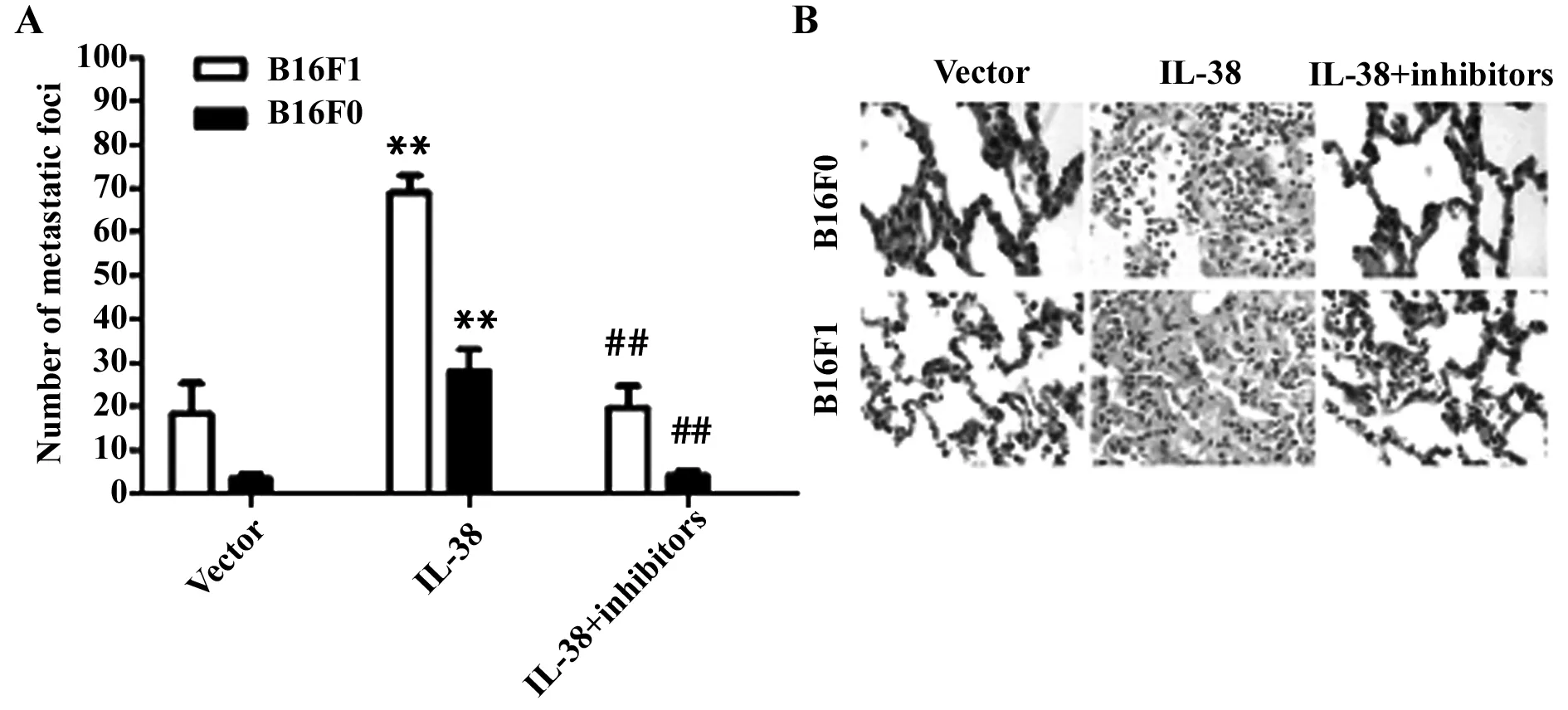
图3 小鼠模型肺转移灶及中性粒细胞浸润分析Fig.3 Analysis of metastatic foci and neutrophil infiltration in mice modelNote:A.Number of metastatic foci in different group;B.Neutrophil infiltration in different group(HE staining).**.P<0.001 compared with vector transfection group;##.P<0.001 compared with IL-38 transfection group.
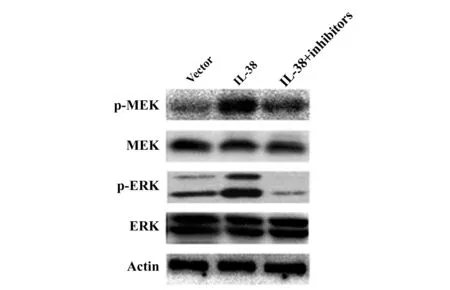
图4 IL-38转染对小鼠肺组织MEK及ERK磷酸化水平的影响Fig.4 Effect of IL-38 transfection on phospholation level of MEK and ERK
3 讨论
本次研究的目的是分析肿瘤患者肿瘤组织中IL-38的表达水平,并探讨其对肿瘤转移病灶形成的影响。IL-38于2001年首次被发现,其基因位于人2号染色体上,位于编码IL-1Ra和IL-36Ra的基因旁[12]。IL-38在免疫组织中广泛表达,如脾、胸腺、扁桃体等[11]。IL-38能与IL-36的受体相关蛋白类型2(IL-1Rrp2)结合。IL-38与IL-1Ra及IL-36Ra的氨基酸组成具有较高的同源性,因此推测IL-38可能作为IL-1的受体拮抗剂,其生物学功能与IL-36Ra类似[13]。最近的研究发现,IL-38对免疫细胞的生物学作用与IL-36受体拮抗剂类似,且与一些自身免疫性疾病如强直性脊柱炎和关节型银屑病有着密切的关系[11]。
本次研究中肺转移肿瘤患者的血清及肿瘤组织中的IL-38水平均显著高于原位癌及健康者。小鼠模型的研究显示,IL-38能促进B16F1与B16F0肺转移模型小鼠的肺组织中性粒细胞浸润,进而促使肺部转移病灶的形成。这些结果提示IL-38在肿瘤肺转移的生理过程中扮演重要角色。肿瘤转移是一个复杂的、多因素调控的动态过程,对于肿瘤转移机制的研究将有助于深入了解转移过程,并可以鉴定到有意义的治疗靶标,为临床诊断和治疗奠定基础[1,2]。肿瘤转移是恶性肿瘤的主要特征,是引起癌症患者死亡的首要因素,肿瘤转移的发生涉及到肿瘤细胞及其所处的微环境中的复杂信号通路,这些信号通路的激活及相互作用介导了肿瘤的转移、侵袭和在血液/淋巴循环系统中存活,以及在转移靶部位的生长过程[2]。
IL-8是一种具有趋化作用和促血管生成作用的炎性细胞因子[8,10]。研究表明,恶性肿瘤细胞、内皮细胞、肿瘤相关巨噬细胞、单核细胞及中性粒细胞浸润过程中均出现IL-8及其受体表达的增加[14]。肿瘤细胞高表达IL-8,从而诱导中性粒细胞趋化,并促使巨噬细胞分泌肿瘤相关生长因子,促进肿瘤细胞的生长和转移[15]。CXCL1最初于黑色素瘤上清液中分离获得,通过与受体CXCR2特异性结合而发挥多种生物学功能,如血管生成、炎症、伤口愈合以及肿瘤发生发展等[5,7]。CXCL1过表达能显著增加迁移相关蛋白(如MMP2、integrin β1等)的表达水平[16]。本次研究中,肺转移肿瘤患者肿瘤组织中CXCL1与IL-8水平均显著高于原位癌患者;IL-38转染能显著增加小鼠肺组织中CXCL1及IL-8的mRNA与蛋白水平;给予CXCL1及IL-8抑制剂能显著抑制IL-38引起的小鼠肺部病灶数增加和中性粒细胞浸润。这些结果提示CXCL1与IL-8在IL-38上调中性粒细胞促进肿瘤转移的过程中发挥重要作用。
近期研究指出,MAPK/ERK信号通路在CXCL1与IL-8发挥促肿瘤转移中发挥关键作用[17]。本次研究中IL-38能显著增加肺转移小鼠模型肺组织中MEK与ERK的磷酸化水平,且给予CXCL1及IL-8抑制剂能显著抑制IL-38对MEK、ERK磷酸化的影响。
综上所述,本次研究表明肺转移肿瘤患者的血清和肿瘤组织中IL-38、CXCL1与IL-8水平均发生显著升高,IL-38可能通过上调CXCL1、IL-8及MEK、ERK的磷酸化水平募集中性粒细胞,从而促进转移病灶的形成。
