Bcl-2-caspase-9凋亡通路在哮喘小鼠睾丸组织中的相关表达
2018-08-01刘海仙李慧芳李晓彤
刘海仙 谭 薇 任 桥 李慧芳 李晓彤
(潍坊医学院内科教研室,潍坊 261000)
哮喘是一种常见的呼吸系统疾病,具有很高的发病率和死亡率,全球约有3亿哮喘患者[1,2]。哮喘是一种慢性气道炎症,由多种细胞(如嗜酸粒细胞、肥大细胞、T淋巴细胞、中性粒细胞、气道上皮细胞等)和细胞组分参与,导致炎性细胞因子增加和气道可逆性阻塞。细胞凋亡包括线粒体路径和死亡受体路径。研究表明在睾丸生精过程中,内源性细胞凋亡途径可以被激活[3]。文献表明细胞凋亡在生殖细胞分化、精子成熟和存活中起重要作用[4]。细胞凋亡过程在睾丸中是非常重要的,因为睾丸需要消除有基因缺陷的精子细胞。所以,在精子发生过程中生殖细胞凋亡的精确控制特别重要,而凋亡途径的过度激活会降低精子数量和活性[5]。细胞凋亡相关基因的表达改变多发生在生育能力低下和精子活性相对较弱的男性中。在重症哮喘患者中,缺氧导致凋亡途径的激活已经开始引起关注[6]。然而,在睾丸中缺氧反应和细胞凋亡之间的关系研究甚少。哮喘是否会影响男性生育能力仍需进一步研究。本研究把小鼠哮喘动物模型的睾丸作为主要研究对象,拟在了解哮喘和精子生成的潜在关系。并且在基因、蛋白质和酶水平上,对凋亡途径的激活进行研究。
1 材料与方法
1.1实验动物 BALB/c小鼠的处理符合潍坊市人民医院伦理委员会(批准号:2014-001)的相关条例,所有实验都遵循动物实验的护理和使用指南(NIH publication No.85-23,revised 1985)。6~8周龄的雄性BALB/c小鼠购自北京维通利华实验动物技术有限公司,所有小鼠都放置在潍坊医学院饲养室特定的无菌环境中。饲养室相对温度20~25℃,相对湿度50%~70%。在实验开始之前,先让小鼠在这种环境中生活2周以适应环境。
1.2方法
1.2.1哮喘造模 参照文献[7]的方法进行造模,即将BALB/c小鼠随机分为两组,哮喘组(n=5)和对照组(n=5)。哮喘模型制备时,在第0、14、21天分别予以20 μg OVA+1 mg Al(OH)3+0.1 ml生理盐水腹腔注射,对照组小鼠则予以0.2 ml生理盐水腹腔注射。在第28~34天,使用超声波喷雾器对所有哮喘组小鼠给予OVA(1%,50 min)雾化吸入,而对照组小鼠则给予生理盐水雾化吸入。在最后一次雾化结束24 h后将所有小鼠处死,并收集睾丸组织以备后续实验。
1.2.2组织准备 每只BALB/c小鼠在称重后予以CO2窒息,取出睾丸后立即称重并置于液氮中保存,用于后续PCR和Western blot。
1.2.3精子计数 参考文献[8]的方法进行精子计数及活性的检测,每只BALB/c小鼠处死后立即收集附睾,置于2 ml的常温(37℃)PBS中制备混悬液,用滴管吸取20 μl的细胞悬液滴入血细胞计数板中,放在低倍镜下观察并计数。精子活性通过活动精子占精子总数的百分比来计数。
1.2.4病理和免疫组化 将摘除的小鼠睾丸固定在4%的多聚甲醛中制作成石蜡块,通过HE染色来处理。滴加cleaved-caspase-3抗体(1∶100)孵化,4℃过夜,发生凋亡的细胞会被染成棕色。
1.2.5RNA提取、PCR芯片和实时荧光定量PCR 将冷冻的睾丸组织在液氮中研磨,并在由the Qiagen RNeasy mini Kit(Applied Biosystems)提供的缓冲液中制备成为混悬液,用以提取RNA。RNA的提取则是依据试剂盒说明书来进行的。所有的RNA样本都放置在无RNA酶的RNA试剂盒中,利用RNase-free DNase I来分解剩余的染色体DNA分解为RNA。RNA的浓度和纯度用紫外分光光度计分别在波长260 nm和280 nm下测量。
在合成互补DNA前,从每只小鼠样本中均抽出等量的RNA混匀成哮喘组和对照组两组,用来进行PCR阵列分析。反转录和实时荧光定量PCR均按照试剂盒说明步骤进行。根据制造商的说明书,使用SYBR Green Real-Time PCR Master Mix(Target Bio)在StepOnePlus Real-time qPCR系统(Applied Biosystems)中进行PCR阵列分析的实时qPCR。对每个条件测试重复的平板,并进行比较以评估结果的再现性。使用仪器软件计算每个孔的阈值循环(Ct),并且在循环程序之后立即运行熔解曲线程序。测试所有引物的扩增效率在1.90~2.10之间。 数据分析采用ΔΔCt法进行。
基因的差异性表达通过实时荧光定量PCR的方法测定。10只小鼠的睾丸RNA分别逆转录为cDNA。HIF-1α、Bax、Bcl-2、BNIP3、AIF、cytochrome c、caspase-9、caspase-3在mRNA水平的表达均通过实时荧光定量PCR的方法测定,如表1。
1.2.6蛋白质提取和Western blot 冷冻的睾丸加入裂解液中,并在液氮中加入蛋白酶抑制剂后研磨制备成混悬液,然后置于冰上裂解10 min。样本在经过彻底离心后获取蛋白上清液。蛋白质浓度的测定使用蛋白浓度测定试剂盒。为每个蛋白质样本取出20 mg放入4%~12%Bis-Tris梯度胶进行电泳,然后应用PDVF膜进行转膜。用10%的脱脂牛奶封闭后,加入抗体孵育。最后,进行压片和显影,含有蛋白质条带的图像被记录在底片(柯达)中,并使用 Image J来处理。试验中所用的一抗应用下述多抗稀释而来:anti-Bcl-2(1∶500,Santa Cruz Biotech-nology),anti-PARP(1∶1 000,Santa Cruz Biotechn-ology),anti-Bax(1∶500,Santa Cruz Biotechnology),anti-cytochrome c(1∶500,Santa Cruz Biotechnology),anti-HIF-1α(1∶500,Santa Cruz Biotechnology),anti-AIF(1∶1 000,Santa Cruz Biotechnology),anti-GAPDH(1∶20 000,Abcam)和anti-cleaved caspase-3(1∶1 000,Cell Signaling)。
表1用于实时qPCR测定的实时PCR引物
Tab.1Real-timePCRprimersusedinreal-timeqPCRassays
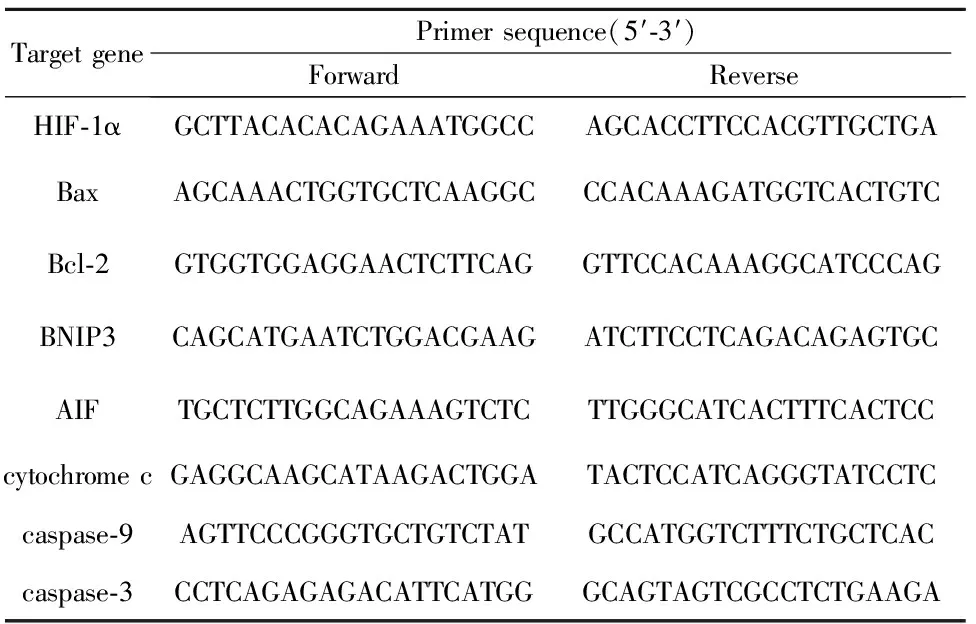
TargetgenePrimersequence(5′⁃3′)ForwardReverseHIF⁃1αGCTTACACACAGAAATGGCCAGCACCTTCCACGTTGCTGABaxAGCAAACTGGTGCTCAAGGCCCACAAAGATGGTCACTGTCBcl⁃2GTGGTGGAGGAACTCTTCAGGTTCCACAAAGGCATCCCAGBNIP3CAGCATGAATCTGGACGAAGATCTTCCTCAGACAGAGTGCAIFTGCTCTTGGCAGAAAGTCTCTTGGGCATCACTTTCACTCCcytochromecGAGGCAAGCATAAGACTGGATACTCCATCAGGGTATCCTCcaspase⁃9AGTTCCCGGGTGCTGTCTATGCCATGGTCTTTCTGCTCACcaspase⁃3CCTCAGAGAGACATTCATGGGCAGTAGTCGCCTCTGAAGA
Note:HIF-1α.Hypoxia inducible factor-1α;AIF.Apoptosis-inducing factor.
1.2.7DNA ladder用DNA ladder的方法进行细胞凋亡检测时按照最近更新的规定进行[9]。在进行DNA纯度和浓度测定后,取出等量的DNA进行琼脂糖凝胶电泳。
1.2.8caspase-9和caspase 3/7酶活性的测定 分别使用Caspase-Glo-9和Caspase-Glo-3/7试剂盒(Promega),操作步骤按照试剂盒说明进行。测定睾丸组织混悬液的蛋白质浓度,并进行蛋白组分析。
2 结果
2.1哮喘组小鼠体重和睾丸重量较对照组小鼠均降低 如表2所示,经过7 d的雾化致敏,实验组小鼠的体重和睾丸绝对重量均较对照组均显著降低(P<0.05)。同时,哮喘组平均的体重增加明显低于对照组。
表2对照组和哮喘小鼠体重与绝对睾丸重量的比较
Tab.2Comparisonofbodyweightandabsolutetestisweightbetweencontrolandasthmaticmice
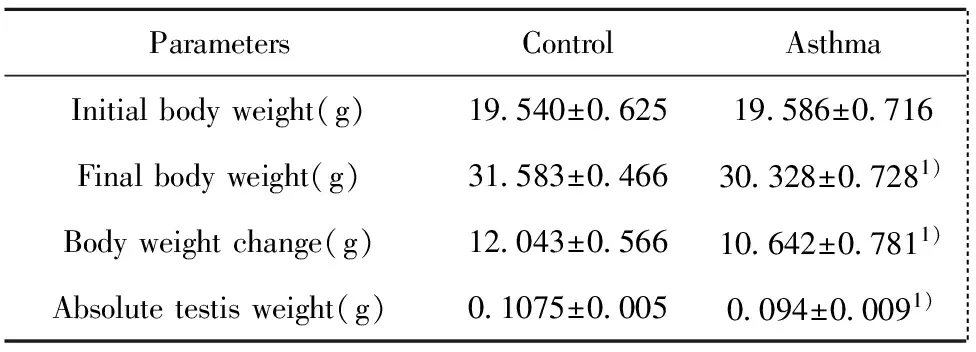
ParametersControlAsthma Initialbodyweight(g)19 540±0 62519 586±0 716 Finalbodyweight(g)31 583±0 46630 328±0 7281) Bodyweightchange(g)12 043±0 56610 642±0 7811) Absolutetestisweight(g)0 1075±0 0050 094±0 0091)
Note:Compared with the control group,1)P<0.05.
表3对照组和哮喘小鼠之间精子计数和运动性的比较
Tab.3Comparisonofspermcountandmotilitybetweencontrolandasthmaticmice

ParametersControlAsthmaSpermcounts(×106)6 850±0 9353 980±0 6282)Spermmotility(%)77 482±9 21751 846±12 5481)
Note:Compared with the control group,1)P<0.05; 2)P<0.01.
2.2哮喘可降低精子数量和活性 哮喘组的精子数目及活性均明显低于对照组(P<0.05,见表3)。值得注意的是,哮喘小鼠的精子计数为对照组的58.1%,而哮喘组小鼠的睾丸重量仅为对照组的87.4%。
2.3基因、蛋白质和酶水平上的改变
2.3.1哮喘组小鼠睾丸凋亡表达增加 按照标准方法对所有的基因组DNA进行了提纯,将每个样本中取出等量的DNA进行了琼脂糖凝胶电泳。结果发现,哮喘组DNA碎片显著增加(图1A)。这与Caspase-Glo®检测试剂盒所得出的结果一致,哮喘组小鼠caspase-3/7酶活性约为对照组的2倍(图1B)。结果表明哮喘小鼠睾丸中凋亡显著增加。
2.3.2哮喘小鼠组织病理学改变 组织学检查发现对照组小鼠的曲细精管中的生精上皮细胞生成精子过程正常(图2A)。 而哮喘组小鼠呈现出生精细胞的丢失/乱序/脱落等多种多样的变化(图2B),也观察到睾丸支持细胞的细胞质中有空泡形成。
2.3.3哮喘诱发生殖细胞凋亡的激活 用caspase-3单抗进行免疫组化,结果如图3所示,在哮喘组小鼠的精细胞/精母细胞/睾丸支持细胞/睾丸间质细胞中caspase-3染色显著增加。
2.3.4改变细胞凋亡相关基因的mRNA水平 采用之前混匀的对照组和哮喘组的样本,评估涉及程序性细胞凋亡通路或者缺氧信号通路的总共120个关键基因的转录表达。结果表明OVA致敏的哮喘小鼠的睾丸与对照组小鼠睾丸在7个基因组中表达存在很大差异,包括Bcl-2、Bax、BNIP3、caspase-9、caspase-3、AIF和HIF-1α,如图4A。对这些靶基因的特异性引物进行实时荧光定量PCR,进一步确定这10只小鼠的睾丸独自的cDNA样本的检测结果。所得的结果与之前对一组缺氧和细胞凋亡相关的基因进行的PCR阵列分析结果一致,如:在患有哮喘的小鼠的睾丸中Bcl-2、抗凋亡因子等等转录的表达都显著减少,然而促凋亡基因(包括Bax、BNIP3、caspase-9和AIF)的mRNA转录的表达都显著增多,哮喘小鼠模型睾丸中的HIF-1α的表达都增多。但是,实时荧光定量PCR的结果显示两组中caspase-3的表达差异不大。细胞色素c作为阴性对照,在两个小组中表达无明显差异。
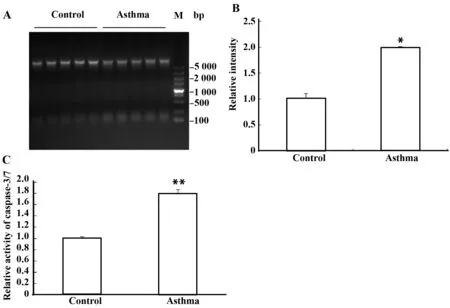
图1 哮喘小鼠睾丸细胞凋亡增强Fig.1 Apoptosis is enhanced in asthmatic mouse testisNote:A.DNA ladder assay was conducted for the 10 testis samples from control and asthma group;B.Quantification of the bands with lower molecular weight (about 150 bp) in Fig.A was done by using Image J software;C.Enzymatic activity of caspase-3/7 was measured for the testis homogenates using Caspase-Glo-3/7 assay kit,and the relative ratio was expressed in the bar graph.Compared with the control group,*.P<0.05;compared with the control group,**.P<0.01.
2.3.5凋亡相关基因的蛋白表达水平 如图5所示,哮喘小鼠睾丸中抗凋亡基因Bcl-2表达显著受损,而AIF和HIF-α却显著增多,与实时荧光定量PCR得出的结果一致。相反,Bax和细胞色素c的蛋白水平却不会因为患哮喘而改变(图5)。符合caspase-3/7酶活性,在哮喘小鼠中,半胱天冬酶-3的切割形式被显著诱导。提示哮喘小鼠模型中胱天蛋白酶途径凋亡的激活。
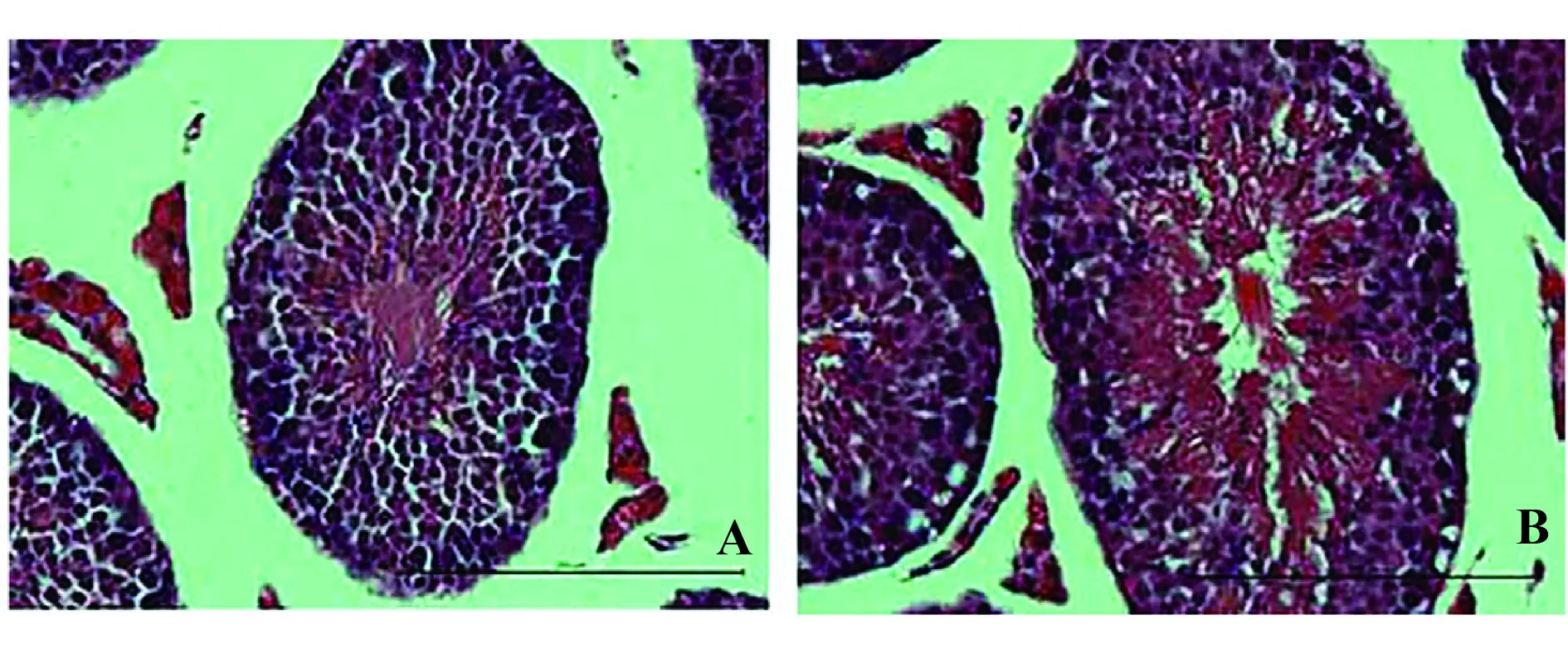
图2 睾丸组织学变化(HE,×1 000)Fig.2 Histological changes in testis(HE,×1 000)Note:A.Control group;B.Asthma group.
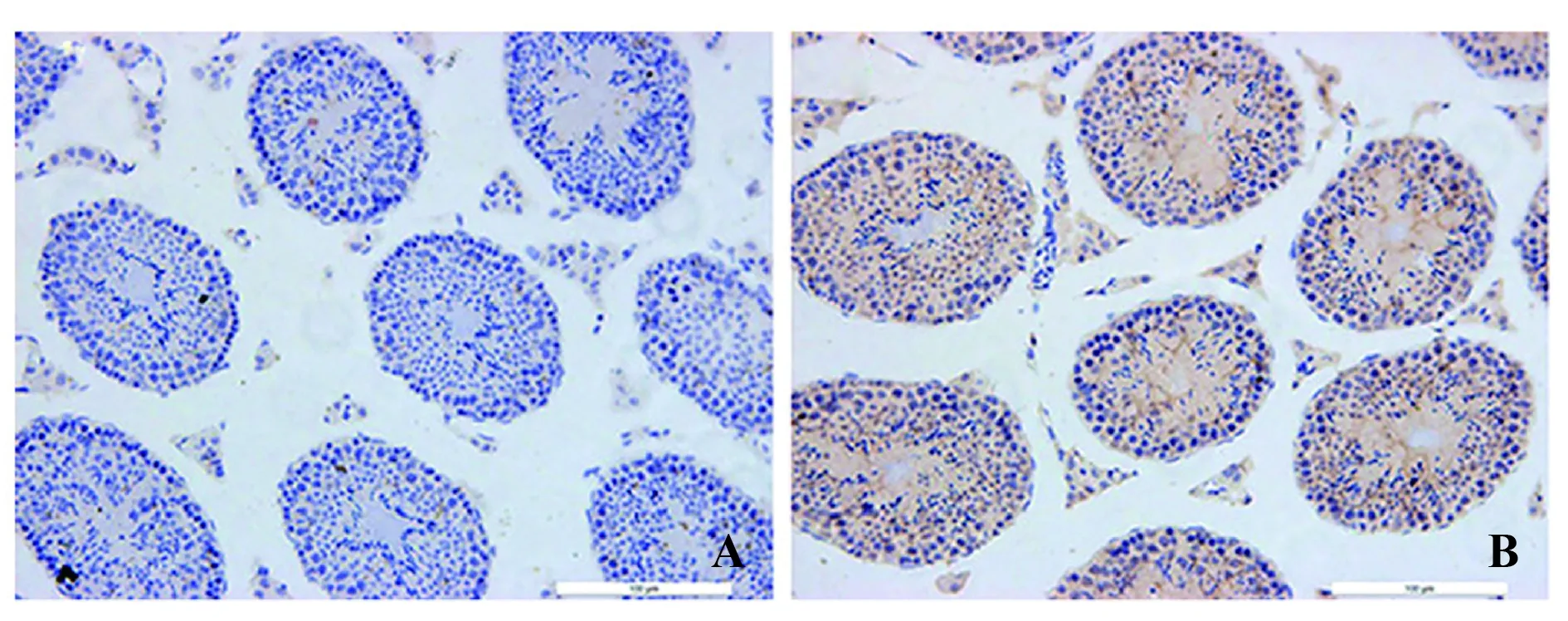
图3 睾丸免疫组化检测(×1 000)Fig.3 Immunohistochemisty assay for testis(×1 000)Note:The transverse sections of the testis were stained for cleaved caspase-3.A.Control group;B.Asthma group.
2.3.6哮喘激活小鼠睾丸组织中的caspase-9 结果如图6A所示,与对照小鼠相比,哮喘睾丸匀浆中caspase-9的总体活性显著诱导。说明Bcl-2-caspase-9通路在哮喘小鼠睾丸中被激活。通过监测细胞凋亡标记物多聚ADP核糖聚合酶(Poly-ADP-ribose polymerase,PARP)来检查每个睾丸的凋亡水平。与caspase-3的切割增加一致,在哮喘睾丸中,切割的PARP的蛋白水平显著上调(图6B、C)。而在哮喘组中,切割的PARP与全长PARP的比例显著增加(图6D)。 这些结果与哮喘性睾丸增强的DNA断裂一致,如DNA梯度测定(图1A)所示。
与PCR芯片数据一致,Bcl-2转录的表达在哮喘组小鼠的睾丸中明显减少,同时促凋亡基因包括Bax、BNIP3、caspase-9和AIF在mRNA水平的表达在哮喘小鼠的睾丸中明显的增加。HIF-1α的表达在哮喘小鼠模型中的表达显著增加。但是,实时荧光定量PCR表明在这两组小鼠中caspase-3的mRNA表达水平无显著差异。可能作为一个负反馈调节,细胞色素C的mRNA表达在哮喘组和对照组小鼠睾丸中并没有改变。
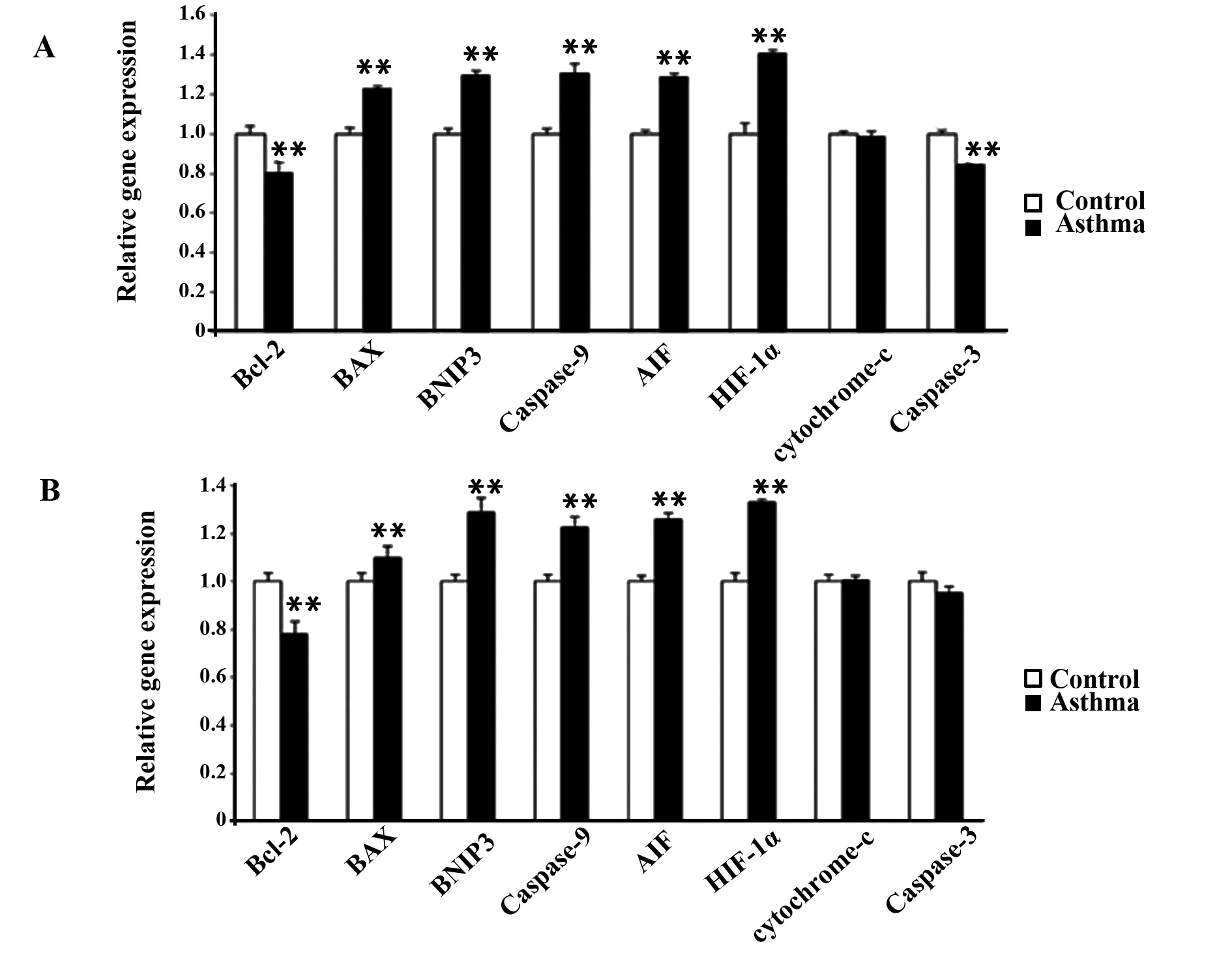
图4 凋亡相关基因的mRNA水平Fig.4 Relative mRNA level of several apoptosis-related genesNote:A.Equal amounts of RNA from 5 control or experiment mice were mixed well and split into two groups before cDNA synthesis;B.Equal amounts of RNA samples from the 10 mouse testes were aliquot individually and then subjected to cDNA synthesis respectively.Transcriptional expression of indicated genes was measured by real-time qPCR.Data were presented as with the control group,**.P<0.01.
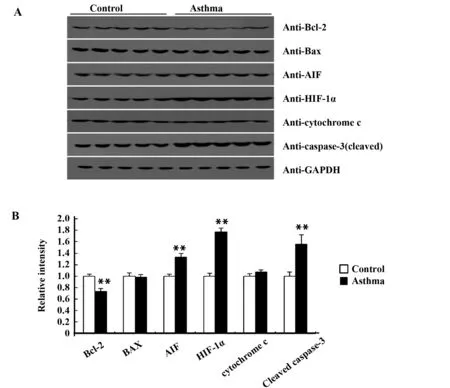
图5 凋亡相关蛋白的免疫印迹分析Fig.5 Western blot analysis of apoptosis related proteinsNote:A.Equal amounts of the protein homogenate from the testis tissue were immunoblotted with the indicated antibodies;B.Quantification of the protein expression level in Fig.A was performed using Image J software.Compared with the control group,**.P<0.01.
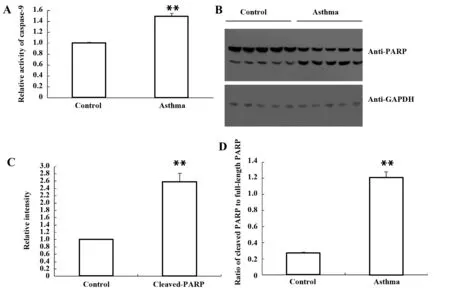
图6 哮喘激活蛋白酶caspase-9并增强小鼠睾丸中PARP的切割Fig.6 Asthma activates proteinase caspase-9 and enhan-ces cleavage of PARP in mouse testisNote:A.Enzymatic activity of caspase-9 in the testis homogenates was measured by Caspase-Glo-9 assay kit,and the relative ratio was expressed in the bar graph;B.Western blot analysis of the PARP (full-length and cleaved isoform).The relative level of cleaved PARP was determined using Image J software as demonstrated in the.Fig.C;D.The ratio of cleaved PARP to full-length PARP was shown based on the intensity calculated by Image J software.Data were expressed as with the control group,**.P<0.01.
3 讨论
哮喘可能直接影响儿童的身体发育。这是身体发育的一个重要决定因素尤其是年轻的危重型患者和没有适当治疗的哮喘患者[10]。然而,哮喘影响身体发育的确切机制尚未完全阐明。可能的原因包括组织慢性缺氧、经常失眠和疾病本身造成的心理压力,可能会影响正常的童年发育[11]。然而,不管是在哮喘儿童还是在哮喘动物模型中,哮喘和男性生殖功能紊乱之间的因果关系知之甚少。本研究通过计数哮喘小鼠模型精子数量和活性,发现哮喘可能干扰动物模型中成熟精子的数量和活性。进一步研究表明,细胞凋亡在此过程中起着至关重要的作用。患有哮喘的青少年的精子活性是否改变基本上仍是未知的。本研究结果显示OVA致敏导致的哮喘对小鼠的身体发育有很大的影响,包括体重减轻和睾丸重量减少。这些身体发育的缺陷可能直接影响哮喘小鼠睾丸的成熟精子细胞的数量。此外,精子能动性和生存能力下降的发现,表明除了身体发育,也有部分原因可能导致精子发生下降。通过DNA梯试验和免疫组织化学方法发现,与对照组相比,OVA诱导的凋亡在哮喘小鼠的睾丸中确实存在。进一步的研究验证了这一观点,并且证明了在OVA致敏的老鼠的睾丸中半胱天冬酶细胞凋亡通路被明显激活。事实上,据估计,多达75%的精子数量是由于程序性细胞死亡而丢失[12],而过程的失调可能会导致精子数量或能动性明显减少,从而导致男性不育。许多外在环境压力可能会导致睾丸细胞凋亡通路过度激活,包括高温、缺氧和一系列的化学危险品[13]。通过对HIF-1α表达式的归纳推理表明,在患有哮喘的情况下,缺氧可能是睾丸细胞凋亡升高的主要原因之一。此外,既往研究表明,精子的发生可能受许多其他因素的影响,如激素水平[14]。因此,除了细胞凋亡,生物学途径可能在OVA致敏的哮喘小鼠的精子的成熟和活性中发挥作用。为了阐明这一假说,在哮喘小鼠中应用细胞凋亡蛋白酶抑制剂来检测精子产生能否升至正常水平。之前已经证实,HIF-1α在哮喘小鼠模型的肺中及哮喘患者的肺泡灌洗液中表达增加,在这里,我们发现HIF-1α的表达也显著诱导哮喘睾丸mRNA水平和蛋白水平[15]。作为缺氧反应的关键调节器,HIF-1α蛋白表达可以诱导多种组织缺氧,形成异二聚体的转录因子HIF-1和HIF-1β[16]。反过来,HIF-1可以通过诱导高浓度的pro-apoptotic蛋白质,如BNIP3来启动细胞凋亡[17]。BNIP3的表达在哮喘睾丸PCR数组中得到证实。然而,据报道,抗凋亡蛋白,如IAP-2,也可能是在缺氧时产生,从而抵消了细胞凋亡过程。因此在诱导和阻止细胞凋亡的多种诱发因素之间可能存在一个错综复杂的平衡。除了BNIP3,促凋亡因素Bax、AIF和caspase-9的表达也相应增加,同时,在目前的研究中发现抗凋亡因子bcl-2的水平下降。与上述一致,这些蛋白质诱导哮喘睾丸进行细胞凋亡,而不是存活。然而,哮喘睾丸中 Bax、AIF和caspase-9诱发的上游通路以及bcl-2的抑制仍有待明确。作为细胞凋亡的下游事件,本研究检测了caspase-9 caspase-3/7,连同caspase-3和PARP的活性。这些结果说明与对照组相比,哮喘小鼠的细胞凋亡酶导致的细胞凋亡通路被显著激活,这可能是睾丸精子的生存能力和活性降低的原因。先前有报道称,细胞凋亡不完全是由细胞凋亡蛋白酶介导。其中,凋亡诱导因子(AIF)是第一个被发现不受细胞凋亡蛋白酶约束的足以诱导细胞死亡的细胞死亡效应器。AIF和细胞色素c可能从线粒体膜间隙流出,改变了细胞核的位置,这个位置可能通过核酸内切酶促进DNA片段化。有趣的是,PCR芯片发现凋亡诱导因子的转录水平有所提高,并且Western blot证实在哮喘小鼠睾丸中蛋白表达增加[18]。因此,细胞凋亡蛋白酶和不依赖细胞凋亡蛋白酶的细胞死亡效应蛋白器如AIF共同合作来诱导哮喘小鼠细胞凋亡。结合对Bcl-2/Bax的观察,这些结果共同表明,哮喘可能导致细胞凋亡的线粒体途径的激活。免疫组织化学显示的,大部分精原细胞和精母细胞发生凋亡,而只有小部分体细胞如支持细胞和睾丸间质细胞发生凋亡。因此哮喘小鼠睾丸的体细胞中的信使RNA和蛋白质水平可能会增加,这种增加可以直接改变整个caspase-9、caspase-3/7酶活性[19]。此外,某些细胞的丢失会使这些细胞产生的基因产物的相对水平改变[20]。在这种情况下,精子形成障碍可能导致一个简单的非生殖细胞的mRNA的表达增加。因此,很难区分哮喘组与对照组中发生细胞凋亡的睾丸中一个信使RNA或一种蛋白质的表达水平。
