戊型肝炎病毒与ING5相互作用的研究
2018-07-31,,,,,
,,, , ,
生长抑制基因家族((Inhibitor of Growth Family Member,ING)具有抑制肿瘤生长、改变细胞周期和引起细胞凋亡等生物学功能[1]。包括ING1,ING2,ING3,ING4和ING5五个成员,广泛分布在各个组织中。ING各个成员编码的蛋白不仅在结构上有相似的特性,在功能上既有相似之处又各具特点[2-3]。其中,ING5定位于人染色体2p37.3上,能和p53和p300相互作用,诱导细胞凋亡[4]。研究发现,肝癌细胞中ING5 mRNA比正常的肝细胞低,表明正常肝细胞到癌变的肝细胞过程中ING5受到明显的限制[5]。最近,Tang等人发现乙型肝炎病毒(Hepatitis B Virus ,HBV)能抑制ING 5的表达,过表达ING 5可抑制肝癌细胞的生长和诱导肝癌细胞凋亡[6]。
戊型肝炎病毒(Hepatitis E Virus, HEV),是一种经肠道传播,严重危害人类健康的病毒性肝炎病原体。HEV感染后,一般患者多为轻中型肝炎,常为自限性,但可引发急性肝炎、爆发性肝衰竭,大多数人感染是无症状的自限型感染,致死率较低,通常情况下是1%~2%,而孕妇感染HEV致死率较高,达到20%~30%[7]。但是在免疫缺陷或者低下的患者,如:器官移植患者,获得性免疫缺陷综合征患者和白血病患者等[8],可发展成慢性戊型肝炎。
目前HEV复制与ING5表达之间的关系尚未清楚,本实验旨在构建ING5真核表达载体和ING5荧光素酶载体,探究ING5与HEV之间的相互作用关系,为后期研究HEV复制对ING5的影响奠定基础。
1 材料与方法
1.1菌株、质粒和细胞 大肠埃希菌DH5α感受态、真核表达载体PGC、pBSK(+)-ING5克隆载体、含HEV全基因组序列 (strain KM01, KJ155502)的载体PUC-HEV、肺癌细胞系A549细胞和人肾上皮细胞系293T细胞均由昆明理工大学医学院病毒感染与免疫课题组保存。
1.2主要试剂 限制性内切酶、T4 DNA连接酶、MLV逆转录试剂、DNA marker DL2000和DL5000购自宝生物工程(大连)有限公司;DNA聚合酶和dNTP购自天根生化科技(北京)有限公司;Trizol和Lipofectamine 2000购自美国Invitrogen公司;质粒小量快速提取试剂盒和DNA胶回收试剂盒购自北京庄盟生物技术有限公司;DMEM培养基、胎牛血清和胰蛋白酶均购自美国Gibco公司;ING5多克隆抗体购自美国Proteintech公司;小鼠抗人的GAPDH多克隆抗体和HRP标记的山羊抗兔和山羊抗小鼠的IgG均购自美国KPL公司;氯仿和异丙醇等其他试剂均为分析纯。
1.3引物设计及合成 根据GenBank中ING5(ID: 84289)基因序列,经Oligo软件分析设计引物,序列如下:上游5′-3′:GACTAGTCTTCATCCAAAACGATGATGC,下游:5′ -3′CAAGCTTGCGTTCCAAAAAATACTTTATT,扩增片段大小为723 bp;引物由上海捷瑞有限公司合成。
1.4ING5片段扩增 培养293T细胞,汇合度达到70% ~80%时,弃培养基,并用1×PBS洗涤细胞2次。利用Trizol试剂盒提取细胞总RNA。按照MLV逆转录试剂盒说明书进行逆转录合成cDNA,反应条件为:42 ℃ 60 min,72 ℃ 15 min。以5 μL cDNA为模板,PCR扩增ING5基因,条件为:94 ℃ 3 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min,共35个循环;72 ℃ 15 min。扩增产物采用1%琼脂糖凝胶电泳鉴定。用DNA胶回收试剂盒进行片段回收。
1.5真核表达质粒PGC-ING5的构建 将PGC载体(见图1)和ING5 PCR产物分别经BamHΙ和HindIII双酶切,胶回收载体和目的基因片段,以T4 DNA连接酶16 ℃连接过夜,并转化大肠杆菌DH5α感受态,筛选阳性克隆,提取质粒,用BamHΙ和HindIII双酶切鉴定,并送生工生物工程(上海)股份有限公司测序,测序正确的质粒命名为PGC-ING5。反应体系如下:PGC载体骨架(200 ng)5 μL,目的片段(100 ng)12 μL,T4 DNA Ligase 1 μL,10×T4 DNA Ligase Buffer 2 μL,total 20 μL。
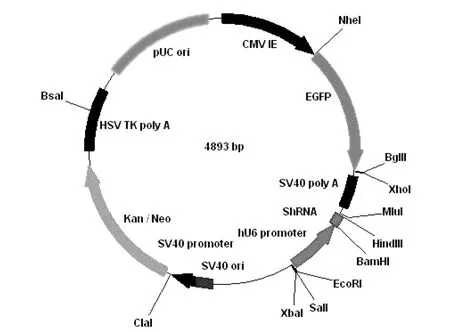
图1 PGC载体图谱Fig.1 PGC vector map
1.6293T细胞培养及转染 用含10%小牛血清的DMEM培养基,于37 ℃,5%CO2条件下培养293T细胞。生长状态良好的细胞接种至24孔板中,培养18~24 h,细胞达到80%~90%汇合度时,按照Lipofectamine 2000转染试剂说明书转染真核表达质粒PGC-ING5,6 h后弃去上清,每孔中加入1 mL含2%小牛血清的DMEM培养基继续培养。同时设计转染空载体PGC-ING5的细胞对照和未转染的细胞对照。
1.7Western blot检测ING5蛋白的表达 细胞转染48 h后,采用RIPA细胞裂解液裂解细胞,取10 μg总蛋白通过10%SDS-PAGE分离后,电转至PVDF膜,将膜置于10%的脱脂奶中4 ℃封闭过夜,加入ING5(1∶1 000)一抗室温孵育3 h。抗原抗体结合后以1×TPBS缓冲液漂洗3次,每次5 min,加入HRP标记的山羊抗兔二抗(1∶10 000),室温孵育l h,再以1×TPBS缓冲液漂洗5次,每次5 min,GAPDH(1∶5 000)作内参对照。ECL显影。
1.8ING5启动序列的获得 选取靶基因ING 5的3′UTR为启动序列。分别取5 μg公司合成的pBSK(+)-ING5克隆载体,利用限制性内切酶HindIII和SacI进行双酶切,反应体系如下:质粒(5 μg),15 μL;HindIII, 2 μL;SacI,2 μL;Buffer,2.5 μL;ddH2O,3.5 μL;合计25 μL。
按照上述体系进行双酶切,酶切反应条件为37 ℃,30 min,取酶切产物进行琼脂糖凝胶电泳,确定目的片段大小和位置,胶回收ING5启动片段。
1.9pMIR-Report载体骨架的获得 分别取1 μg pMIR-Report报告载体,其载体图谱见图2,利用限制性内切酶SacI和HindIII对其进行双酶切,反应体系如下:pMIR-Report质粒(1 μg)10 μL;HindIII,2 μL;SacI,2 μL;Buffer,2 μL;ddH2O,4 μL;合计20 μL。
按照上述体系进行双酶切,酶切反应条件为37 ℃,30 min,取酶切产物进行琼脂糖凝胶电泳,胶回收目的片段,作为重组载体的载体骨架。

图2 PGC载体图谱Fig.2 PGC vector map
1.10ING5荧光素酶载体构建 取胶回收的pMIR-Report载体骨架片段和ING5 -3′UTR启动片段,经T4 DNA酶连接酶进行连接,构建重组表达载体,连接体系如下:pMIR-Report载体骨架(200 ng)5 μL;目的片段(100 ng)12 μL;T4 DNA Ligase,1 μL;10×T4 DNA Ligase Buffer,2 μL;合计20 μL。反应条件为16 ℃过夜,转化DH5α感受态细胞。
1.11荧光素酶方法检测 1)293T细胞铺48孔板,24 h后转染PUC-HEV 70 ng和pMIR-Report-ING5 70 ng。
2)24 h后,细胞用PBS细3次,加入PLB 65 μL每孔,置室温摇床15 min。
3)收集2)中裂解物置200 μL EP管中,12 000 g离心5 min。取上清。
4)取20 μL上清加入100 μL LARII,进行Firefly luciferase activity检测。
2 结 果
2.1ING5片段的扩增 通过RT-PCR体外扩增,1%琼脂糖凝胶电泳分析显示,在723 bp左右出现特异性条带,目的片段扩增成功,见图3。

1: PCR扩增ING5目的片段;2: 空白对照;M: marker 2000。图3 PCR扩增ING5目的基因片段Fig.3 PCR products of ING5

1: PGC-ING5质粒双酶(BanH I和Hind III)产物;2: 未酶切PGC-ING5质粒;M: marker2000。图4 真核表达质粒双酶切产物的鉴定Fig.4 Identification of PGC-ING eukaryotic expression vector
2.2真核表达质粒PGC-ING5的鉴定 1%琼脂糖凝胶电泳分析显示,真核表达质粒PGC-ING5采用BamHΙ和HindIII双酶切鉴定,可见723 bp的目的基因片段,大小与预期一致,见图4。测序结果证明真核表达载体PGC-ING5构建成功。
2.3ING5蛋白水平的检测 文献报道HepG2细胞中ING5低表达,而293T细胞中高表达。采用Western Blot法,发现293T细胞中ING5高表达,在HepG2未转染组和转染空载组ING5低表达,而在转染真核表达载体PGC-ING5的实验组中成功过表达ING5。并且通过灰度分析,再次证明真核表达质粒PGC-ING5在HepG2细胞中成功表达,见图5和图6。

图5 Western blot 检测ING5表达情况Fig.5 Determination of ING5 expression by Western blot

图6 灰度分析ING5的表达情况Fig.6 Analysis of ING5 expression using image J software
2.4ING5荧光素酶载体的鉴定 1%琼脂糖凝胶电泳分析显示,pMIR-Report-ING5荧光素酶质粒采用SacI和HindIII双酶切鉴定,可见218 bp的目的片段,大小与预期一致,见图7。测序结果证明pMIR-Report-ING5荧光素酶载体构建成功。

1: 未酶切PGC-ING5质粒;2: pMIR-Report-ING5质粒双酶(SacI和HindIII)产物;M: marker2000。图7 pMIR-Report-ING5质粒双酶切产物的鉴定Fig.7 Identification of pMIR-Report-ING5 vector

图8 细胞内荧光素酶活性的变化Fig.8 The detection of luciferase activity
2.5ING5与HEV相互作用 为了进一步探究HEV与ING5之间的相互作用关系,我们将pMIR-Report- ING5荧光素酶质粒及PUC-HEV质粒转染239T细胞24 h后,对各组中荧光素酶活性进行检测。通过比较pMIR-Report-ING5转染组、空白对照组和PUC-HEV 与pMIR-Report-ING5共转染组的荧光素酶活性。结果显示,PUC-HEV 和pMIR- Report-ING5共转染组与pMIR-Report-ING5转染组相比,细胞中荧光素酶活性降低93.4%(见图8),表明 HEV明显抑制293T细胞中pMIR-Report-ING5荧光素酶的表达。证明 HEV与ING5之间具有直接相互作用。
3 讨 论
近年来,ING家族与癌症的发生和发展之间的关系引起人们的高度关注。已有研究发现肝癌细胞中ING1,ING2,ING4和ING5的mRNA表达均下调[9-11]。ING5是生长抑制基因家族主要的一员,在肿瘤细胞中的表达是至关重要的。ING5编码的肿瘤抑制蛋白,能抑制细胞生长并诱导凋亡。ING5在转录调控过程中能与肿瘤抑制基因相互作用[12]。
戊型肝炎在亚洲和非洲国家不断暴发流行,已经成为严重的全球性公共健康问题。2012年根据WHO报道,仅亚洲和非洲地区就有近2010万人感染HEV,其中7万人死于HEV感染所引发的重症肝炎,东亚和南亚已经成为HEV感染的重灾区,感染率占全球的60.6%,死亡率占全球的64.7%[13]。2014年发布的全国第三届病毒性肝炎调查报告显示:中国是戊肝的高发国家,HEV在全国不同省份的流行情况有较大差异,四川、贵州、成都、新疆、云南等成了新的HEV高发地区[14]。近年,我国戊肝的发病率一直呈持续上升的趋势。但是人们对HEV的复制机制和它与宿主的关系尚未清楚。
为进一步研究宿主基因ING5 与HEV之间关系,本文利用了荧光素酶作为载体,成功构建了pMIR-REPORT/ING5荧光素酶重组报告载体。利用荧光酶标仪对反应体系中(含有荧光素酶的细胞裂解液与反应所需的试剂混合体系)迅速衰减的黄绿色闪光(发射峰560 nm)进行检测。当底物过量时,发光量的总值与样品的荧光酶活性成正比,因此,可对荧光素酶报告基因的转录进行间接评估。荧光素酶报告系统为启动子及其上游基因活性的检测提供了一个灵敏、快速和安全的非放射性的检测方法。本文研究发现HEV明显抑制293T细胞中pMIR-Report-ING5的荧光素酶活性,说明HEV可能通过抑制 ING5为自身感染和复制提供有利条件。
综上所述, 本文初步研究发现HEV显著抑制ING5荧光素酶的活性,为下一步研究HEV复制机制提供实验基础,进而了解HEV与宿主细胞的相互作用关系提供了新的思路。
