海南1例感染类鼻疽伯克霍尔德菌的溯源调查
2018-07-31,,,,,,,
, , , ,,, ,
类鼻疽病(Melioidosis)是一种流行于热带、亚热带地区的自然疫源性传染病,可引起败血症、肺炎等严重临床表现,死亡率高达20%~40%[1]。此病的致病菌-类鼻疽伯克霍尔德菌(Burkholderiapseudomallei, 简称类鼻疽伯克菌)是一种革兰氏阴性腐生菌,栖息于热带地区的土壤、水体中,主要通过皮肤接触、气溶胶吸入、消化道等途径感染人和动物。类鼻疽的感染、发病通常受气候、宿主免疫状态、职业暴露机会等因素影响,但环境中是否存在类鼻疽伯克菌是判定类鼻疽疫源地的决定因素[1]。在东南亚、澳大利亚北部等世界主要类鼻疽流行区,高发病率与环境中类鼻疽伯克菌的高分离率呈正相关[2]。
海南省于1990年首次发现人类鼻疽病例[3],目前已成为我国类鼻疽病危害最为严重的地区之一。然而,目前对该地区类鼻疽流行病学,尤其病原菌的生态、地理分布特征,传播方式,感染途径等尚不明确,严重影响了防控工作的开展。以往曾有自海南外环境分离出类鼻疽伯克菌及其近缘相似菌-泰国伯克霍尔德菌的报道[4]。但以上研究中环境类鼻疽伯克菌的低分离率与当前海南类鼻疽的流行态势不能吻合,提示可能存在尚未了解的流行影响因素。此外,在海南地区,尽管已经证实外环境中存在类鼻疽伯克菌,但环境菌株与致病菌株间的关联尚未被证实过,这需要菌株间的遗传信息比对提供直接证据。
为深入了解海南地区类鼻疽病的流行原因,我们对海南一例类鼻疽患者的居住环境进行了病原学调查;通过基于分子分型技术的菌株同源性比对,进一步明确了感染来源,为类鼻疽疫情的科学防控提供了重要依据。
1 材料与方法
1.1病史 患者为男性,海南省三亚市某农场农民,于2014年6月因高热、泌尿道感染入院治疗。病人患糖尿病多年。病原学检查:采集患者尿道分泌物、静脉血;前者直接接种血平板,后者经血培养培养物接种血平板;分离出类鼻疽伯克菌各1株,分别命名为HN186,HN187(表2)。临床诊断:糖尿病合并类鼻疽性败血症;类鼻疽性泌尿系感染;脓毒血症。病人经美罗培南联合左氧氟沙星抗感染治疗,病愈出院。
1.2环境样品采集与菌株分离 病人住院期间,经患者及家属同意,参照“国际类鼻疽工作组”推荐的类鼻疽伯克菌环境采样策略及分离方案[5],采集患者居住地周围的泥土、稻田水、井水等环境样品共58份(29个采样点,每个点采样2份,采样量每份约50 g,见表1),立即送实验室进行菌株分离。简述如下:1)取10 g样品,加入Ashdown液体培养基20 mL,震荡培养24 h(42 ℃);2)吸取培养物100 μL,涂布于Ashdown选择性平板,37 ℃孵育,至48 h后每日观察菌落形态特征;3)挑取粉红或浅紫色、扁平、周边皱褶,有金属光泽的类鼻疽伯克菌疑似菌落,接种于Ashdown选择性平板用于进一步鉴定。
1.3 细菌学鉴定
1.3.1使用类鼻疽抗原检测胶体金试剂进行血清学鉴定,读取结果并记录。
1.3.2参照文献[4],通过16S rDNA基因序列,三型分泌系统(Type Ⅲ secretion system,TTSS1)、伯克霍尔德菌致死因子(BurkholderiaLethal Factor 1,BLF1)等类鼻疽伯克菌特异毒力因子的携带情况对疑似菌株进行鉴定。
1.3.3PCR检测泰国伯克菌样鞭毛基因簇(BurkholderiaThailandensis-like flagellar gene cluster, BTFC)/ 耶尔森菌样菌毛基因簇(Yersinia-like fimbrial gene cluster, YLF)携带情况[6]。BTFC引物:Btfc_orf18_forward(5′-GTC GAT TTC GGC TGC GAA ACA ACA-3′),Btfc_orf18_reverse(5′-ATG CCG TCG CAA CCA TTG ATG ATG-3′);YLF引物:BPSS0120_forward(5′-TGA CCC ATT CAG GCA AGG GAT TCT-3′),BPSS0120_reverse(5′-TCC GTC CTG TTC GGT GAT TTC GAT-3′)。PCR 反应体系及扩增条件同上。
1.4 分子分型及同源性分析
1.4.1多位点序列分型(MLST) 参照文献[7],收集菌株培养物并提取染色体DNA,然后进行ace、gltB、gmhD、lepA、lipA、narK、ndh等7个等位基因的PCR扩增及测序。测序结果校对后提交类鼻疽伯克菌MLST 数据库(http://bpseudomallei.mlst.net),获得等位基因序列号并确定菌株序列型(ST)。
1.4.2脉冲场凝胶电泳(PFGE) 实验步骤及电泳参数与以往文献相同[8],采用BioNumerics 5.0软件(比利时Applied Maths公司)进行同源比对及聚类分析。
1.4.3多位点可变数目串联重复序列分析(MLVA) 参照Bart等建立的类鼻疽伯克菌MLVA_4分型方案[9],提取菌株染色体DNA,然后进行4个VNTR位点(2341,1788,933,389)的PCR扩增。PCR产物送北京天一辉远生物技术有限公司进行毛细管电泳,根据GeneScan 500 LIZ DNA Marker(美国ABI公司)确定扩增产物长度。根据产物长度计算各VNTR位点的重复次数,并获得MLVA_4指纹谱。
2 结 果
2.1环境样品种类及菌株分离结果 采集的环境样品分为4种类型:患者居住地周围泥土、患者家芒果园泥土、患者家稻田泥土、患者及邻居家水井水;29个采样点的类型分布见表1。58份环境样品中共分离出3株类鼻疽伯克菌的疑似菌:HN85e、HN86e、HN161e,均来源于水井水(表1)。其中,HN85e、HN86e自类鼻疽患者家水井水分离,HN161e自邻居家水井水分离,两井相距约80 m。
表1 环境样品类型、分布及类鼻疽伯克菌分离培养结果
Tab.1 Types and distribution of environmental samples, results of isolation and culture of Burkholderia pseudomallei
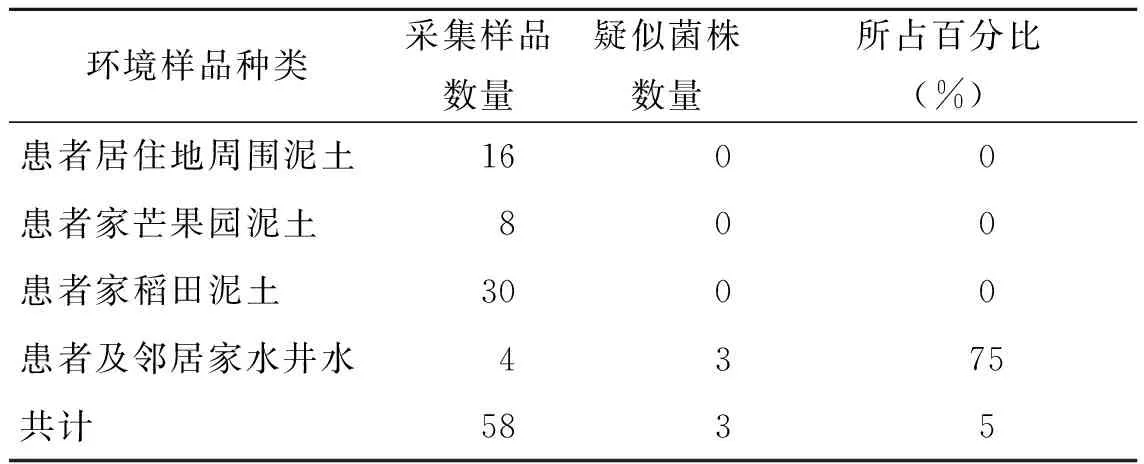
环境样品种类采集样品数量疑似菌株数量所占百分比(%)患者居住地周围泥土1600患者家芒果园泥土800患者家稻田泥土3000患者及邻居家水井水4375共计5835
2.2 分离菌株细菌学鉴定结果
2.2.1类鼻疽抗原血清学鉴定结果 HN186、HN187、HN85e、HN86e、HN161e均为阳性。
2.2.216S rDNA序列分析 经测序比对,病人分离株(HN186、HN187)、环境分离株(HN85e、HN86e、HN161e)的16S rDNA序列与类鼻疽伯克菌测序株K96243的16S rDNA序列同源性为100%。
2.2.3毒力基因携带情况 经检测,病人分离株(HN186、HN187)、环境分离株(HN85e、HN86e、HN161e)均携带TTSS1及BLF1相关基因(表2)。
2.2.4BTFC/YLF基因簇是重要的类鼻疽种群(澳大利亚/东南亚)指示标签[6],并且可用于类鼻疽伯克菌分子诊断。通过PCR检测,HN186、HN187、HN85e、HN86e、HN161e均为BTFC阴性,YLF阳性,符合东南亚群类鼻疽伯克菌特征(表2)。
表2 病人临床分离株、环境分离株来源及特异诊断基因携带情况
Tab.2 Sources of clinical isolates, environmental isolates and carrying status of specific diagnostic genes
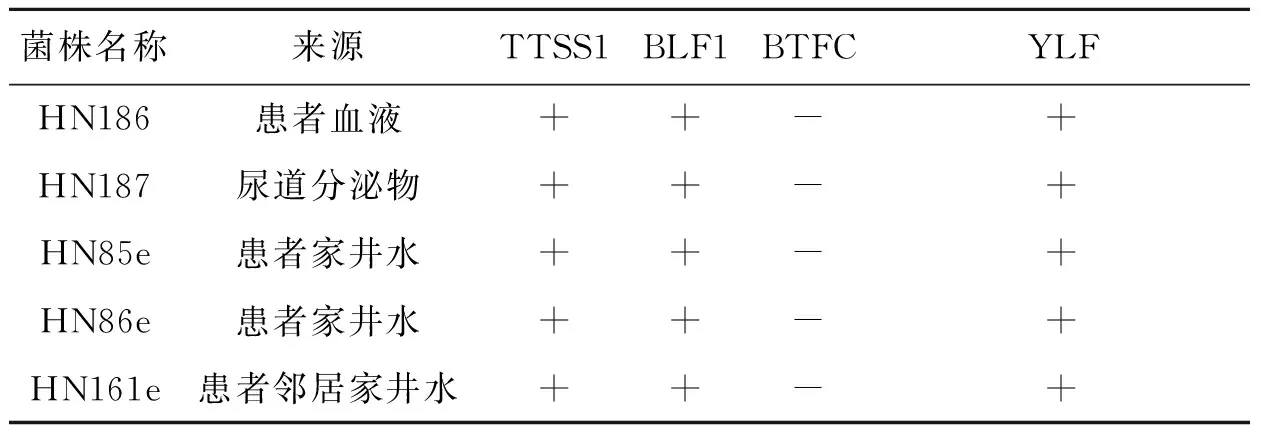
菌株名称来源TTSS1BLF1BTFCYLFHN186患者血液++-+HN187尿道分泌物++-+HN85e患者家井水++-+HN86e患者家井水++-+HN161e患者邻居家井水++-+
2.3 分子分型及同源性比对结果
2.3.1MLST分型 病人分离株HN186、HN187的ST型别相同,均为ST677(指纹谱:1,1,3,1,1,22,1)。环境分离株中,HN85e(ST677)与病人菌株ST型相同;HN86e(ST1394,指纹谱:1,1,6,1,1,29,3)、HN161e(ST376,指纹谱:1,4,2,3,8,4,3)与病人分离株分别在3个和6个等位基因存在差异。
2.3.2PFGE分型 病人分离株HN186与3株环境分离株的带型比对见图1。HN186与环境菌株HN85e带型相似度为100%;与HN86e、HN161e差异较大,带型相似度分别为82%、76%。
2.3.3MLVA_4指纹谱 病人分离株HN186、HN187的MLVA_4指纹谱与环境菌株HN85e相同(5,4,8,2);与其余两株环境菌株HN86e、HN161e完全不同(图1)。
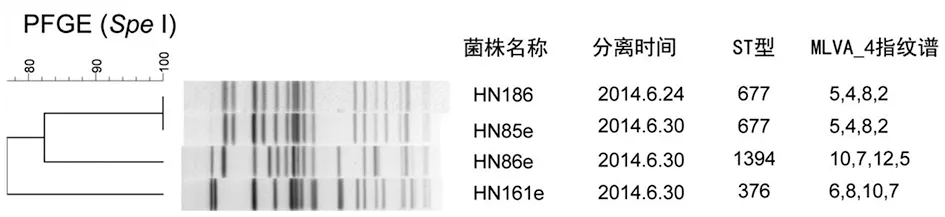
图1 病人分离株HN186与3株环境菌株的PFGE比对图Fig.1 Comparison of PFGE between HN186 isolated from patients and 3 strains of environmental strains
3 讨 论
溯源调查是传染病疫情处理过程中的重要环节,对于明确病原体来源,判断感染原因,制订防控措施意义重大。近年来,海南地区类鼻疽流行呈上升趋势,但是相关病例的感染源调查工作开展较少,对病原来源、感染方式的认知往往基于经验或者国外文献报道,缺乏实证,已经不能满足类鼻疽防控工作的要求。本次调查通过环境样品采集、菌株分离鉴定、分子特征比对等工作,发现并证实了一例类鼻疽病人的临床分离菌株与其自家水井水分离菌株同源,因此水井水很可能是引起类鼻疽病的感染源。以往海南类鼻疽流行病学报道中,农民占较大比例,因此推测职业暴露尤其水稻种植是海南类鼻疽病感染的重要原因[10]。本调查在病人家稻田、芒果园样品中未分离出类鼻疽伯克菌,但在居住地水井中分离到三株类鼻疽伯克菌,提示社区环境污染导致的类鼻疽感染应引起关注。与职业暴露相比,生活用水由于接触机会多,感染途径(皮肤接触、气溶胶、消化道等)多,因此引发类鼻疽病的危险性更大,可能引发更加严重的公共卫生问题。2011年及2012年,澳洲北部、泰国东北部均有生活用水污染引起类鼻疽流行的报道[11-12]。针对这一情况,卫生部门应加强水井等供水设施的卫生检测、卫生清理工作,保证水源安全;同时广泛开展类鼻疽病相关宣教工作,提高居民尤其糖尿病等易感人群对类鼻疽病及其防护措施的认知度。
分子分型技术在类鼻疽病疫情调查及溯源中已有成功应用。Mark等通过比较澳大利亚达尔文地区类鼻疽环境分离株、临床分离株的ST型别谱,发现部分临床菌株与井水分离株ST型相同,推测水井可能是重要类鼻疽感染源[12]。Bart等比较了澳洲北部一起类鼻疽暴发流行临床分离菌株的PFGE指纹谱,确认所有菌株为同一来源,并且与当地供水系统中类鼻疽分离菌株同源[13]。然而,类鼻疽伯克菌基因组学研究表明,受重组、回复突变、分辨能力等影响,仅依靠MLST或者PFGE的一致性,不能充分证明菌株相关性[14]。本次研究,我们引入了更加灵敏的MLVA-4分型方案。以上3种遗传标志,从不同方面证实外环境菌株与临床菌株间的遗传学关联,可靠性更高。
此次调查,明确了患者的感染来源,并为证明海南地区是类鼻疽的自然疫源地提供了实例。然而,相关病例感染途径、居民区水井被类鼻疽伯克菌污染的程度及原因等仍不确定,今后需进行更加广泛的流行病学调查工作。
