抗癌先导物T-OA脂质体的制备及性质研究△
2018-07-31王秀丽李士远王鹏龙曲昌海阮婧华
王秀丽,李士远,王鹏龙,曲昌海,阮婧华
(北京中医药大学中药学院,北京 100102;2.贵阳中医学院第一附属医院,贵州 贵阳 550001)
抗癌先导物T-OA(3β-羟基齐墩果烷-12-烯-28-酰基-3,5,6-三甲基吡嗪基-2-甲酯)是以临床常用抗肿瘤复方中的活性成分——齐墩果酸与四甲基吡嗪为原料,利用化学拼合原理,设计并合成的化学实体,分子式为C38H58N2O3,分子量为590.44。T-OA是具有结构新颖和多靶点特性于一体的化学结构,现已注册国家专利。研究表明,T-OA能较显著的抑制多种肿瘤细胞的增殖,防止肝癌转移肺细胞株LM3的侵袭,并且能够诱导癌细胞凋亡,对正常细胞毒性较低;能明显抑制CAM模型新生血管增生;对S180小鼠肉瘤的生长有显著抑制活性,抑制率达到50%;该药物安全性高,毒性小[1-5]。初步的药代动力学研究结果显示,由于T-OA的溶解性差,几乎不溶于水,影响药物吸收的速度和程度,其口服生物利用度小于10%,阻碍了药物的临床开发与应用。
脂质体作为药物载体具有靶向性、细胞亲和性与组织相容性,提高药物稳定性等优点。脂质体制备时用的磷脂等材料可生物降解,对机体无毒,故本实验尝试把抗癌先导物T-OA制备成脂质体,来改善其在体内的药动学行为,进而提高T-OA的生物利用度。
1 仪器与试药
1.1 仪器
Waters UPLC:二元溶剂管理系统、在线脱气机、自动进样器、 PDA 检测器( Waters公司,美国);Sartorius BS 110S型电子分析天平(北京赛多利斯科学仪器有限公司);超声波清洗器(昆山市超声仪器有限公司);DW-86L626 型超低温保存箱(青岛海尔特种电器有限公司);FD-1C-50冷冻干燥机(北京博医康实验仪器有限公司);Zetasize Nano ZS 纳米粒度仪(英国Malvern 公司);G16型医用高速离心机(白洋离心机厂)。
1.2 试药
抗癌先导物T-OA样品(北京中医药大学中药学院);抗癌先导物T-OA标准品(北京中医药大学中药学院);乙腈(色谱纯,Fisher Scientific );娃哈哈纯净水(杭州娃哈哈集团有限公司);大豆磷脂(西安凯新生物科技有限公司,德国Lipoid,S-100);胆固醇(美国 Amresco);海藻糖;乳糖;Emprove 低内毒素蔗糖(批号 K43921892)、Emprove低内毒素甘露醇(批号:M759903247)、Emprove 低内毒素甘氨酸(批号:VP559490329)、注射级有机溶剂(批号:DC4DF64301)均由默克化工技术(上海)有限公司提供。
2 T-OA含量测定方法的建立
2.1 色谱条件
色谱柱:ACQUITY UPLCTM BEH C18(1.7 μm,2.1 mm×50 mm);流动相:乙腈-水(98∶2);流速:0.4 mL·min-1;进样量:1 μL;样品室温度:4 ℃;柱温:30 ℃;检测波长:278 nm。
2.2 专属性试验
精密称取T-OA适量,以乙腈配制成一定浓度溶液,分别取空白破乳脂质体溶液、T-OA标准溶液、T-OA破乳脂质体,T-OA溶液进样分析,考察脂质体中的辅料在此条件下对T-OA的检测是否有干扰。由图1可知,磷脂、胆固醇等辅料对T-OA的检测没有干扰,专属性良好。
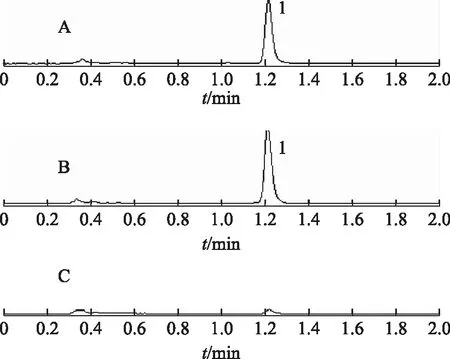
注:A.标准品;B.含药脂质体;C.空白脂质体;1. T-OA。图1 UPLC专属性试验结果
2.3 线性、精密度、重复性、稳定性及回收率试验
线性试验结果显示在4.176 ~125.28 μg · mL-1浓度范围内峰面积和浓度呈良好线性关系,方程为Y=2500X-98.978,r=0.999 9。精密度和重复性试验结果的RSD分别为0.56%和0.96%,均小于2%,符合要求。24 h内样品稳定性试验RSD为0.75%,小于2%,24 h内稳定性良好。回收率试验结果显示,高、中、低浓度组T-OA的平均回收率分别为101.79%、 98.89%、100.52%,处于 95%~105%之间,RSD值均小于2%,说明该方法的回收率符合要求。
3 脂质体的制备与处方优化
3.1 T-OA脂质体制备
本文采用冷冻干燥法[6-8]制备T-OA脂质体,具体操作如下:称取处方量的磷脂、胆固醇和T-OA,加适量的有机溶剂超声溶解,得到脂质液A;取一定量的保护剂加水超声溶解,得到保护剂溶液B,然后将A溶液和B溶液混合,混匀后,用0.22 μm微孔滤膜过滤,分装于西林瓶中,在-80 ℃冰箱中预冻13 h,取出放入冻干机中,冻24 h,冻干,取出即得T-OA脂质体。
3.2 包封率测定方法
本实验采用低速离心法[9]测定T-OA脂质体的包封率。取一定体积的脂质体,低转速条件下离心,精密移取上清液0.1 mL加适量乙腈超声破乳,UPLC测定药物含量为W1,另精密移取脂质体混悬液0.1 mL加适量乙腈超声破乳,UPLC测定药物含量为W2,包封率(Encapsulation efficiency,EE)计算公式:
EE(%)=W1/W2×100%
(1)
3.3 单因素实验
以包封率和粒径为评价指标,考察磷脂与胆固醇的比例、药脂比例(药物与脂质材料的质量比)、冻干保护剂的种类、糖脂比例以及有机溶剂与水的比例等因素对T-OA脂质体的影响,进而选出较佳的制备处方。
3.3.1 磷脂与胆固醇的比例对T-OA脂质体的影响 固定其他因素,将磷脂与胆固醇的比例设置成4∶1、6∶1和8∶1三个水平,按照3.1项下的方法制备脂质体,以包封率和粒径为指标,选出较佳的磷脂与胆固醇比例。
3.3.2 药脂比例T-OA脂质体的影响 固定其他因素,将药脂比例设置成1∶6、1∶8和1∶10三个水平,按照3.1项下的方法制备脂质体,以包封率和粒径为指标,选出较佳的药脂比例。
3.3.3 保护剂种类对T-OA脂质体的影响 固定其他因素,选用不同的冻干保护剂,按照3.1项下的方法制备脂质体,以包封率和粒径为指标,选出最佳的保护剂种类。
3.3.4 糖脂比例对T-OA脂质体的影响 固定其他因素,将糖脂比例设成5∶1、6∶1和7∶1三个水平,按照3.1项下的方法制备脂质体,以包封率和粒径为指标,选出较佳的药脂比例。
3.3.5 有机溶剂与水的比例T-OA脂质体的影响 固定其他因素,将有机溶剂与水的比例设置成1∶5、1∶3和1∶1三个水平,按照3.1项下的方法制备脂质体,以包封率和粒径为指标,选出较佳的有机溶剂与水的比例。
4 单因素实验结果
4.1 磷脂与胆固醇的比例筛选结果
实验结果如表1所示,根据粒径和包封率的数据,选择磷脂和胆固醇的比例为8∶1。
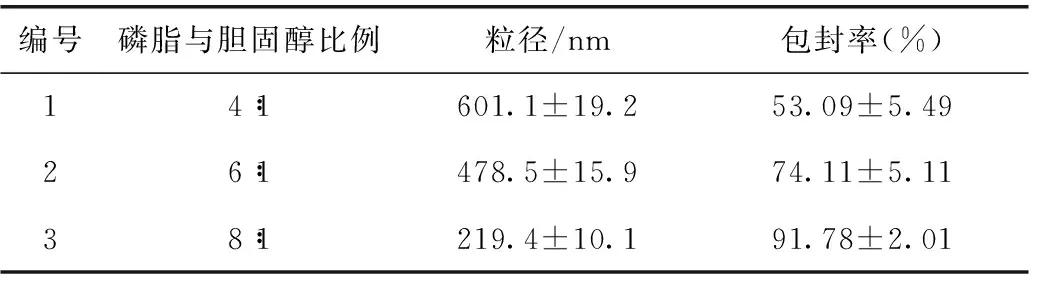
表1 磷脂与胆固醇比例筛选
4.2 药脂比筛选结果
实验结果如表2所示,根据粒径和包封率的数据,选择药脂比例1∶10。
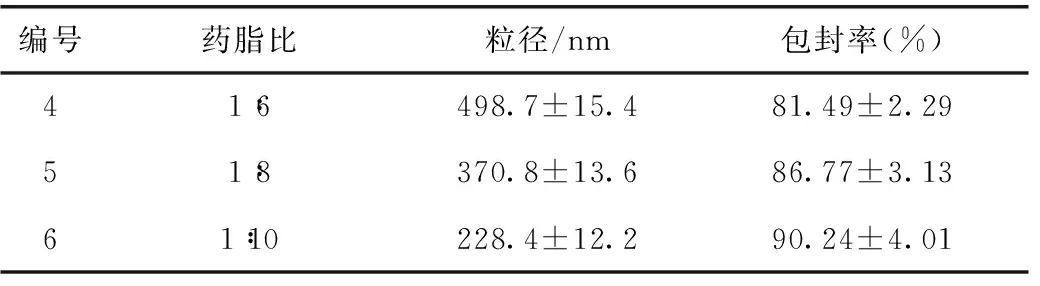
表2 药脂比例筛选
4.3 保护剂种类筛选结果
实验结果如表3所示,根据粒径和包封率数据,选出的保护剂为海藻糖。

表3 保护剂种类的筛选
4.4 糖脂比例筛选结果
实验结果如表4所示,根据粒径和包封率数据,最终选择糖脂比例为6∶1。
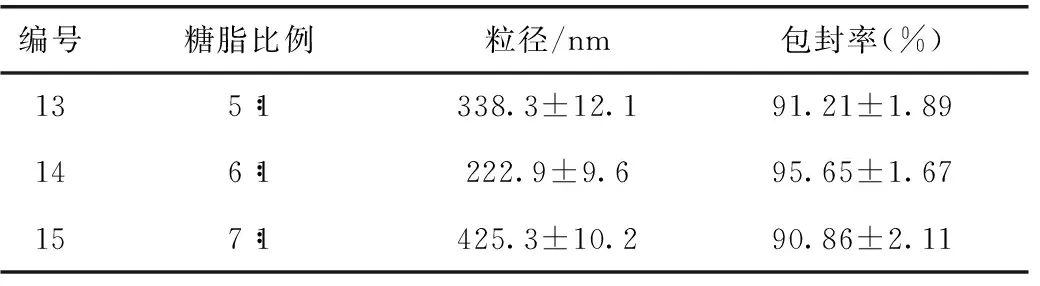
表4 糖脂比例筛选
4.5有机溶剂与水比例筛选结果
实验结果如表5所示,根据粒径和包封率数据,选择有机溶剂与水的比例为1∶3。
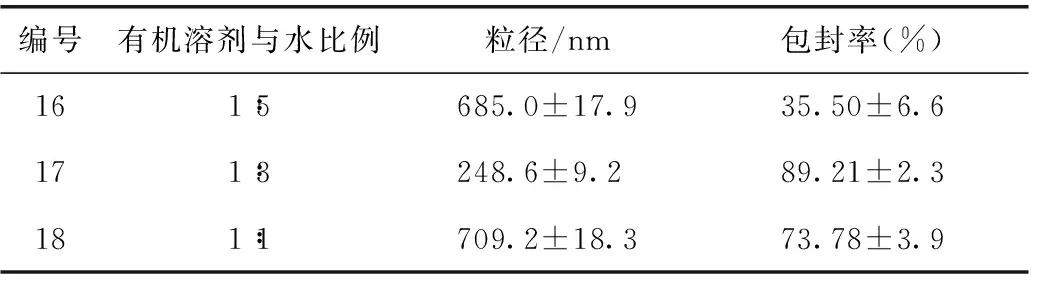
表5 有机溶剂和水比例筛选
综上,以包封率和粒径为评价指标,采用单因素实验筛选出的较佳处方为磷脂与胆固醇的比例为8∶1,药脂比例为1∶10,糖脂比例为6∶1,有机溶剂与水的比例为1∶3,保护剂为海藻糖。
按照选出的处方制备3批T-OA脂质体,并测定其粒径和包封率,计算实际值与预测值之间的偏差,结果显示偏差小于5%,说明单因素实验筛选得到的工艺条件参数准确。
5 T-OA脂质体药剂学性质的考察
5.1 粒径及电位
根据单因素实验筛选出的处方制备脂质体,然后用Zetasize Nano ZS 纳米粒度仪测定粒径和Zeta 电位。
5.2 体外释放实验
T-OA为脂溶性药物,几乎不溶于水,需选择一定的增溶介质。有资料研究表明[3,10],适当浓度的十二烷基硫酸钠和吐温80对T-OA有一定的增溶作用,且十二烷基硫酸钠的增溶效果较好,故选择0.5%十二烷基硫酸钠作为T-OA的体外释放介质。
精密平行吸取脂质体、同浓度的T-OA混悬液(T-OA经超声5 min后混悬分散于水中)各3份,每份3 mL置于100 mL 0.5%SDS释放外液中,在预处理好的透析袋中加入3 mL释放介质后浸没于释放外液中, 37 ℃水浴磁力搅拌,分别于0.5、1、2、3、4、6、8、10、12、24、30、36 h从透析袋内吸取2 mL释放介质(同时补加等量,同温的释放介质),测定T-OA的含量,计算药物的累计释放百分率并进行模型拟合。
5.3 稳定性实验
根据单因素实验采用筛选出的处方制备脂质体,分别于冻干当天,冻干后放置7 d,放置14 d,放置28 d测定其粒径和包封率。
6 药剂学性质考察结果
6.1 粒径与电位
根据选出的处方制备脂质体,测得的粒径、电位结果见图2、图3。
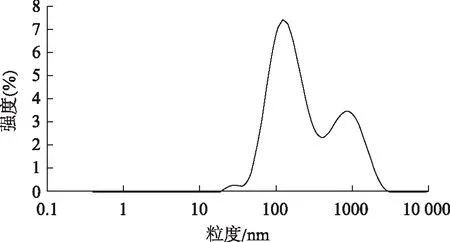
图2 T-OA脂质体粒径分布图

图3 T-OA脂质体Zeta电位结果
6.2 体外释放实验
如图4所示,脂质体中药物的累计释放率比原药的高,T-OA体外释放曲线符合Weibull方程,r=0.9895 。
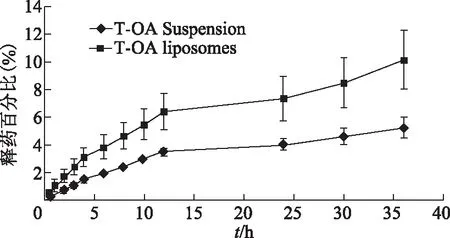
图4 体外释放结果
6.3 稳定性实验结果
实验结果如表6所示,从粒径和包封率可以看出,随着放置时间的延长,T-OA脂质体的粒径有所增大,但是粒径仍小于250 nm;包封率有所减小,但仍大于90%,说明冻干脂质体在一个月内是相对稳定的。

表6 定性试验结果
7 讨论
由于抗癌先导物T-OA溶解性差,几乎不溶于水,影响药物吸收的速度和程度,其口服生物利用度低,阻碍了药物的临床开发与应用。脂质体的磷脂双分子层,使其具有细胞亲和性与组织相容性,同时,难溶性药物能够以分子状态存在于磷脂双分子层,因此,将难溶性药物包载于脂质体能够促进其释放、吸收。本文的释放结果也很好地证明了将T-OA包载于脂质体能够促进其释放。
笔者同时也对T-OA脂质体的口服药代动力学进行了考察,并对T-OA的肠淋巴转运情况进行了研究。实验结果显示,T-OA脂质体口服给药后,由于血浆样品中药物含量小于最低检测限,无法在血浆样品中检测到T-OA。但在淋巴样品中能够检测到T-OA,且脂质体组药物在淋巴中的累积转运量显著高于T-OA混悬液给药,因为脂质体的脂性结构有助于增加T-OA 口服后的肠淋巴转运,促进T-OA吸收(另文发表)。
脂质体制备的方法有很多,常用的是薄膜分散法,但存在制备工艺繁琐、不适合工业放大、液态产品不稳定等问题。而冷冻干燥法[11]是一种低温下物质干燥的过程,优点:(1)能减少挥发性成分及受热变性成分(如磷脂)的损失;(2)干燥后体积、形状基本不变,复溶性好;(3)能保护易氧化的物质;(4)能提高稳定性,延长保存时间。故本实验选择用冷冻干燥法制备T-OA脂质体。
单因素实验结果显示,磷脂与胆固醇的比例、有机溶剂与水的比例对T-OA脂质体的包封率和粒径结果影响较大,其次是冻干保护剂、药脂比例、糖脂比例等因素。海藻糖[12]为葡萄糖的非还原双糖,在本实验中被选为冻干保护剂,它最明显的性质为在无水条件下有保护生物膜的能力。海藻糖是通过氢键与磷脂膜的极性基团结合起来稳定脱水的膜,有效地取代了在极性基团周围的残余水分,这种“水置换”改变了冻干脂质体膜组成的物理性质,阐明了缺少水的稳定性。但过量的冻干保护剂在冻干过程中会促进脂质体颗粒的聚集,使粒径和离散度均有一定增大,选用适当的冻干保护剂可提高包封率数据,最终选择的糖脂比为6∶1。
8 结论
本研究采用冷冻干燥法制备的T-OA脂质体包封率较高,提高了T-OA的溶解度,且建立了精密度、重复性、稳定性均良好的T-OA含量测定方法。使用冷冻干燥法制备T-OA脂质体,以包封率及粒径为指标,应用单因素法进行处方优化。最终确定的最佳处方为磷脂与胆固醇比例为8∶1,药脂比例为1∶10,糖脂比例为6∶1,有机溶剂与水比例为1∶3,冻干保护剂为海藻糖。此制备工艺简单,重现性及稳定性较好,适合工业放大生产,所得脂质体粒径均一,大小在200 nm左右,包封率为93.24%;体外释放结果显示T-OA脂质体的累积释放度比T-OA混悬液高,释放曲线符合Weibull方程。
