一株牛肠道病毒的分离与鉴定
2018-07-26宋文凤向文杰李德栋陈瑞红朱远茂
宋文凤,向文杰,林 俊,李德栋,陈瑞红,朱远茂,薛 飞
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,哈尔滨150069)
牛肠道病毒(Bovine enterovirus,BEV)属于小RNA病毒科、肠道病毒属,病毒粒子呈球形,无囊膜,直径30~40 nm。BEV为不分节段的单股正链RNA病毒,基因组全长约7500 nt,包括5'非编码区(5' untranslated region,5'UTR)、一个开放阅读框(open reading frame,ORF)及3'非编码区(3'untranslated region,3'UTR)。ORF编码一个大的多聚蛋白,经过一系列酶解后产生结构蛋白(VP1、VP2、VP3和VP4)和非结构蛋白(2A、2B、2C、3A、3B、3C和3D)[1]。
BEV感染牛一般引起轻度的腹泻症状[2],也可侵犯其他器官而引起呼吸系统疾病或流产[3-6],同时存在隐性感染。从患腹泻、肺炎、呼吸系统疾病及生殖障碍疾病的牛分泌物或排泄物中可分离获得BEV,也可以从正常牛的粪便样品中分离出。
1959年Moll和Davis首次分离获得BEV[7],随后很多国家和地区相继报道了BEV的分离鉴定[8,9]。国外牛群中BEV的血清学阳性率为17.6%~80%[10]。中国有关BEV的病原学及流行病学调查相对较少。2011年李英利等[11]首次在中国国内报道了牛肠道病毒的分离鉴定,随后又从北京市分离到1株牛肠道病毒。2013年彭小薇等[12]从北京市某牛场严重腹泻的泌乳奶牛直肠拭子中分离获得1株牛肠道病毒,并进行了全基因组序列测定。2013年第九次病毒分类报告将BEV重新分类为EV-E与EV-F[13]。分子进化树分析表明以上2株牛肠道病毒中国分离株(BHM-26、BJ50和BJ001)均为EV-F2[14]。2014年邢泽黎等[15]从吉林省肉牛场新发疫病分离出E种肠道病毒。2015年张海丽等[16]从山西省某奶牛场的泌乳奶牛粪便样品中分离得到1株牛肠道病毒,分析其可能为EV-E。
本实验室2017年1月从内蒙古发生呼吸道疾病的某牛场采集牛鼻拭子,用MDBK细胞进行病毒分离,获得1株病毒。经电镜观察、理化特性鉴定和序列分析表明该分离株为牛肠道病毒,命名为NM575,这是国内首次从表现呼吸道疾病的牛鼻拭子中分离到牛肠道病毒。
1 材料和方法
1.1 病料 内蒙古某牛场发生呼吸道疾病,病牛表现精神沉郁、流涕、咳嗽和呼吸窘迫等症状。采集30头牛的鼻拭子于含3%小牛血清的MEM中,冰袋保存并迅速运回实验室。
1.2 主要试剂 MDBK细胞由本实验室保存;基因组提取试剂盒、胶回收试剂盒和质粒提取试剂盒均购自 AXYGEN 公司;反转录酶和pMD18-T载体购自TaKaRa公司;dNTP、DEPC水、DNA Marker(DL2000)均购自Thermo公司。
1.3 样品处理与病毒分离 将鼻拭子浸出液经0.45 µm滤器过滤后接种于24孔板培养的MDBK单层细胞,每孔100 µL,37℃、5% CO2培养箱中吸附2 h后换液,逐日观察细胞病变(cytopathic effect,CPE)。未出现CPE的盲传3代后,出现CPE后继续传代,当CPE达到80%时收毒,-70℃保存。
1.4 病毒含量的测定(TCID50) 将分离株F4用维持培养液稀释至10-9,每个稀释度做8个重复,接种96孔细胞培养板中的MDBK细胞(100 μL/孔),并设正常细胞对照,置37℃、5% CO2培养箱中培养。每天观察细胞病变,共培养4 d,记录细胞病变孔数,根据Reed-Muench法计算TCID50。
1.5 电镜观察 将分离病毒接种MDBK细胞,待80%出现CPE后反复冻融3次收毒,2400×g离心15 min,取上清,再经4℃、13 800×g离心30 min,取沉淀,2%磷钨酸负染,进行电镜观察。
1.6 病毒的理化特性鉴定 对该病毒进行核酸型鉴定、乙醚敏感性试验、氯仿敏感性试验、胰蛋白酶敏感性试验、耐热性试验、耐酸性试验等理化特性鉴定。
1.6.1 病毒的核酸型鉴定 将MDBK传至 96 孔板,待其长至单层,将已知的RNA病毒牛副流感病毒3型(Bovine parainfluenza virus type 3,BPIV3)和DNA病毒牛传染性鼻气管炎病毒(Infectious bovine rhinotracheitis virus,IBRV)与分离的病毒NM575,分别用含100µg/mL的DNA 抑制剂 5-溴脱氧尿苷(BRDU)的维持液稀释至 100 TCID50,然后接种至MDBK细胞,同时设100µg/mL BRDU细胞对照组。每日观察CPE,48 h后收获细胞培养物,反复冻融3次后,接种至96孔板上长至单层的MDBK细胞,48 h后记录CPE情况并计算TCID50。
1.6.2 乙醚敏感性试验 取2 mL 病毒液与0.5 mL乙醚混匀置4℃过夜,次日900×g 离心 30 min,吸取下层病毒液并过滤除菌,于MDBK细胞中测定TCID50。
1.6.3 氯仿敏感性试验 病毒液以2400×g 离心30 min去除细胞碎片,取1.2 mL 上清与200 μL 氯仿混匀置4℃过夜,次日取上层病毒液并过滤除菌,于MDBK细胞中测定TCID50。
1.6.4 胰蛋白酶敏感性试验 取1 mL 病毒液与等体积0.5%胰蛋白酶溶液混匀(胰蛋白酶终浓度为0.25%),置37℃作用1 h,立即加入 4 mL 胎牛血清以终止胰蛋白酶的作用,过滤除菌后于MDBK细胞中测定TCID50。
1.6.5 耐酸耐碱性试验 分别取2 mL病毒液,将其pH调至3.0、5.0、9.0和10.0,置于 37℃水浴中作用1 h,再将pH调至7.0,过滤除菌后于MDBK细胞中测定TCID50。
1.6.6 温度敏感性试验 各取1 mL 病毒液,分别置于50℃和56℃水浴中作用30 min。各取1 mL 病毒液与等体积MgSO4(终浓度1 mol/L)混匀,分别置于50℃、56℃水浴中作用30 min。处理后的病毒液均于MDBK细胞中测定TCID50。
1.7 病毒的细胞嗜性 将分离的病毒NM575株分别接种于MDBK、BHK-21、PK-15、MDCK、Vero-E6、CEF、Marc145等细胞中,逐日观察,出现CPE及时收毒。收获的病毒液于MDBK细胞中测定TCID50。
1.8 病毒一步生长曲线 将分离毒株NM575按100 TCID50/0.1 mL 分别接种于 MDBK 细胞6小瓶,吸附1 h。用PBS 洗去未吸附的病毒,加入维持液,于5% CO2、37℃培养。分别于接毒后3、6、12、24、36、48 h收毒,收获的病毒液于MDBK细胞中测定TCID50,绘制生长曲线。
1.9 RT-PCR检测 参考GenBank中登录的牛肠道病毒BJ001株(HQ663846)全基因组序列,设计并合成特异性扩增P1基因的引物,引物序列为:P1F:5'-C C A A C T G A A C C T G G C G T A T-3',P 1 R:5'-GACTGTAGCCCGAAATCCC-3'。预期扩增片段大小为1338 bp。
按照AXYGEN病毒RNA小量提取试剂盒方法提取病毒基因组RNA。用下游引物作为反转录引物将RNA反转录为cDNA,再以cDNA为模板,进行P1基因的扩增。PCR扩增条件为:94℃预变性3 min;94℃变性30 s,50℃退火45 s,72℃延伸3 min,共30个循环;72℃再延伸10 min。PCR产物用1%琼脂糖凝胶电泳鉴定。将扩增片段进行胶回收,与PMD-18T载体连接,并转入感受态DH5α中,经培养后挑取单个菌落,摇菌后送吉林库美公司测序。测序结果与GenBank中登录的BEV参考毒株序列进行比较,利用MAGE6软件进行同源性分析,并绘制遗传进化树。
2 结果
2.1 病毒的分离结果 30份鼻拭子接种MDBK细胞后,第1代有1个样品出现CPE,表现为细胞圆缩集聚并突出于底层细胞表面,随着时间的推移,细胞破裂。进行病毒分离,获得的毒株命名为NM575。其他样品盲传后未见CPE。对照组细胞生长良好(图1)。
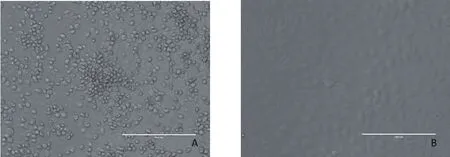
图1 病毒分离株NM575在MDBK中引起的细胞病变Fig.1 CPE caused by the isolate NM575 in MDBK cellsA: 接种病毒分离株NM575的MDBK细胞; B: 正常MDBK细胞A: MDBK cells inoculated with NM575; B: Normal MDBK cell
2.2 电镜观察结果 病毒分离株NM575接种MDBK细胞的上清,经电镜负染可观察到无囊膜的球形病毒粒子,直径大小约30 nm,与小RNA病毒粒子的特征相符(图2)。
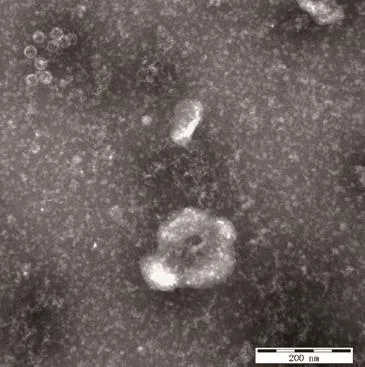
图2 分离株NM575病毒粒子电镜图Fig.2 Observation of the virions of the NM575 isolate under electron microscope(Bar=200 nm)
2.3 病毒的理化特性 100µg/mL的DNA抑制剂5-溴脱氧尿苷(BRDU)不能抑制分离株NM575的增殖,能够抑制DNA病毒IBRV,不能抑制R N A病毒B P I V 3,且对M D B K细胞无毒性,由此可判定该毒株为R N A病毒。分离株N M 5 7 5细胞培养物经乙醚、氯仿及胰蛋白酶处理后,TCID50与对照组比较无明显差异,表明分离病毒对脂溶剂及胰蛋白酶有一定的抵抗能力。耐酸耐碱试验结果显示,该病毒可抵抗pH3.0的酸性环境,但对pH9.0的碱性环境敏感。50℃30 min可使该病毒活性明显下降,56℃30 min可使病毒失活,表明该病毒对热敏感。在病毒培养物中加入终浓度为1 mol/L MgSO4后,经50℃或56℃30 min作用后其TCID50无明显变化,说明二价阳离子(如Mg2+)可提高分离病毒对高温环境的抵抗力(图3)。
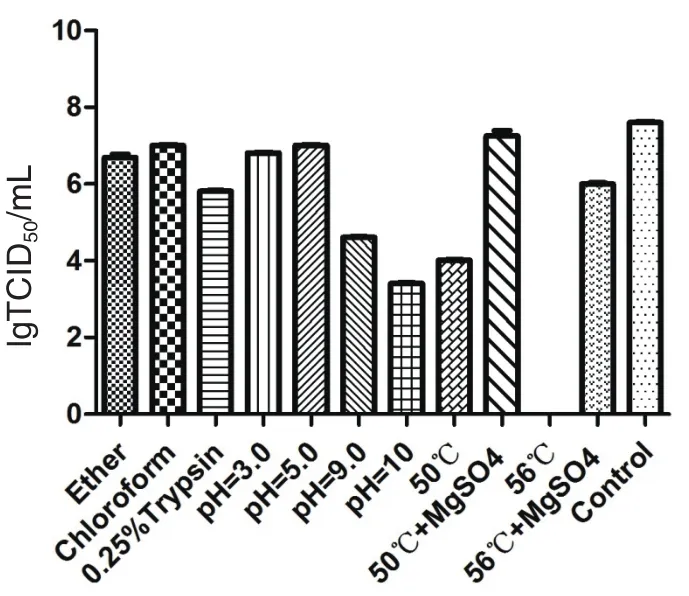
图3 分离病毒株NM575理化特性鉴定结果Fig.3 Physical and chemical properties of the isolated NM575 strain
2.4 分离株NM575的细胞嗜性 将分离株NM575接种到不同种属的细胞。结果表明在MDBK中最敏感,生长滴度最高,TCID50/mL可达107.6;在BHK、CEF和Marc145中较敏感,TCID50/mL为105.5左右;在PK-15中也可增值,但滴度较低,TCID50/mL为101.7;在Vero-E6中不增殖(图4)。

图4 分离病毒株NM575接种不同细胞后的TCID50Fig.4 TCID50 of the isolated virus NM575 strain in different kinds of cells
2.5 分离株NM575的生长曲线 分离株NM575在感染MDBK细胞后,3~24 h内病毒滴度不断上升并达到高峰,24 h后稍有下降,但仍保持在高滴度水平直至本试验结束,即接种后48 h(图5)。

图5 分离病毒株NM575的一步生长曲线Fig.5 The growth curve of the isolated virus NM575 strain
2.6 RT-PCR鉴定结果 以分离病毒RNA为模板经反转录制备的cDNA中,用牛肠道病毒引物扩增获得大小为1300 bp左右的特异性目的条带,与设计引物时参考的牛肠道病毒BJ001株(HQ663846)预测的大小相符,初步证明分离株NM575为牛肠道病毒(图6)。
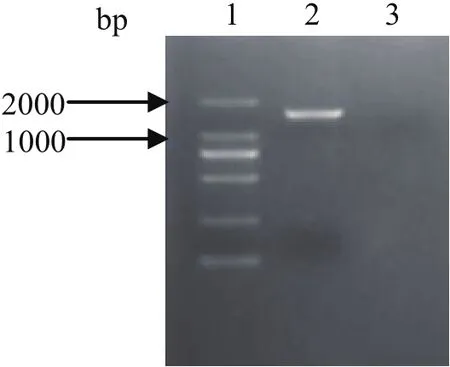
图6 分离病毒株NM575 P1基因的PCR鉴定Fig.6 Identif i cation of the isolated virus NM575 by PCR1: DNA分子量标准(DL2000); 2: 分离株NM575; 3: 水对照1: DNA Marker(DL2000); 2: NM575;3: H2O control
2.7 病毒分离株NM575的序列比对分析及分子进化树的构建 将病毒分离株NM575 P1基因序列与GenBank中登录的牛肠道病毒不同毒株,以及不同种属的肠道病毒参考株的P1序列进行比对,结果表明本研究分离株NM575与牛肠道病毒BEV-261株核苷酸同源率最高,达80%。经MEGA软件分析表明NM575与德国牛肠道病毒分离株BEV-261处于同一分支,证实分离株为牛肠道病毒。对基因序列进一步分析表明分离株NM575血清型属于EV-F,基因型为EV-F1(图7)。
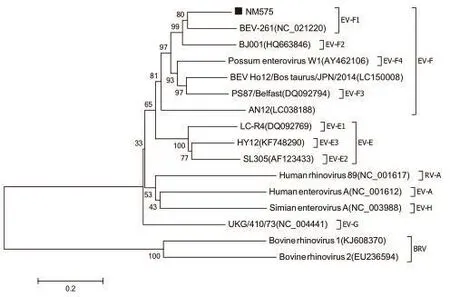
图7 病毒分离株NM575的P1基因进化树分析Fig.7 Phylogenetic tree analysis of the P1 gene of NM575 strain
3 讨论
牛肠道病毒属于小 RNA病毒科、肠道病毒属,为单股正链 RNA病毒。它具有典型的小 RNA病毒结构,主要抗原表位也集中在结构蛋白VP1上,但其致病力明显弱于同属的人肠道病毒,所以多年以来并未引起人们足够的重视。牛肠道病毒感染宿主广,易被感染动物排泄在粪便中,滴度较高并且在环境中存活时间较长,对环境及水源的污染较为严重。牛肠道病毒在全世界较为流行,其分离源包括患有牛肺炎和痢疾、呼吸系统疾病及发热、流产、脊髓水肿、腹泻、出血性肠炎等疾病的牛粪便及组织样本,这些都表明牛肠道病毒在一定程度上与一些临床疾病相关。国内已有5株牛肠道病毒被分离鉴定,其中3株(BHM26、BJ50和BJ001株)为EV-F2[14],2株(HY12与HLJ-3531/2013株)为EV-E,这些病毒均从表现腹泻的牛粪便中分离获得[11,12,15,16]。
本研究中病牛表现精神沉郁、呼吸困难、咳嗽、流涕等症状,发病牛数量多、发病率高,从症状和流行特点难于判断是由何种病原引起。国内牛呼吸道病流行病学调查显示,牛传染性鼻气管炎、牛副流感病毒3型和牛呼吸道合胞体病毒为牛主要呼吸道病毒性病原,因此对采集的30份牛鼻拭子进行了这3种病原的核酸检测,结果均为阴性。由于国内还未见从患呼吸道疾病的病牛鼻拭子中分离肠道病毒的报道,所以当时并未考虑牛肠道病毒的感染。为了查明本次疾病流行的原因,对30份牛鼻拭子用MDBK细胞进行病毒分离,结果分离出1株有CPE的病毒,命名为NM575。通过CPE、电镜观察和理化特性的鉴定,发现所分离的病毒符合小RNA病毒特点,因此设计牛鼻病毒和牛肠道病毒特异性引物进行核酸鉴定,结果用牛鼻病毒引物未扩增出条带,而用牛肠道病毒引物扩增出特异的阳性条带。对阳性条带进行克隆测序,进一步序列分析表明分离病毒NM575与牛肠道病毒BEV-261株核苷酸同源率高达80%。经MEGA软件分析,NM575与德国牛肠道病毒分离株BEV-261株处于同一分支,从而证实NM575为牛肠道病毒,为国内首次从患呼吸道病牛的鼻拭子中分离到牛肠道病毒的报道。有报道表明牛肠道病毒感染可引起牛呼吸道疾病的暴发,所以本次牛呼吸道疾病的暴发可能是牛肠道病毒感染所致。
病毒体外细胞培养结果显示,NM575可感染牛、仓鼠、猪、犬和鸡等多种动物细胞,尤其在牛源细胞中复制滴度最高,与相关文献报道中牛肠道病毒体外培养细胞嗜性相符。张海丽等[16]研究结果表明牛肠道病毒分离株HLJ-3531/2013株能够感染Vero细胞,而NM575在Vero-E6中不增殖。这可能是由毒株血清型的差异造成的,其中HLJ-3531/2013株为EV-E型,而本研究分离毒株为EV-F型。
2013年3月,经国际病毒分类委员会批准,重新将肠道病毒属进行归类,共分为12个病毒种,牛肠道病毒被重新分为肠道病毒E(EV-E)和肠道病毒F(EV-F),其中EV-E又包括4种基因型(E1、E2、E3和E4),EV-F又分为6种基因型(F1、F2、F3、F4、F5和F6)。肠道病毒P1区主要负责编码结构蛋白,该区域种内发生重组的概率很小,因此常作为肠道病毒分型的依据。本研究选取P1基因进行了序列测定和比对以及系统进化分析,结果显示分离毒株NM575与德国分离株BEV-261核苷酸同源率最高,处于同一分支,同为EV-F,基因型为EV-F1。
结合病牛临床症状、流行特点、病毒所致的细胞病变特征、病毒形态学特征、体外细胞培养嗜性和特异性RT-PCR鉴定结果,证明所分离毒株NM575为牛肠道病毒,基因分型为EV-F1。本研究结果提示我国患呼吸道疾病牛的上呼吸道中存在牛肠道病毒,为今后该病的诊断、流行病学调查以及牛肠道病毒免疫学、致病机理和免疫预防的进一步研究奠定了基础。
