猪源干扰素刺激基因PPBP荧光定量PCR检测方法的建立及初步应用
2018-07-26王飞飞郇贝丽魏建超邵东华李蓓蓓邱亚峰石元元钱莺娟马志永JUNGYongSam
王飞飞,刘 珂,郇贝丽,魏建超,邵东华,李蓓蓓,邱亚峰,石元元,钱莺娟,马志永,JUNG Yong-Sam
(1.南京农业大学动物医学院 教育部动物健康与食品安全国际合作联合实验室,南京210095;2.中国农业科学院上海兽医研究所,上海200241)
促血小板碱性蛋白(pro-platelet basic protein,PPBP)基因又名CXCL7。PPBP基因是一种干扰素刺激基因,IFN-α刺激细胞之后能够上调PPBP基因的表达,并且在猪繁殖与呼吸综合征病毒感染过程中PPBP的表达差异具有显著统计学意义,因此我们推测PPBP基因表达的蛋白或许参与了机体抑制PRRSV感染过程。目前对于PPBP的研究,大部分集中于人类肿瘤方面,PPBP抗病毒机制研究尚未见报道。SYBR GreenⅠ荧光定量PCR检测方法具有实时性、特异性、准确性、灵敏性的特点。本研究通过荧光定量PCR检测方法,建立标准曲线,用来检测PPBP基因表达情况。
1 材料与方法
1.1 主要试剂 大肠杆菌DH5α、胶回收试剂盒、无内毒素大量提取试剂盒购买自天根生化科技(北京)有限公司;Q5聚合酶购自New England Biolabs公司;SYBR®GreenⅠ反转录酶、限制性核酸内切酶购自TaKaRa公司;T4连接酶购自Thermo Scientific公司;7500 Real-Time PCR System(Applied Biosystems)、紫外分光光度计、涡旋振荡仪、琼脂糖凝脂电泳、凝胶成像系统购自上海达迈生物科技有限公司。
1.2 引物 根据GenBank数据库中猪PPBP基因序列,利用Beacon Designer 7针对其保守区设计特异性引物 Sus scrofa PPBP 1r:5'-AAATTGAGG GAAGAATGG-3'、Sus scrofa PPBP 2r:5'-ATGTT ACTGGGATGAATG-3'。利用Primer Premier 5.0引物设计软件设计猪的PPBP扩增引物Sus scrofa PPBP 1a 5'-GTGAAGCTTATGAGCCTCAGACTTGGCGC CATCT-3'、Sus scrofa PPBP 2a:5'-TATGAATTCA GCAGCTGACCCACCATCTTCCATTA-3',引物由Invitrogen公司合成并测序。
1.3 细胞和组织中总RNA的提取以及反转录 按照Trizol法提取PAM细胞中总RNA,以2 μL的RNA为模板进行反转录,体系(20 μL)包含:1 μL 随机引物、4 μL 5×反转录 buffer、2 μL DTT、1 μL dNTP mix(10 mmol/L)、1 μL的反转录酶(200 U/μL)、1 μL RNA RNase Inhibition(20 U/μL),以反转录的产物为模板。
1.4 阳性标准模板的建立 以Sus scrofa PPBP 1a和Sus scrofa PPBP 2a为上下游引物,通过PCR扩增、酶切、连接等过程构建重组质粒p3XFLAG-CMV-7.1-PPBP。PCR体系:cDNA 0.5 μL、上/下游引物各0.5 μL、dNTP 1 μL、5×buffer 5 μL 、Q5 0.3 μL、DEPC水 17.2 μL。PCR程序:98℃预变性30 s;98℃变性10 s,54℃退火30 s,72℃延伸20 s,总共35个循环;72℃再延伸10 min。扩增出的目的条带,与质粒P3XFLAG-CMV-7.1,分别进行HindⅢ、EcoRⅠ的双酶切,16℃过夜连接。构建好的重组质粒送去Invitrogen测序,测序结果经Blast比对,结果正确,即为重组质粒构建成功。
1.5 SYBR Green Ⅰ实时荧光定量PCR检测方法的建立
1.5.1 SYBR GreenⅠ实时荧光定量PCR体系的建立及优化 以质粒标准品为模板,反应体系为20 μL,分别对引物、模板、SYBR Green Ⅰ mix最佳使用量以及反应条件进行优化并绘制熔解曲线。
1.5.2 标准曲线的建立 将猪的PPBP质粒做10倍系列稀释,稀释至0.9×100copies/μL,并以系列稀释的标准质粒为模板,进行实时荧光定量PCR。反应体系:2×SYBRR Green premix Ex Taq II 10 μL、上下游引物各0.4 μL(25 pmol/μL)、ROX Reference Dye(50×)0.4 μL、DEPC水6.8 μL。反应条件:95℃预变性30 s;95℃变性5 s,60℃退火及延伸31 s,扩增40个循环。以Ct值为横坐标,以起始模板浓度的度数为纵坐标,绘制标准曲线。
1.5.3 敏感性检测 将荧光定量PCR产物进行琼脂糖凝胶电泳检测,以0.9×1010~0.9×100copies/μL阳性质粒为模板,进行普通PCR,验证敏感性。普通PCR体系(50 μL):H2O 40.7 μL、dNTP 1 μL、10×buffer 5 μL、Taq酶0.3 μL、上/下游引物各0.5 μL、模板2 μL。反应条件:98℃预变性15 s;98℃变性15 s,56℃退火15 s,72℃延伸 15 s,35个循环;72℃再延伸2 min。
1.5.4 重复性实验 使用3次不同批次的质粒标准品进行批内重复实验和批间重复实验。
2 结果
2.1 标准品的制备 将PCR扩增获得的猪PPBP基因与p3XFLAG-CMV-7.1相连,对构建的重组质粒进行酶切鉴定和测序,结果正确。
2.2 阳性质粒标准品的准备 将阳性质粒转化步骤,使用无内毒素大提试剂盒,最后通过紫外分光光度计检测出阳性质粒浓度为270 ng/μL。将浓度单位转化为copies/μL。通过公式(6.02×1023)×(质粒浓度ng/μL×109)/(质粒长度×660),计算得到浓度为0.9×1011copies/μL ,10倍系列稀释阳性质粒,梯度为0.9×1010~0.9×100copies/μL。
2.3 反应体系中各组分的优化以及反应条件的优化
2.3.1 反应体系中各组分的优化 分别在反应体系中加入不同浓度的引物和模板,检测结果的重复性和扩增效率,最后筛选出最佳反应体系(20 μL):2×SYBR Green premix Ex Taq II 10 μL 、上下游引物各0.4 μL(25 pmol/μL)、ROX Reference Dye(50×)0.4 μL、DEPC水 6.8 μL。
2.3.2 反应体系中反应条件的优化 分别改变荧光定量PCR的变性、退火温度,最终得到最佳反应条件:95℃预变性30 s;95℃变性5 s,60℃退火31 s。
2.4 标准曲线绘制 上游引物:5'-AAATTGAGGGAAGAATGG-3',下游引物:5'-ATGTTACTGGGATGAATG-3'。荧光定量体系(20 μL):SYBR Green Ⅰ 10 μL、上/下游引物各0.4 μL、ROX 0.4 μL、DEPC水 6.8 μL。程序:98℃预变性30 s;98℃变性5 s,60℃退火31 s,40个循环。产生熔解曲线程序:98℃ 15 s,60℃30 s。以0.9×1010~0.9×100copies/μL为模板进行荧光定量PCR实验,结果显示标准曲线为y=-3.2624x+39.963,R2=0.9916(图1),扩增效率为102%,其中y是Ct值,x是拷贝数的对数值。
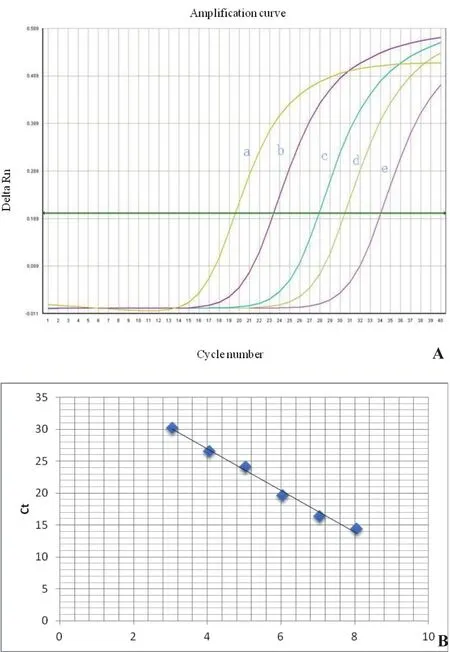
图1 实时荧光定量RT-PCR检测猪的PPBP的扩增曲线(A)和标准曲线(B)Fig.1 Amplif i cation curve(A) and standard curve(B) of real-time fl uorescent quantitative PCR
2.5 特异性与敏感性分析 产生的熔解曲线呈现单一峰值,扩增曲线呈现典型的S型曲线(图2)。检测结果显示,实时荧光定量PCR(图3)比普通PCR(图4)敏感1000倍,说明建立的荧光定量PCR具有较高的特异性和敏感性。
2.6 稳定性和重复性分析 将6个不同稀释度的标准品(0.9×109~ 0.9×104copies/μL)同批次重复8次,得到批内CV为0.3%~1.1%;将这6个梯度标准品分3次于不同时间点进行检测,得到批间变异系数CV为2.1%~4.7 %。结果表明该实验体系具有较好的稳定性和重复性(表1)。

图2 SYBR Green Ⅰ实时荧光定量PCR检测猪PPBP的熔解曲线Fig. 2 The dissociation curve of real-time SYBR GreenⅠf l uorescence quantitative PCR for porcine PPBP
图3 猪PPBP标准品实时荧光定量PCR检测结果Fig.3 Real-time PCR detection for porcine PPBP standardM: DNA 分子量标准(DL2000); 1~6: 初始模板浓度分别为0.9×109~0.9×104M: DNA Marker(DL2000); 1-6: Initial template number were 0.9×109-0.9×104, respectively

图4 猪PPBP标准品普通PCRFig.4 Regular PCR detection for porcine PPBP standardM: DNA 分子标准(DL2000); 0~10:0.9×100 ~0.9×1010 copies/μLM: DNA Marker(DL2000); 0-10: 0.9×100 –0.9×1010 copies/μL,respectively
2.7 临床应用 使用建立的荧光定量PCR方法,检测感染猪和正常猪肺脏、肝脏、肠系膜组织中PPBP的含量,结果见表2。结果表明不同组织之间,同种组织不同状态下,PPBP含量存在区别。
3 讨论
我国是一个农业大国,养殖业特别是养猪业的发展与我国经济发展密切相关。改革开放以来,我国养猪业保持着稳定持续的发展,已经成为畜牧业的支柱产业,对于农业经济发展、农业产业结构调整和农民收入的增加发挥着重要作用。然而,目前养猪业存在着大量的问题,其中猪病流行最为突出,每年都会造成巨大的经济损失,给我国养猪业带来严峻的挑战。
PPBP基因又名CXCL7,由此基因编码的蛋白称为促血小板碱性蛋白。在血栓形成中,由激活血小板释放,并且能够牵引中性粒细胞到达受伤位置发挥作用。CXCL7属于中性粒细胞激活细胞因子,N端有一个ELR基序,是CXCR2受体潜在的激活物。这个生长因子是一个有效的趋化物和激活物,可以刺激各种细胞过程,例如DNA合成、有丝分裂、糖酵解。另外PPBP表达蛋白是一个抗微生物蛋白,具有抗细菌和真菌活性。目前研究表明在人类吞噬细胞系中,PPBP可以抵抗结核分枝杆菌和嗜肺军团菌。人源PPBP有单体和二聚体两种形式。 PPBP基因由128个氨基酸编码,蛋白大小为14 kDa。PPBP有四种变异体,包括血小板基础蛋白(PBP)、连接组织激活肽Ⅲ(CTAP-Ⅲ)、血小板球蛋白(小板球)、中性粒细胞激活蛋白2(NAP-2)。本研究建立的PPBP SYBR Green Ⅰ实时荧光定量PCR的标准曲线斜率为-3.2624,扩增率为102 %,相关系数为0.9916。对三份不同批次的标准品分别进行3次批内重复和3次批间重复检测,变异系数均小于5%。结果表明初步建立的PPBP SYBR Green Ⅰ实时荧光定量PCR检测方法灵敏度好、特异性强、重复性好,可以定性定量检测猪样品中PPBP的含量,为深入研究PPBP的功能和机制奠定了基础。
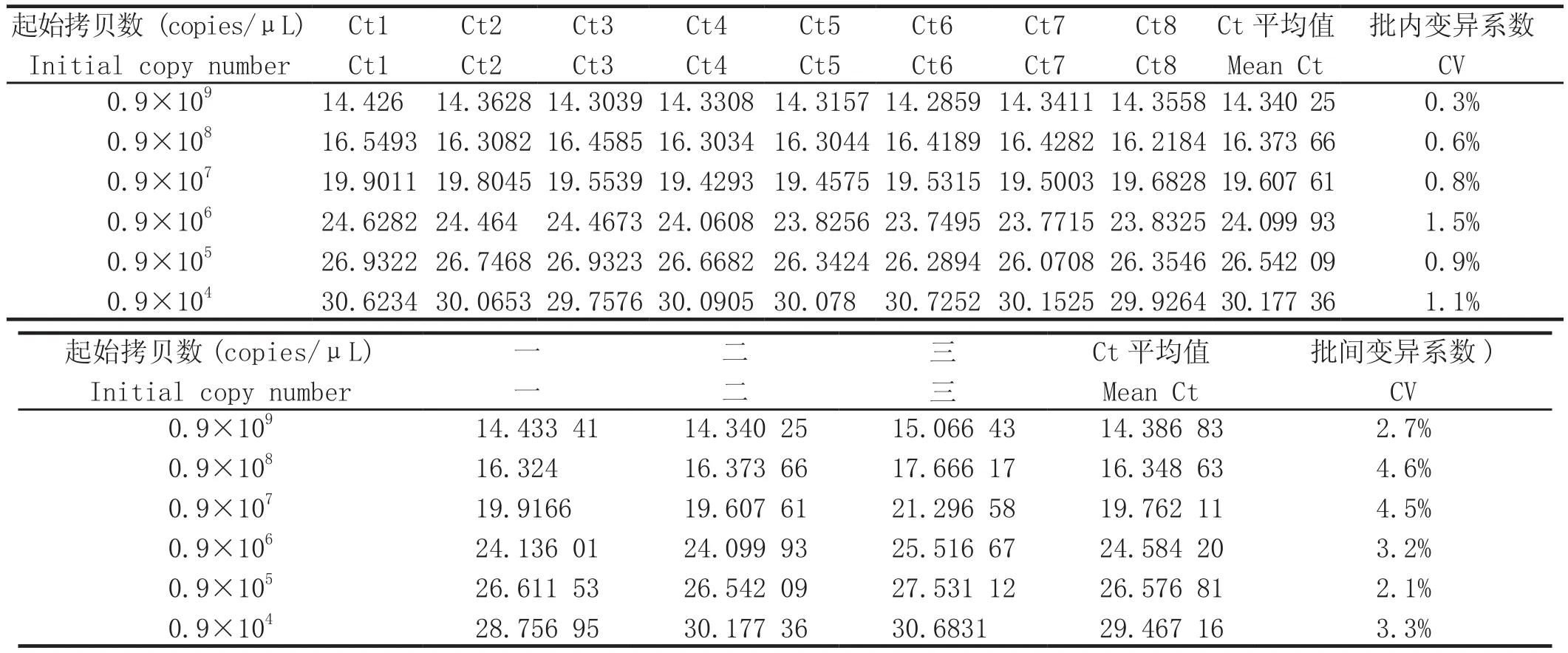
表1 标准曲线重复性检测Table1 Result of standard curve repeatability
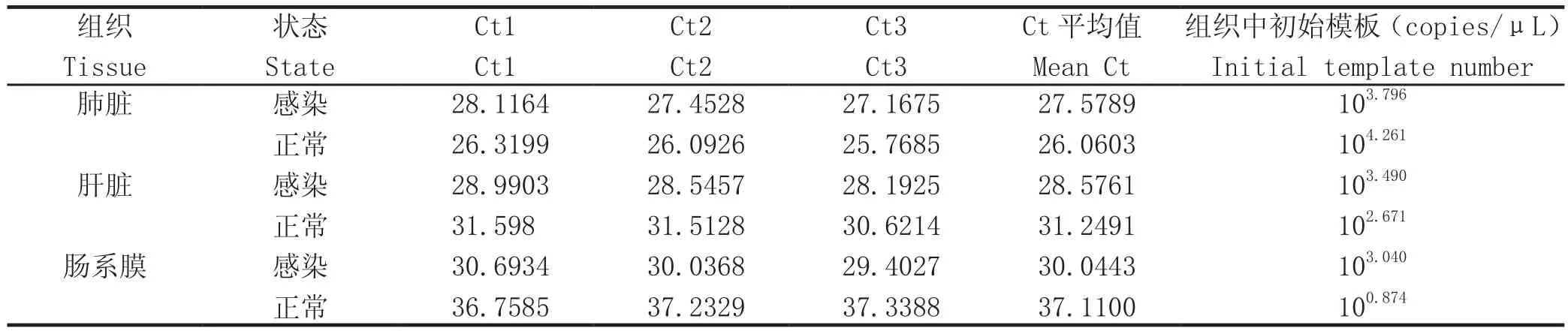
表2 SYBR GreenⅠ荧光定量PCR方法检测组织中PPBP的含量Table2 Detection results of PPBP in tissues by SYBR Green Ⅰreal-time fl uorescent quantitative RT-PCR
