蝙蝠流感病毒与H9N2亚型禽流感病毒M蛋白的免疫原性比较研究
2018-07-26刘宸瑞滕巧泱刘芹防李雪松陈鸿军车广胜任超超崔宏锐闫大为周伟光李泽君杨健美
黄 敏,刘宸瑞,滕巧泱,刘芹防,李雪松,陈鸿军,车广胜,任超超,崔宏锐,闫大为,周伟光,李泽君,3,杨健美,3
(1. 内蒙古农业大学兽医学院,呼和浩特 010018;2. 中国农业科学院上海兽医研究所,上海 200241;3. 上海市兽医生物技术重点实验室,上海 200240)
流感病毒属于正黏病毒科,根据NP蛋白和M蛋白的不同,可分为A型、B型、C型和D型4种类型[1]。A型流感病毒(Influenza A viruses,IAVs)是人类和动物中最普遍的流行病病原体。IAVs基因组由8个分节段的单股负链RNA组成。2009~2010年,Tong带领其团队捕获一批野生蝙蝠,通过解剖和分子检测,发现其内脏(包括肝脏、肾脏、肺脏及直肠)为流感病毒感染阳性,经过测序鉴定出两种新亚型的A型流感病毒,分别将其命名为H17N10和H18N11[2,3]。这两种新型流感病毒HA的氨基酸序列与已知IAVs的同源性在45%左右,NA的氨基酸序列与已知IAVs的同源性仅有24%[2]。目前为止,这两种病毒仅存在于一些野生蝙蝠中,尚未在禽类和其他哺乳动物体内被检测出[4]。由于蝙蝠流感病毒感染入侵方式可能与典型的流感病毒不同,且具有严格的细胞嗜性,通过体外拯救和培养蝙蝠流感病毒很难获得成功[5]。直到2016年 Moreira等[6]在MDCKII细胞和RIE 1495细胞上成功获得野生型蝙蝠流感病毒。
蝙蝠体内除了这两种新亚型流感病毒之外,可能还存在着其他亚型流感病毒的感染,但是研究报道极少。2015年Freidl等[7]首次报道利用HA蛋白抗体微阵列技术,在100只非洲果蝙蝠(frugivorous bats)体内检测到其他亚型A型流感病毒感染,其中H9亚型阳性比例最高,达30%。H9亚型禽流感病毒在家禽中普遍流行,可以直接感染人,并且还能够为其他致人死亡的流感病毒(H7N9、H10N8)提供整套或者部分内部基因[8]。蝙蝠流感病毒虽然与其他亚型流感病毒存在一定差异,但也具有IAVs变异能力强,易发生重组及基因突变的性质。通过反向遗传学技术可以获得A型猪和人流感病毒(TX98/H3N2、KS-107824/H3N2、PR8/H1N1)与嵌合蝙蝠流感病毒的重组病毒,并且发现M基因可以影响重组嵌合蝙蝠流感病毒的致病性[5,9]。如果在蝙蝠体内同时感染蝙蝠流感病毒与H9亚型流感病毒,那么两种亚型的流感病毒可能会发生重组,对人类健康和养禽业将造成巨大威胁。因此对蝙蝠流感病毒和H9流感病毒开展重组及其致病性研究具有重要意义。
流感病毒的第7个基因节段能够编码和指导翻译两个蛋白,即M1基质蛋白和M2离子通道蛋白。其中M1基质蛋白是流感病毒含量最为丰富的功能性结构蛋白。它不仅是病毒粒子核衣壳的主要组成成分,保持病毒粒子形态的稳定,还参与病毒粒子的结合、输出、转录等过程[10-12]。M2离子通道蛋白是一种较为保守的跨膜蛋白,具有较高的同源性,含量虽少但却存在于病毒感染细胞的细胞膜上,是除了HA和NA之外的膜蛋白。M2主要通过调节细胞的pH值,使其形成一个酸性环境来帮助病毒脱壳和释放[11-13]。综上所述,M1和M2在流感病毒的组成和功能中都起到重要作用。对新发现的蝙蝠流感病毒(H17N10和H18N11)和其他A型流感病毒的M1、M2氨基酸序列进行同源性分析,结果发现蝙蝠流感病毒的M1与其他亚型的同源性为78%左右,蝙蝠流感病毒的M2与其他亚型的同源性更低,为42%左右,我们推测蝙蝠流感病毒的M蛋白与其他A型流感病毒的M蛋白之间存在着免疫原性的差异。因此,本研究对蝙蝠流感病毒(Bat09/H17N10)以及H9N2禽流感病毒(A2093/H9N2)进行了体外M1、M2蛋白的原核和真核表达以及病毒的细胞感染,通过不同抗体进行免疫印迹和免疫荧光鉴定,比较其免疫原性,为今后进一步研究M1、M2蛋白的生物学功能提供基础。
1 材料与方法
1.1 载体、质粒、细胞和病毒 pET30a载体、pGEX-4T-1载体、pCAGGS载体、Bat09/H17N10-M(A/little yellow-shouldered bat/Guatemala/164/2009)构建在pHW2000质粒上和A2093/H9N2-M构建在pCAGGS质粒上、293T(人胚肾细胞)和MDCK(犬肾细胞)、嵌合蝙蝠流感病毒(Bat09:mH9mN2)、H9N2禽流感病毒(A/chicken/Jiangsu/A2093/2011,A2093/H9N2)均由中国农业科学院上海兽医研究所动物流感病原生态学创新团队保存提供。
1.2 试剂 Phanta Max Super-Fidelity DNA Polymerase、T4 DNA连接酶购自诺唯赞公司;EcoR I、Sac I、BamH I、Xho I、Hind III限制性内切酶购自NEB公司;DNA 纯化回收试剂盒购自Qiagen公司;小剂量质粒(去内毒素)抽提试剂盒购自Omega公司;Mirus 293T转染试剂、OPTIMEM、DMEM、FBS均购自Invitrogen 公司;E.coli DH5α和BL21(DE3)感受态细胞购自Invitrogen公司;Influenza A virus M1(matrix protein) antibody(A/Puerto Rico/8 /1934(H1N1))、Influenza A virus M2 antibody(A/Puerto Rico/8/1934(H1N1))均购自Gene Tex公司;Influenza A M2 Antibody (14C2)(A/WSN/1933(H1N1))、羊抗鼠(FITC标记)IgG、羊抗兔(FITC标记)IgG购自Thermo公司;羊抗鼠(HRP标记)IgG、羊抗兔(HRP标记)IgG购自Invitrogen公司;H9N2病毒(A/Chicken/Shanghai/343/2009) M1的单抗3G8、5F2[14]均由上海兽医研究所动物流感病原生态学创新团队保存。
1.3 M1、M2氨基酸比对 查阅相关文献,并在NCBI网站下载目前所有蝙蝠流感病毒和其他亚型的流感病毒代表株的M1和M2氨基酸序列,通过MEGA6软件,利用Neighbor-joining算法,Bootstrap取值1000,对下载的43株不同亚型的流感病毒进行同源性比对分析和进化树绘制。
1.4 M1、M2原核表达载体的构建 以Bat09/H17N10-M质粒和A2093/H9N2-M质粒为模板,用表1中的BamH I-Bat-M1-F、Hind III-Bat-M1-R和BamH I-A2093-M1-F、Xho I-A2093-M1-R为引物,通过高保真酶PCR反应分别扩增M1的基因全片段;根据文献[15],M2基因去跨膜区(69~127 bp)才能进行原核表达,故设计表中的引物并加上编码4个甘氨酸(GGTGGTGGTGGT)的序列为融合重叠氨基酸序列,以BamH I-Bat-M2-F、Bat-M2-69-R;Bat-M2-127-F、Xho I-Bat-M2-R;BamH I-A2093-M2-F、A2093-M2-69-R;A2093-M2-127-F、Xho I-A2093-M2-R为引物,PCR分别扩增M2前后两个片段,并以此两个片段为模板,进行融合PCR获得去跨膜区的M2片段,获得的扩增产物经2%的凝胶电泳进行鉴定。将目的片段切胶回收纯化后,用BamH I、Hind III和BamH I、Xho I双酶切,37℃温育3 h,再次纯化后将M1连接至经相同酶切处理的pET30a载体上,将M2连接至经相同酶切处理的pGEX-4T-1载体上,然后转化到DH5α感受态中,在含氨苄青霉素和卡那霉素的LB平板上筛选出阳性菌落,经PCR初步鉴定后送样测序。
1.5 M1、M2真核表达载体的构建 以Bat09/H17N10-M质粒和A2093/H9N2-M质粒为模板,用表2中的EcoR I-Bat-M1-F、Sac I-Bat-M1-R;EcoR I-A2093-M1-F、Xho I-A2093-M1-R和EcoR I-Bat-M2-F、Sac I-Bat-M2-R和EcoR I-A2093-M2-F、Xho I-A2093-M2-R为引物,通过高保真酶PCR反应分别扩增M1和M2的基因全片段,反应条件:95℃预变性2 min;95℃变性30 s,58℃退火30 s(M1),62℃退火20 s(M2),72℃延伸1 min(M1),72℃延伸35 s(M2),扩增30个循环;最后72℃延伸5 min,4℃保存。获得的扩增产物经1.5%的凝胶电泳进行鉴定,将目的片段切胶回收纯化,用EcoR I、Sac I和EcoR I、Xho I双酶切,于37℃温育3 h,再次纯化后16℃过夜连接至经相同酶切处理的pCAGGS载体上,然后转化到DH5α感受态,经过含氨苄青霉素的LB平板筛选出阳性菌落,PCR初步鉴定后送样测序。

表1 构建原核表达质粒pET30a-M1和pGEX-4T-1-M2的扩增引物Table 1 Amplif i cation primers for constructing prokaryotic expression plasmids of pET30a-M1 and pGEX-4T-1-M2
1.6 M1、M2原核诱导表达 按照去内毒素小提质粒试剂盒说明书抽提测序正确的重组阳性质粒,并与未插入任何外源基因的pET30a空载体、pGEX-4T-1空载体一起转化到诱导表达菌BL21(DE3)中,筛选挑取阳性单克隆菌落,分别接种到2 mL含氨苄青霉素和卡那霉素的LB培养液中,37℃、270 r/min恒温振荡箱中培养过夜。取活化过夜的菌400 μL稀释到6 ml LB液中,待OD值为0.4~0.6时,加IPTG 30 μL(终浓度为1 mmol/L)继续培养6~8 h,10 000×g离心1 min收获菌体,用300 μL PBS 重悬菌体超声裂解离心,在收集的上清和沉淀中加SDS上样buffer(终浓度1×),97℃金属浴10 min,10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)进行分离,考马斯亮蓝染色30 min,鉴定M1、M2的表达。
1.7 蛋白质免疫印迹(Western blot)鉴定 将重组菌与空白菌经10% SDS-PAGE分离后,转印至NC膜(硝酸纤维素膜)上,封闭过夜。将M1多抗、M2多抗和M2单抗按1∶1000稀释;M1单抗-3G8和M1单抗-5F2按1∶500稀释。二抗为HRP标记的羊抗鼠IgG和羊抗兔IgG,均为1∶2000稀释,加上ECL显色液后经仪器曝光进行拍照。
1.8 M1、M2真核转染表达与病毒感染 构建的真核表达质粒pCAGGS-M1和pCAGGS-M2经去内毒素小提质粒后各取500 ng,用Mirus 293T转染试剂按500 ng/孔(12孔板)转染至细胞密度为85%左右的293T细胞中,转染28 h后用4%多聚甲醛固定液进行固定(300 μL/孔),4℃保存备用。
将嵌合蝙蝠流感病毒Bat09∶mH9mN2与A2093/H9N2病毒测定TCID50后,按MOI=0.001接种至细胞密度为85%左右的MDCK细胞中,并加TPCK胰酶辅助HA裂解,感染后24 h观察到有明显细胞病变时用4%的多聚甲醛固定,4℃保存备用。
1.9 间接免疫荧光检测(indirect immunoflurescent assay,IFA) 用PBST洗板3次后,加入含0.5%Triton-X-100的PBS(300 μL/孔),室温透化10 min。清洗3~5次,加入新鲜配制5%的BSA(牛血清白蛋白)封闭液于37℃恒温封闭0.5 h。清洗3~5次,均按照1∶500(封闭液稀释)分别加M1多抗、M1单抗(3G8和5F2)、M2多抗、M2单抗37℃温育1 h。清洗3~5次,将带荧光标记的羊抗鼠IgG(1∶1000)、羊抗兔IgG(1∶500)作为二抗,室温避光作用45 min,用PBST清洗5次后于倒置荧光显微镜中观察结果。
2 结果
2.1 M1、M2氨基酸进化树 目前NCBI中蝙蝠流感病毒基因组序列共计有5株(3株H17N10、2株H18N11),与其他各种亚型的A型流感病毒代表株进行M1和M2氨基酸序列的比对后发现,蝙蝠流感病毒的M1和M2氨基酸与其他A型流感病毒相比,处于完全不同的进化分支(图1),其相关生物学功能的改变可能尚未被人们了解,有待进一步地研究。
2.2 M1、M2重组质粒的构建与鉴定 按照1.4的方法获得阳性质粒,用M1的引物PCR扩增得到的特异性目的条带为759 bp左右,命名为pET-Bat-M1和pET-A2093-M1(图2A)。用1.4中的融合PCR技术先获得了前后分别为69 bp和171 bp左右的条带(图2B),将两个片段融合在一起成功得到1条240 bp去除跨膜区(69~127 bp)的条带(图2C),命名为pGEX-Bat-M2和pGEX-A2093-M2。用M1、M2的引物扩增获得全长为759 bp和297 bp的条带,并命名为pCAGGS-Bat-M1、pCAGGS-A2093-M1(图2A),pCAGGS- Bat-M2、pCAGGS-A2093-M2(图2D)。上述所有重组质粒经转化挑菌测序,测序结果均与预期序列一致。
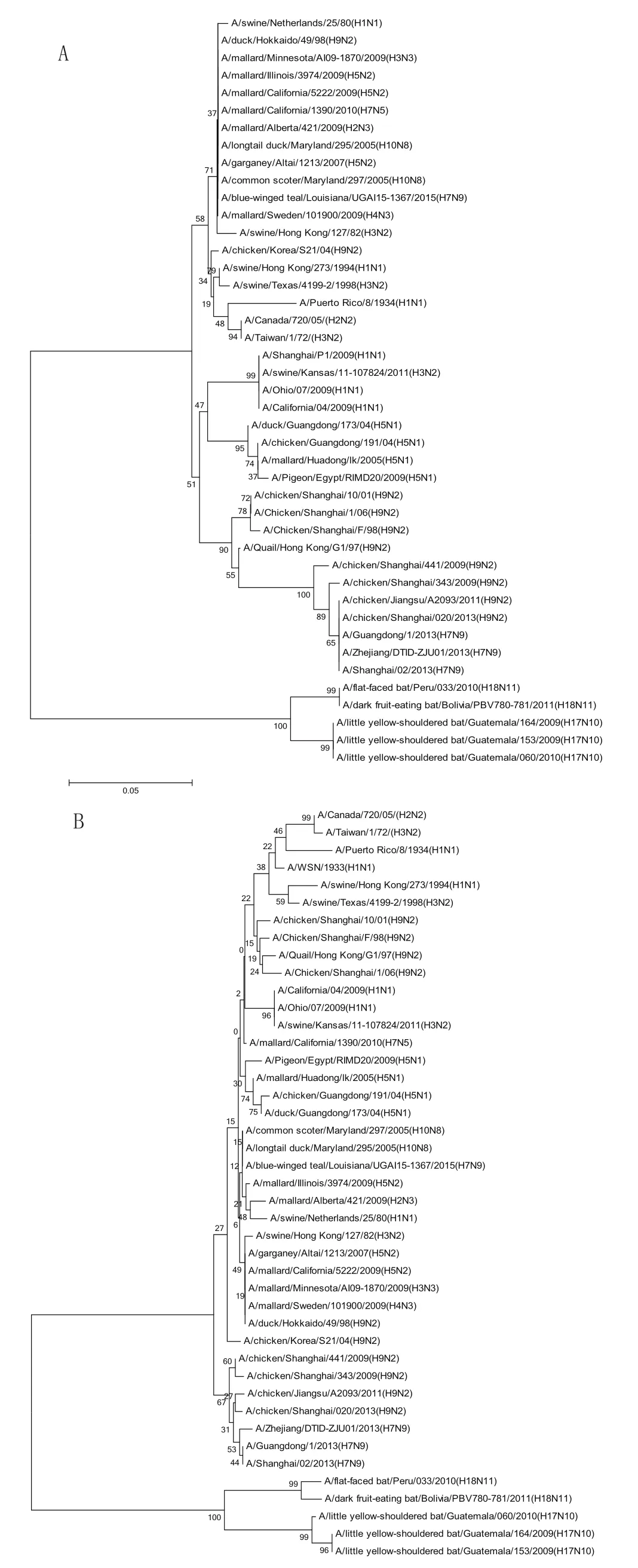
图1 M1、M2氨基酸进化树Fig.1 Phylogenetic trees of M1, M2 amino acidA: M1氨基酸进化树; B:M2氨基酸进化树A: Phylogenetic tree of M1; B: Phylogenetic tree of M2
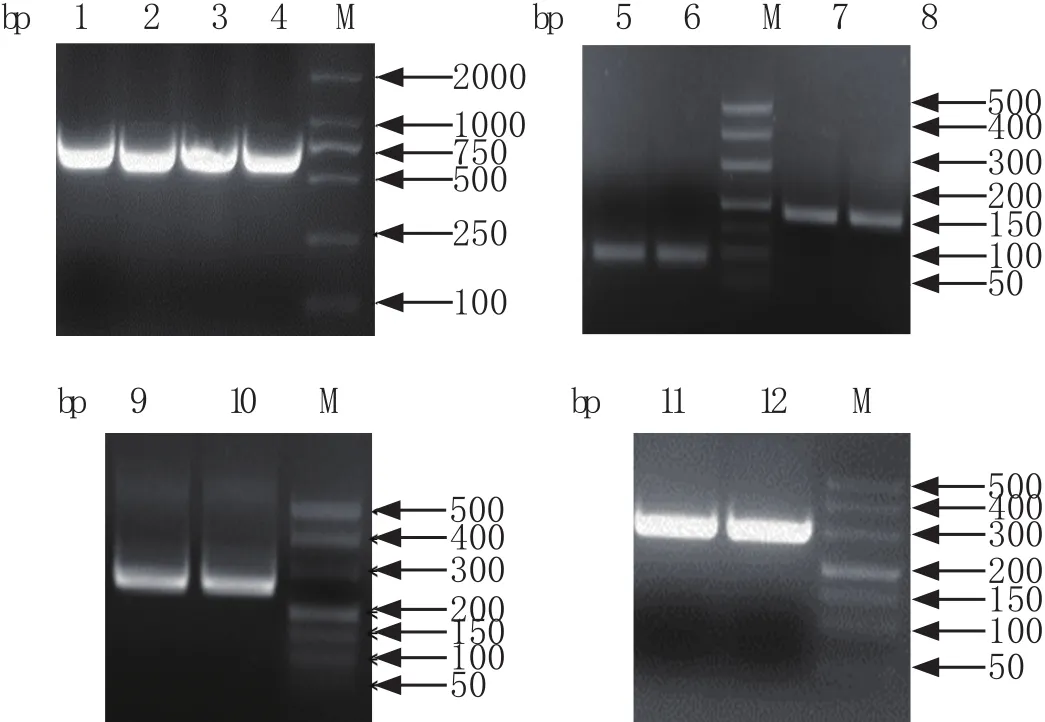
图2 M1、M2基因的PCR扩增鉴定结果Fig.2 PCR amplif i cation for M1,M2 geneM: DNA分子量标准(DL2000、DL500); 1: pET-Bat-M1; 2:pET-A2093-M1; 3: pCAGGS-Bat-M1; 4: pCAGGS-A2093-M1;5: pET-Bat-M2-69; 6: pET-A2093-M2-69; 7: pET-Bat-M2-127;8: pET-A2093-M2-127; 9: pET-Bat-M2; 10: pET-A2093-M2; 11:pCAGGS-Bat-M2; 12: pCAGGS-A2093-M2M: DNA Marker(DL2000, DL500); 1: pET-Bat-M1; 2: pETA2093-M1; 3: pCAGGS-Bat-M1; 4: pCAGGS-A2093-M1; 5:pET-Bat-M2-69; 6: pET-A2093-M2-69; 7: pET-Bat-M2-127; 8:pET-A2093-M2-127; 9: pET-Bat-M2; 10: pET-A2093-M2; 11:pCAGGS-Bat-M2; 12: pCAGGS-A2093-M2
2.3 原核表达质粒的蛋白表达 将重组质粒转化到诱导表达菌BL21(DE3)中,经诱导、超声处理后,全菌分为上清和沉淀,分别经10%的SDS-PAGE分离,考马斯亮蓝染色处理。结果显示,pETBat-M1和pET-A2093-M1在沉淀中可明显观察到28 kDa的目的条带(图3),pGEX-Bat-M2、pGEX-A2093-M2在沉淀中均可观察到35 kDa左右带GST标签的目的条带(图3),而上述蛋白在上清中均不表达。
2.4 M1、M2原核表达蛋白的免疫印迹鉴定 将原核表达产物的沉淀经SDS-PAGE分离,按照1.7的方法加入一抗和二抗。结果显示,pET-Bat-M1和pETA2093-M1原核表达产物均能够与购买的M1多抗发生反应,出现28 kDa的特异性条带(图4A),与M1的单抗,即3G8和5F2都不反应(图4B、4C),说明H17N10和H9N2的M1原核表达蛋白免疫原性一致,没有显示出差异。
pGEX-Bat-M2与商品化的M2单抗(14C2)反应,却与M2的多抗不反应,然而pGEX-A2093-M2的反应结果与之相反(图5)。结果证实了我们之前假设,蝙蝠流感病毒和H9N2禽流感病毒的M2蛋白存在免疫原性的差异。

图3 M1、M2原核表达结果Fig.3 Prokaryotic expression for M1,M2 proteinM: 预染小分子质量蛋白标准; 1:pET-30a空载; 2: pETA2093-M1; 3: pET-Bat-M1; 7、11: pGEX-4T-1空载; 8: pGEXA2093-M2; 12: pGEX-Bat-M2 (以上均为沉淀) 4: pET-30a空载; 5: pET-A2093-M1; 6: pET-Bat-M1; 9、13: pGEX-4T-1空载;10: pGEX-A2093-M2; 14: pGEX-Bat-M2 (以上均为上清)M: Pre-stained low molecular weight protein marker; 1: pET-30a;2: pET-A2093-M1; 3: pET-Bat-M1; 7,11: pGEX-4T-1; 8: pGEXA2093-M2; 12: pGEX-Bat-M2 (Above were precipitate) 4: pET-30a; 5: pET-A2093-M1; 6: pET-Bat-M1; 9,13: pGEX-4T-1; 10:pGEX-A2093-M2; 14: pGEX-Bat-M2 (Above were supernatant)
2.5 IFA鉴定 将真核表达质粒转染到293T细胞中,28 h后固定细胞;用病毒感染MDCK细胞,24 h后固定细胞。再按照1.9的方法,孵育相应的一抗、二抗,倒置荧光显微镜观察并拍照。结果显示,转染H9和蝙蝠流感病毒M1的真核表达质粒以及A2093/H9N2和Bat09∶mH9mN2病毒感染细胞后都与M1单抗5F2反应,而与M1单抗3G8和M1多抗不反应(图6)。转染H9流感病毒M2的真核表达质粒以及A2093/H9N2病毒感染细胞后均与M2单抗(14C2)以及M2多抗反应,转染的蝙蝠流感病毒M2的真核表达质粒以及Bat09∶mH9mN2病毒感染细胞后均与M2单抗(14C2)反应,但与M2多抗却不反应(图7)。结果再次证实我们的假设,蝙蝠流感病毒和H9N2禽流感病毒M2蛋白之间存在免疫原性的差异,在体外真核表达和病毒感染水平都显示出差异。

图4 M1 原核表达产物的Western blot 鉴定Fig.4 Western blot for prokaryotic expression products of M1 proteinM: 预染小分子质量蛋白标准; 1:pET-30a空载;2: pETA2093-M1; 3: pET-Bat-M1 (以上均为M1多抗); 4: pET-30a空载; 5: pET-A2093-M1; 6: pET-Bat-M1 (以上均为M1的单抗3G8); 7:pET-30a空载; 8: pET-A2093-M1; 9: pET-Bat-M1 (以上均为M1的单抗5F2)M: Pre-stained low molecular weight protein marker; 1:pET-30a; 2: pET-A2093-M1; 3: pET-Bat-M1 (Above were identified with M1 polyclonal antibody); 4: pET-30a;5: pET-A2093-M1;6: pET-Bat-M1 (Above were identified with 3G8 monoclonal antibody); 7: pET-30a; 8: pET-A2093-M1; 9: pET-Bat-M1 (Above were identified with 5F2 monoclonal antibody)

图5 M2 原核表达产物的Western blot 鉴定Fig.5 Western blot for prokaryotic expression products of M2 proteinM: 预染小分子质量蛋白标准; 1: pGEX-4T-1空载; 2:pGEXA2093-M2; 3: pGEX-Bat-M2 (以上均为M2多抗); 4: pGEX-4T-1空载; 5: pGEX-Bat-M2; 6: pGEX-A2093-M2 (以上均为M2单抗14C2)M: Pre-stained low molecular weight protein marker; 1: pGEX-4T-1; 2:pGEX-A2093-M2; 3: pGEX-Bat-M2 (Above were identified with M2 polyclonal antbody); 4: pGEX-4T-1; 5: pGEXBat-M2; 6: pGEX-A2093-M2 (Above were identified with M2 monoclonal antibody 14C2)
3 讨论
流感病毒作为一种既能感染动物又能传染给人的病原体,引起了人类的高度关注。2009~2010年首次从两种蝙蝠(little yellow-shouldered bat,flatfaced bat)中发现了两种新的亚型流感病毒的全基因组序列。与其他流行毒株不同的是,这两种病毒株的HA不能与唾液酸受体结合,NA缺乏神经氨酸酶活性[16,17],说明其可能存在其他特别的入侵和释放机制,因此有学者建议将新发现这两种蝙蝠流感病毒分别命名为HL17NL10和HL18NL11[18]。蝙蝠是否是流感病毒除了水禽之外的新的储存宿主,蝙蝠流感病毒与其他亚型流感病毒的重组和致病能力,以及对人类和动物的健康威胁,也都成为了最新的研究热点。
M蛋白可翻译编码M1和M2蛋白,作为流感病毒的基质蛋白(M1)和离子通道蛋白(M2),在病毒感染的各个生命周期中发挥着不可或缺的重要功能。本研究最初从序列比对分析发现蝙蝠流感病毒的M1和M2氨基酸与其他IAVs具有较大差异。蝙蝠流感病毒的M1与其他亚型的同源性为78%左右,而其他亚型之间的M1氨基酸序列同源性高达92%左右。蝙蝠流感病毒的M2与其他亚型的同源性只有42%左右,而其他亚型之间的M2氨基酸序列同源性高达84%左右。M蛋白通常是流感病毒研究鉴定时通用的抗体靶标之一,蝙蝠流感病毒与其他亚型流感病毒的M蛋白氨基酸序列差异如此之大,尤其是M2蛋白,很可能已经不能作为通用抗体的靶标。

图6 M1间接免疫荧光鉴定结果Fig.6 Indirect immune fl uorescence assay for M1 proteinA~F均为M1真核质粒在293T细胞上的表达. A: pCAGGS-A2093-M1(3G8); B: pCAGGS-A2093-M1(5F2); C: pCAGGS-A2093-M1(M1多抗); D: pCAGGS-Bat-M1(3G8); E: pCAGGS-Bat-M1(5F2); F: pCAGGS-Bat-M1(M1多抗)G~L均为病毒感染MDCK细胞上的表达.G: A2093-M1(3G8); H: A2093-M1(5F2); I: A2093-M1(M1多抗); J: Bat-M1(3G8); K: Bat-M1(5F2); L: Bat-M1(M1多抗)A-F were the 293T cells transfected with eukaryotic plasmids of M1.A: pCAGGS-A2093-M1(3G8); B: pCAGGS-A2093-M1(5F2); C:pCAGGS-A2093-M1(M1 multi-resistance); D: pCAGGS-Bat-M1(3G8); E: pCAGGS-Bat-M1(5F2); F: pCAGGS-Bat-M1(M1 polyclonal antibody)G-L were MDCK cells infected with Infuenza viruses. G: A2093-M1(3G8); H: A2093-M1(5F2); I: A2093-M1(M1 polyclonal antibody); J:Bat-M1(3G8); K: Bat-M1(5F2); L: Bat-M1(M1 polyclonal antibody)
图7 M2 间接免疫荧光鉴定结果Fig.7 Indirect immune fl uorescence assay for M2 proteinA~D均为M2真核质粒在293T细胞上的表达. A: pCAGGS-A2093-M2(M2单抗14C2); B: pCAGGS-A2093-M2(M2多抗); C: pCAGGSBat-M2(M2单抗14C2); D: pCAGGS-Bat-M2(M2多抗)E~H均为病毒感染MDCK细胞上的表达.E: A2093-M2(M2单抗); F: A2093-M2(M2多抗); G: Bat-M2(M2单抗); H: Bat-M2(M2多抗)A-D were the 293T cells transfected with eukaryotic plasmids of M2. A: pCAGGS-A2093-M2(M2 monoclonal antibody 14C2); B:pCAGGS-A2093-M2(M2 multi-resistance); C: pCAGGS-Bat-M2(M2 monoclonal antibody 14C2); D: pCAGGS-Bat-M2(M2 polyclonal antibody)E-H were MDCK cells infected with Infuenza viruses. E: A2093-M2(M2 monoclonal antibody 14C2); F: A2093-M2(M2 polyclonal antibody); G: Bat-M2(M2 monoclonal antibody 14C2); H: Bat-M2(M2 polyclonal antibody)
通过构建蝙蝠流感病毒(H17N10)与H9N2禽流感病毒(A2093/H9N2)M1、M2蛋白的原核表达载体、真核表达载体以及用相应病毒感染细胞,并通过不同的抗体进行免疫印迹和免疫荧光鉴定。结果发现,两种亚型的M1蛋白的免疫原性完全一致,但M2蛋白的免疫原性却出现了差异。M2的多抗不能识别蝙蝠流感病毒的M2原核、真核表达产物以及病毒感染,却能够识别A2093/H9N2病毒M2的原核、真核表达产物和病毒感染。由于该M2多抗的制备病毒是PR8/H1N1株,根据图1B的M2遗传进化关系显示,其与H9N2禽流感病毒属于同一大分支,而与蝙蝠流感病毒分属不同的分支,使用的M2多抗可能不具有识别蝙蝠流感病毒的抗原表位,因此可以用于区分蝙蝠流感病毒和H9流感病毒的感染。而M2的单抗能识别蝙蝠流感病毒的M2原核、真核表达产物以及蝙蝠流感病毒感染,也能够识别A2093/H9N2病毒M2的真核表达产物以及A2093/H9N2病毒感染,却不识别A2093/H9N2病毒M2的原核表达产物。说明M2单抗可能针对的是构象表位,可能识别的是蝙蝠流感病毒与H9流感病毒保守的M2的一个抗原表位,因此不能够将这两者区分。通过一系列的免疫原性比较研究,揭示了蝙蝠流感病毒(H17N10)M蛋白确实与H9N2禽流感病毒的M蛋白存在差异,同时暗示着蝙蝠流感病毒M蛋白可能与其他亚型流感病毒M蛋白也存在差异。研究结果进一步提示我们,蝙蝠流感病毒除了HA、NA与普通的A型流感病毒不同之外,M作为流感病毒的保守基因之一,也存在着较大的差异,值得引起我们的关注。虽然至今仍没有在蝙蝠以外的哺乳动物或是易感家禽中发现蝙蝠流感病毒,但已有报道显示通过体外少数的犬源细胞(MDCKII,RIE 1495)培养,可以获得野生蝙蝠流感病毒的拯救[6],且证实嵌合蝙蝠流感病毒能与其他亚型流感病毒的基因兼容,产生重组病毒[5,9],而蝙蝠流感病毒各个基因片段的功能特殊性还有待于进一步的研究。本研究通过免疫原性的比较,更直观地显示蝙蝠流感病毒M蛋白的不同,同时筛选到了可以区分蝙蝠流感病毒的抗体,为今后更全面地认识蝙蝠流感病毒与其他流感病毒的差异提供新思路,也为流感病毒M蛋白的生物学功能研究奠定基础。
