刺参2 种天冬氨酸蛋白酶的酶学性质及其对自溶的影响
2018-07-24年益莹季晓彤崔钰婷张公亮侯红漫孙黎明
王 玲,年益莹,薛 鹏,季晓彤,崔钰婷,张公亮,侯红漫,孙黎明,*
(1.大连工业大学食品学院,辽宁 大连 116034;2.国家海洋食品工程技术研究中心,辽宁 大连 116034)
海参(Stichopus japonicus)是我国经济价值较高的海珍品之一,富含多糖、胶原蛋白、糖脂等功能活性因子,近年来产量逐年递增。但是,海参自溶能力很强,在捕捞、运输、贮藏以及加工过程中均可发生自溶,导致海参原料品质下降。前期研究表明,海参体壁和肠道中的一系列内源性蛋白酶是海参自溶的主导因素,其中组织蛋白酶(cathespin,Cat)对海参自溶起重要作用[1-2]。
在所有Cat中,只有Cat D和Cat E属于天冬氨酸蛋白酶(EC3.4.23)[3]。Cat D的分布非常广泛,几乎在所有组织中都有分布[4];而Cat E分布则相对局限,只存在于部分组织细胞中[5]。它们虽然是天冬氨酸蛋白酶家族中2 种性质非常相似的蛋白酶,但Cat D分布于溶酶体中,在高等动物的胃部和在其他组织器官都有分布[6-8]。而Cat E并不是溶酶体蛋白酶,而是一种非分泌性的细胞内蛋白酶。同一物种的Cat D和Cat E在理化特性、分子质量、存在形式[9-10]及抗原性[7,11]等方面均有一定差异。
Simon等[12]发现Cat D具有较强的纤维蛋白及纤维蛋白原溶解活性。Helseth等[13]发现Cat D参与原胶原纤维的降解,能够将原胶原的羧基端前肽水解掉,当pH值为6时,断裂位点从羧基端端肽移至羧基端端肽/前肽结合处。胶原蛋白是海参的主要结构蛋白,因此,海参内源性Cat D及Cat E很有可能参与海参自溶。
海参Cat D和Cat E相关信息鲜见报道。本实验以辽宁特产刺参体壁中的Cat D和Cat E为研究对象,对其部分酶学性质进行研究,包括最适pH值、最适温度和热稳定性,以及金属离子、蛋白酶抑制剂和激活剂对Cat D和Cat E活力的影响。进一步利用特异性抑制剂Pepstatin A,考察天冬氨酸蛋白酶对海参自溶过程中蛋白质降解的影响,为进一步阐明Cat D和Cat E在海参自溶中的作用机制及其控制奠定基础。
1 材料与方法
1.1 材料与试剂
鲜活刺参购于大连长兴市场,30 min内于冰盒中运回实验室。
MOCAc-Gly-Lys-Pro-Ile-Leu-Phe-Phe-Arg-Leu-Lys(Dnp)-D-Arg-NH2(Cat D底物)、MOCAc-Gly-Ser-Pro-Ala-Phe-Leu-Ala-Lys(Dnp)-D-Arg-NH2(Cat E底物)、Z-Leu-Leu-Leu-H(Z-LLL)CA-074 日本Peptide Institute公司;E-64、抗痛素、苯甲基磺酸氟(phenylmethylsulfonyl fluoride,PMSF)、1,10-菲啰啉、胃蛋白酶抑制剂(pepstatin A,Pep A) 美国Sigma公司;L-半胱氨酸(L-Cys)、碘乙酸、二硫苏糖醇(dithiothreitol,DTT)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、三羟甲基氨基甲烷(trismethyl aminomethane,Tris) 生工生物工程(上海)有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
荧光光谱仪 美国PE公司;PHS-3C型pH计 上海精密科学仪器有限公司;Z-323K型大容量冷冻离心机德国Hermle公司。
1.3 方法
1.3.1 粗酶液的制备
新鲜刺参剖腹去肠,体壁用去离子水洗净、切碎,按料液比1∶1(g/mL)加入Tris-HCl缓冲溶液(50 mmol/L,pH 7.0),匀浆,上述过程中均在冰浴下进行,4 ℃浸提1 h,离心(12 000 r/min,20 min),取上清液即为粗酶液,-80 ℃贮藏备用。1.3.2 酶学性质的测定
1.3.2.1 特异性荧光底物法测定酶活力
取150 μL粗酶液,加入75 μL Tris-HCl反应缓冲溶液(50 mmol/L,pH 7.0),再加入75 μL(10 μmol/L)特异性底物,混匀后于37 ℃水浴30 min,立即加入300 μL终止液甲醇-异丙醇-水(35∶30∶35,V/V)终止反应,混匀后在各自激发波长和发射波长条件下(Cat D激发波长320 nm,发射波长400 nm;Cat E激发波长328 nm,发射波长393 nm)测定荧光强度,每组实验均做3 次平行。
以荧光产物7-氨基-4-甲基香豆素(7-amino-4-methylcoumarin,MCA)物质的量(μmol)为横坐标,在其激发波长346 nm和检测波长439 nm条件下测得的荧光强度为纵坐标,绘制标准曲线,得到标准曲线方程为Y=10.06X-0.199 3(R2=0.999 9)。将酶活力定义为:在1 min内水解底物并释放1×10-3μmol的MCA产物的量为1 个酶活力单位(1 U)。相对酶活力定义为:各种条件下测得的酶活力相对最高酶活力(或对照组酶活力)的百分比。
1.3.2.2 最适pH值的测定
配制pH值分别为2~11的缓冲液作为反应缓冲液,按照1.3.2.1节中的方法测定不同pH值条件下Cat D和Cat E的活性。各反应缓冲液分别为:0.2 mol/L Gly-HCl 缓冲液(pH 2~3),0.2 mol/L HAc-NaAc缓冲液(pH 4~5),0.2 mol/L Na2HPO4-NaH2PO4缓冲液(pH 6~8),0.2 mol/L Gly-NaOH 缓冲液(pH 9~10),0.2 mol/L的Na2CO3-NaHCO3缓冲液(pH 11)。
1.3.2.3 最适温度的测定
取150 μL粗酶液,加入75 μL最适pH值反应缓冲溶液,再加入75 μL底物,混合均匀,分别于10~80 ℃反应30 min后立即加入300 μL终止液,混匀后测定荧光强度。
1.3.2.4 热稳定性的测定
取150 μL粗酶液分别于20~80 ℃水浴30 min后,加入75 μL最适反应缓冲溶液,再加入75 μL底物,混合均匀。分别于最适温度下反应30 min后立即加入300 μL终止液,混匀后测定荧光强度。
1.3.2.5 金属离子对酶活力的影响
取75 μL粗酶液,加入150 μL含有10 mmol/L金属离子Mn2+、Zn2+、Cu2+、Ca2+、Mg2+、Fe2+、Fe3+的最适缓冲溶液,常温孵育30 min,加入75 μL底物,混合均匀。分别于最适温度下反应30 min后加入300 μL终止液,混匀后测定荧光强度。对照组用最适pH值缓冲液代替金属盐溶液,其余操作不变。
1.3.2.6 抑制剂与激活剂对酶活力的影响
取75 μL粗酶液分别与含有20 μmol/L CA-074、2 mmol/L Z-LLL、2 mmol/L碘乙酸、20 μmol/L E-64、0.5 mmol/L抗痛素、2 mmol/L PMSF、2 mmol/L 1,10-菲啰啉、2 mmol/L DTT、2 mmol/L L-Cys、2 mmol/L EDTA的缓冲液等体积混合,室温孵育30 min,加入75 μL最适pH值缓冲液和75 μL底物,分别于最适温度下反应30 min,加入300 μL终止液,混匀后测定荧光强度。对照组用最适pH值缓冲液代替抑制剂,其余操作不变。
1.3.2.7 Pep A对刺参自溶的影响
将新鲜刺参切碎,匀浆,取2 g匀浆物加入试管中,再加入2 mL Tris-HCl缓冲液(50 mmol/L,pH 7.0),分为4 组,每组3 管。第1组:立即加入2 mL蛋白提取缓冲液(2%十二烷基硫酸钠,8 mol/L尿素,5% DTT,20 mmol/L Tris-HCl,pH 7.5),振荡12 h,沸水浴5 min,离心(4 000 r/min,15 min),取上清液备用。第2组:于25 ℃孵育(自溶)6 h,然后加入2 mL蛋白提取缓冲液,后续步骤同第1组。第3、4组:添加终浓度分别为0.2、0.4 mmol/L的Pep A,于25 ℃孵育6 h,然后立即加入2 mL蛋白提取缓冲液,后续步骤同第1组。采用5%浓缩胶,8%分离胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)。电泳后,胶块用清水洗涤后,于0.125%考马斯亮蓝R-250中染色3 h后,用甲醇-醋酸-水溶液脱色后进行凝胶成像。
2 结果与分析
2.1 Cat D和Cat E的最适pH值
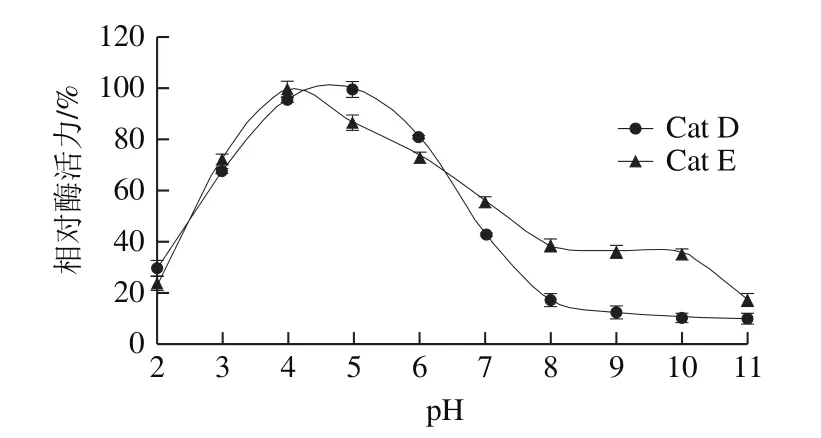
图1 Cat D和Cat E的最适pH值Fig.1 Optimum pH values for Cat D and Cat E
如图1所示,随着pH值的增大,Cat D和Cat E的酶活力分别在pH 5和pH 4时达到酶活力高峰;在随后的酶活力下降过程中,两者呈现一定差异,Cat E酶活性下降较为缓慢,而Cat D酶活性则快速下降。在pH 8~10范围内,Cat E的相对酶活力保持在40%左右,而Cat D的相对酶活力则仅为10%~17%。
关于Cat D的最适pH值研究报道较多。在水产动物方面,Venugopa等[14]发现贻贝Cat D的最适pH值为3.5。Goldman-Levkovitz等[15]测得鲤鱼Cat D在pH 3.0呈现酶活力峰值,之后随着pH值升高,活性直线下降,至pH 5.0时酶活性降为最大酶活力的40%以下。Wang等[16]测得大西洋鳕鱼(Clupea harengus)肌肉中Cat D的最适pH值也为3.0,当pH值升至4.5和5.2时活性仅为最大酶活力的50%和20%。Balti等[17]研究了鱿鱼肝胰腺Cat D的理化特性,其最适pH值也为3.0。Liu Zhongyi等[18]报道草鱼肠道Cat D的最适pH值为2.5。Nielsen等[19]测得大西洋鲱鱼的最适pH值为2.5,当pH值升到4时,活性降低50%;当pH值为6时,酶活性几乎为零。
在陆生动物方面,Krause等[20]报道了鸵鸟Cat D的最适pH值为4。Simon等[12]发现人Cat D最适pH值在3.5,在pH值为5时,酶活力则降为最大酶活力的50%。Yasuda等[21]测得大鼠胃和脾Cat D的最适pH值为4,当pH值升到6.5时,酶活力降为最大酶活力的10%以下。
上述结果表明,不同物种Cat D最适pH值均在2.5~4范围内,且对pH值的敏感性较强,一般在pH 5时活性就显著降低;不同物种Cat D间最适pH值差异较大的原因可能有如下两点:1)不同物种以及同一物种不同组织细胞来源Cat D的结构功能不同,其最适pH值存在差异。2)不同研究者用的底物不同,很可能是另一个主要原因[22-23]。Komai等[24]分别用酸变性血红蛋白、酸变性酪蛋白和特异性荧光底物,测得太平洋褶鱿鱼Cat D的最适pH值分别为3.5、2.2和3.0,可见底物种类对判定最适pH值有较大影响。
关于Cat E的研究报道较少,Inokuchi等[10]发现牛蛙Cat E在pH 2.5显示最大酶活力,而当pH值升至4时,酶活力降为35%,pH值升至5时,酶活性几乎全部消失。Yasuda等[21]测得大鼠胃和人红细胞Cat E的最适pH值为4,当pH值升到6时,酶活力降为最大酶活力的20%以下。
Cappiello等[25]发现重组pro-Cat E的最大反应速率在pH 4.0时,随着pH值上升,反应速率下降,pH值升至5.0时,反应速率降为0;而活化形式的Cat E则在pH 3.5~4.5范围内反应速率均稳定在最高水平,但pH值升至4.8时,反应速率降为最大反应速率的40%下,当pH值升至5.25时,反应速率降为零。同样,Zaidi等[26]测得重组人Cat E在中性pH值时几乎没有活性。Zeleznik等[27]研究了重组人类Cat E的最适pH值也为4.0,当pH值高于4.0时,活性迅速下降,pH 6.0时残余酶活力为50%,但在pH 6.0~8.0,酶活力则抑制维持在50%左右,pH 8.5时彻底失活。Yasuda等[21]关于人红细胞Cat E的报道,也有相似的结果。Lapresle等[28]发现兔脾脏Cat E在pH 2.5呈现峰值,但当pH值升至5时,酶活性则降至峰值的5%左右。
大多数报道均显示Cat D和Cat E的最适pH值在酸性范围。Athauda等[29]发现Cat E的最适pH值虽然在酸性范围,但其在中性pH值时仍可以保持一定活性,而且显示出不同的酶解切割特异性。在pH 5.5及pH 3.0时,Cat E倾向于水解Phe-X、Tyr-T、Leu-X等肽键,而当pH值为中性时Cat E则选择性地水解Glu13-Ala14肽键。当pH值为7.4时,Cat E则选择性地水解Arg-X和Glu-X肽键,尤其对Arg-Arg键则更为优先水解[30-31]。同样,Cat D也有相似现象。
上述研究表明,Cat D和Cat E的酶活力对环境pH值很敏感,其酶活力在较为狭窄酸性pH值范围内才能发挥作用。由图1可知,在中性及碱性范围内,Cat E酶活力具有一定的稳定性。刺参受外界环境刺激发生自溶后,会相继发生细胞及溶酶体破裂,释放的Cat E和Cat D会在短时间内水解刺参结构蛋白。但是,刺参体液pH值为中性偏碱性,两者的pH值稳定性差异表明,Cat E在中性及碱性环境下依然具有酶活力。因此,相对Cat D而言,Cat E对刺参自溶的贡献可能更大。
2.2 Cat D和Cat E的最适温度
由图2可知,在温度为40 ℃时,Cat E达到酶活力高峰,而Cat D在60 ℃左右酶活力达到峰值。当温度升至70 ℃,Cat D的相对酶活力维持在65%左右,而Cat E的相对酶活力则降低至不到10%,表明Cat D具有较强的热稳定性,而Cat E对环境温度的敏感性较高。
同样,贻贝Cat D最适温度也为60 ℃,温度升至80 ℃时活性降至最大活性的60%左右[13]。鲤鱼Cat D在43~55 ℃范围内活性可一直维持在峰值水平[14]。欧洲横纹乌贼肝胰腺Cat D最适温度为50 ℃,但酶活性随着温度高于50 ℃而迅速降低,在60 ℃和65 ℃时,活性分别为最大活性的55.1%和32%[17]。草鱼肠道Cat D的最适温度为37 ℃,在50 ℃孵育30 min后,活性降至最大活性的20%[15];大西洋鲱鱼Cat D的最适温度也为37 ℃[20]。鸵鸟Cat D在45 ℃显示出最大酶活力,但在70 ℃时,酶活力分别降至52%和36%[17]。莫桑比克罗非鱼Cat D最适温度为50 ℃,在此温度下孵育10、60 min,活性损失20%、35%;但在60 ℃孵育10、60 min后,活性分别降低60%、90%[18]。大西洋鲑鱼肌肉Cat D最适温度也为50 ℃[19]。Yasuda等[22]发现人红细胞Cat D和鼠胃Cat E均在45 ℃呈现最大酶活性。
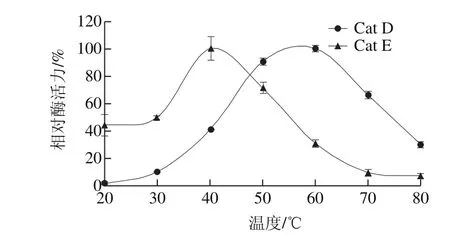
图2 Cat D和Cat E的最适温度Fig.2 Optimum temperatures for Cat D and Cat E
2.3 Cat D和Cat E的热稳定性
温度对Cat D和Cat E酶活力的影响如图3所示。刺参体壁的Cat D和Cat E在温度20~40 ℃时,酶活力较为稳定,温度超过50 ℃酶活力急剧下降,但Cat D下降的速度较Cat E略缓慢,证明了Cat D较Cat E具有较强的热稳定性。
与陆生动物比较,海洋动物体内蛋白酶的热敏性更高,更易失活。大西洋鳕鱼Cat D的热稳定性很低,在40 ℃孵育15 min后,活性就全部消失,而牛Cat D在45 ℃酶活很稳定,在60 ℃孵育15 min后,酶活力才明显下降[16]。尽管欧洲横纹乌贼肝胰腺Cat D在50 ℃呈现最大酶活力,但在50、55 ℃和60 ℃孵育30 min后,活性降至最大活性的75.2%、49%和20.5%,在65 ℃孵育30 min后活性已经丧失[17]。马鲛鱼Cat D在50 ℃孵育20 min后活性降至初始值50%以下[32]。
大西洋鲱鱼与牛Cat D在较高温度具有相似的热稳定性,65 ℃孵育1 h后的活性几乎没有下降;而鲑鱼Cat D在50 ℃孵育3 min后,活性几乎全部丧失[20]。南极冰鱼Cat D具有较强的热稳定性,在50 ℃孵育55 min后,其Cat D活性还能够保持最大活性的50%,而人类Cat D在50 ℃半衰期只有3 min,虹鳟鱼肝脏Cat D在50 ℃孵育不到2 min,酶活性就全部丧失[33]。
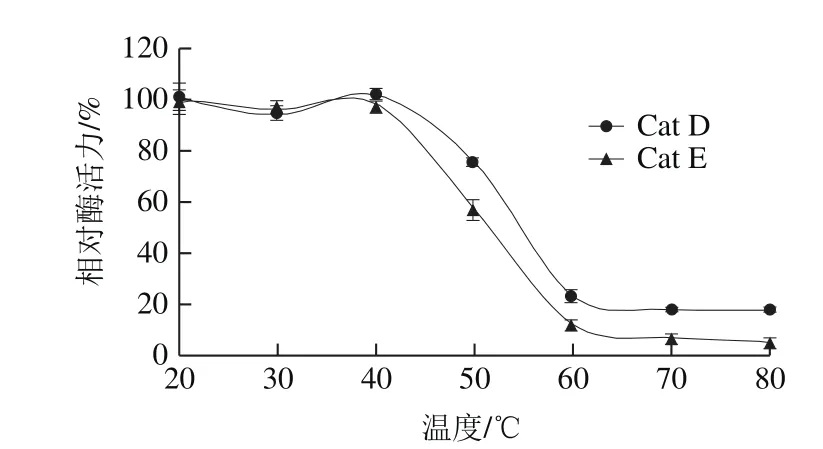
图3 Cat D和Cat E的热稳定性Fig.3 Thermal stabilities of Cat D and Cat E
2.4 金属离子对Cat D和Cat E的影响

图4 金属离子对Cat D和Cat E活力的影响Fig.4 Effects of metal ions on activities of Cat D and Cat E
金属离子对Cat D和Cat E酶活力的影响如图4所示,Ca2+、Mg2+对Cat D、Cat E活性的影响不大。Zn2+对Cat D的抑制作用较强,但不会抑制Cat E的活性。Fe2+能够抑制Cat D和Cat E的活性,抑制率分别为29.2%和82.2%;Fe3+对Cat D和Cat E的抑制作用更强,抑制率分别为56.5%和99.1%,能够完全抑制Cat E的活性。Cu2+、Mn2+均对Cat D有较强的抑制作用,对Cat E的抑制作用相对较弱。
金属离子是影响蛋白酶活性的一个重要因素。一方面,金属离子可能抑制蛋白酶的活力,其机制可能是:1)与蛋白酶活中心氨基酸上的基团(例如半胱氨酸的巯基)结合,从而抑制酶的活性;2)与蛋白酶非活性中心的氨基酸结合,影响蛋白酶空间构象,从而降低酶活力。相反,金属离子还可能作为激活剂提高蛋白酶的活力,尤其是活性中心依赖金属离子的金属蛋白酶,金属离子作为金属蛋白酶的辅基,与氨基酸结合形成稳定常数较高的配合物,从而提高蛋白酶的活力。
由图4可知,Zn2+、Fe2+、Fe3+、Cu2+和Mn2+分别对刺参Cat D或Cat E均有一定抑制作用,但抑制作用有明显差异,提示这2 种天冬氨酸蛋白酶与上述离子的相互作用存在较大不同。
2.5 抑制剂和激活剂对Cat D和Cat E的影响
由图5可知,所用的几种蛋白酶抑制剂和激活剂对Cat D和Cat E的作用几乎是一致的。Pep A、Z-LLL、PMSF、1,10-菲啰啉能够抑制两者活性,抑制率分别约为98%~99%、65%~78%、30%~35%、19%~23%。Pep A几乎可完全抑制两者的酶活力,证明两者均为天冬氨酸蛋白酶。兼具丝氨酸蛋白酶和木瓜蛋白酶抑制作用的PMSF对两者的抑制率为30%~35%,金属离子螯合剂1,10-菲罗啉对两者的抑制率为19%~23%,提示Cat D和Cat E的活性中心附近很可能有丝氨酸参与酶活性的调节,而且两者有一定的金属离子依赖性。同为金属离子螯合剂的EDTA却对两者活性有一定促进作用,可分别将Cat D和Cat E的活力提高6.6%和7.9%。有较多报道显示,EDTA对组织蛋白酶等酸性蛋白酶具有激活作用[34-35]。由此可以推测,EDTA对两者酶活力的提升作用很可能远大于其螯合金属离子而发挥的酶活抑制作用。

图5 蛋白酶抑制剂和激活剂对Cat D和Cat E活性的影响Fig.5 Effects of protease inhibitors and activators on Cat D and Cat E
具有较强还原能力和巯基激活能力的DTT和L-Cys对Cat D和Cat E均有激活作用,其中DTT将两者活性均提高了31%,L-Cys分别将Cat D和Cat E活性提高了9.64%和7.58%。这提示Cat D和Cat E分子结构中带有较多的半胱氨酸,这些半胱氨酸极易形成二硫键,DTT能够打开二硫键,使巯基处于还原状态,L-Cys能够保护游离巯基不形成二硫键,从而对Cat D和Cat E活性起到一定的激活和保护作用。
Z-LLL是半胱氨酸蛋白酶Cat K的特异性抑制剂,对Cat D和Cat E的抑制率分别为78.15%和65.21%,提示Cat D和Cat E与Cat K酶活中心结构有较强的相似性。尽管E-64、抗痛素和碘乙酸均为半胱氨酸蛋白酶抑制剂,但对Cat D和Cat E的作用却不一致,抗痛素对酶活力无明显影响,而碘乙酸则表现出一定的激活效应,Cat D和Cat E的酶活力分别增加至112.52%和110.46%,这进一步提示Cat D和Cat E与其他组织蛋白酶具有较大差异。
上述结果提示Cat D和Cat E为具有一定金属离子依赖性的天冬氨酸蛋白酶,其活性中心周围可能有半胱氨酸和丝氨酸参与酶活力的调节。
2.6 Pep A对刺参自溶的影响
由图6可知,新鲜刺参蛋白提取物中,以分子质量较大的蛋白质为主,分子质量集中在114~200 kDa范围内和44.3 kDa处。刺参自溶6 h后,200 kDa的大分子蛋白质发生降解。加入终浓度分别为0.2、0.4 mmol/L的Pep A后,该大分子蛋白的降解明显受到抑制。
Pep A是天冬氨酸蛋白酶特异性抑制剂,它能够抑制海参自溶过程中大分子蛋白的降解,说明Pep A通过抑制海参内源性天冬氨酸蛋白酶实现自溶抑制作用。由此可以推测,天冬氨酸蛋白酶很有可能参与刺参自溶过程。研究发现,海参内源性半胱氨酸蛋白酶和基质金属蛋白酶均参与海参自溶[1,36],但天冬氨酸蛋白酶是否参与自溶鲜见报道。Eakpetch等[37]在虾肉中加入Pep A,发现南美白对虾的自溶能够明显受到抑制,从而确认天冬氨酸蛋白酶是引起南美白对虾自溶的主要蛋白酶。除了分布于动物胃肠中的胃蛋白酶,生物体细胞内的天冬氨酸蛋白酶主要包括Cat D和Cat E。因此,本实验所考察的刺参体壁天冬氨酸蛋白酶必然以Cat D和Cat E为主,由此可以推测Cat D和Cat E很有可能参与了刺参自溶。
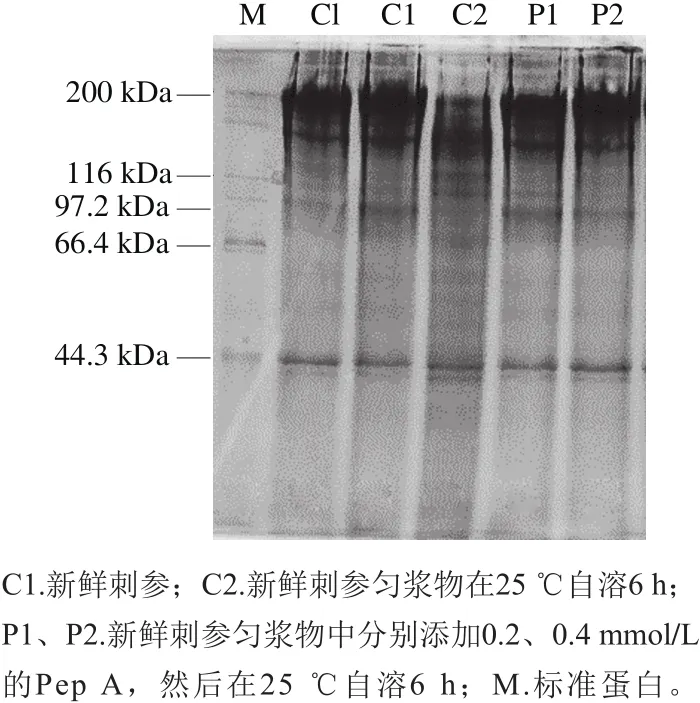
图6 Pep A对刺参自溶自溶过程蛋白降解的影响Fig.6 Effect of Pep A on protein degradation during autolysis of sea cucumber
3 结 论
刺参Cat D最适pH 5.0、最适温度60 ℃,Cat E最适pH 4.0、最适温度40 ℃,两者在20~40 ℃酶活力较为稳定。Zn2+、Cu2+、Fe2+、Fe3+、Mn2+可抑制Cat D的活性。Fe3+、Fe2+、Cu2+可抑制Cat E的活力,但同一金属离子对两者抑制程度不一致;Cat D和Cat E均为具有一定金属离子依赖性的天冬氨酸蛋白酶,其活性中心周围可能有半胱氨酸和丝氨酸参与酶活力的调节。Cat D和Cat E很有可能参与刺参自溶过程中蛋白质的降解。
