内源酶对刺参肠自溶的作用
2018-01-04李傲婷杜椅楠段秀红柴晓倩于翠平吴海涛
李傲婷,杜椅楠,段秀红,柴晓倩,吴 超,唐 越,于翠平,吴海涛*
内源酶对刺参肠自溶的作用
李傲婷,杜椅楠,段秀红,柴晓倩,吴 超,唐 越,于翠平,吴海涛*
(大连工业大学食品学院,国家海洋食品工程技术研究中心,辽宁 大连 116034)
以刺参肠为原料,通过诱导自溶并添加各种酶抑制剂,以三氯乙酸可溶性寡肽和还原糖释放量为指标,并采用聚丙烯酰胺凝胶电泳检测方法,研究内源酶在刺参肠自溶过程中的作用。结果表明,在一定的浓度范围内,胃蛋白酶抑制剂、胰蛋白酶抑制剂、丝氨酸蛋白酶抑制剂、α-淀粉酶抑制剂和β-1,3-葡萄糖苷酶抑制剂对刺参肠的自溶均具有一定的抑制作用,且丝氨酸蛋白酶抑制剂N-甲苯磺酰-L-赖氨酸氯甲基化酮作用较强。说明胃蛋白酶、胰蛋白酶、丝氨酸蛋白酶、α-淀粉酶和β-1,3-葡萄糖苷酶参与刺参肠自溶过程。
刺参;肠;自溶;内源酶;丝氨酸蛋白酶
海参属棘皮动物门海参纲,是一种重要的海洋软体动物[1]。近年来海参养殖业在亚洲国家发展迅速[2]。2015年,我国海参产量达20.50万 t[3],而刺参(Stichopus japonicus)是我国最重要的人工养殖经济品种之一[4]。刺参具有极强的自溶能力,在受到外界物理因素、化学因素和生理因素等刺激后,原本正常的生命活动出现紊乱,会发生吐肠和体壁软化的现象[5]。刺参体内含有丰富的内源酶,主要为体壁和肠中的复杂酶类[6-7]。郑杰等[8]采用环境因子紫外线诱导海参自溶,在考察温度、pH值、NaCl质量浓度和液料比对海参自溶过程中主要化学成分变化影响的基础上,建立了海参自溶的评价指标,即三氯乙酸(trichloroacetic acid,TCA)可溶性寡肽和还原糖释放量。
刺参肠作为刺参加工的副产物,其中含有胃蛋白酶和胰蛋白酶[9]、组织蛋白酶B[10]、高碱性蛋白酶[11]、肽水解酶[12]及β-1,3-葡聚糖酶[13]等多种酶类。这些蛋白酶的存在为利用自溶手段制备生物活性寡肽创造了良好的条件,目前已成功获得具有抗氧化活性的刺参肠自溶寡肽[14-15]。同时,前期研究针对刺参体壁的自溶过程,研究了蛋白酶对其的贡献作用[16]。然而,针对刺参肠自溶过程中,其内源酶对肠蛋白质作用的影响,目前还鲜见报道。
因此,本实验以刺参肠为原料,利用胃蛋白酶抑制剂(Pepstain)、胰蛋白酶抑制剂(soybean trypsin inhibitor,SBTI)、丝氨酸蛋白酶抑制剂及糖苷酶抑制剂,以TCA可溶性寡肽和还原糖释放量为指标,并采用聚丙烯酰胺-凝胶电泳(sodium-dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)检测刺参肠蛋白质的变化情况,明确各种内源酶在刺参肠自溶过程中的作用,为深入开发利用刺参肠提供理论参考依据。
1 材料与方法
1.1 材料、试剂与仪器
刺参肠取自新鲜刺参购于大连长兴市场,取出刺参肠,去除内容物,去离子水清洗后于-80 ℃冷冻。
Pepstain、SBTI、N-甲苯磺酰-L-赖氨酸氯甲基化酮(N-tosyl-L-lysine chloromethyl ketone,TLCK)、N-甲苯磺基-L-苯乙胺酰氯甲基酮(N-tosyl-L-phenylalaninylchloromethyl ketone,TPCK)、N,N,N,N-四甲基乙二胺(N,N,N’,N’-tetramethylethylenediamine,TEMED)、丙烯酰胺、N,N-亚甲基双丙烯酰胺、β-巯基乙醇、考马斯亮蓝R-250、Folin-酚溶液 生工生物工程(上海)有限公司;即用型蛋白分子质量标准(高)、即用型蛋白分子质量标准(低) 宝生物工程(大连)有限公司;α-Amylase 、Nojirimycin 美国Sigma公司;TCA、DNS试剂、甘氨酸 天津市科密欧化学试剂有限公司;其他试剂均为分析纯。
PHS-3精密pH计 上海雷磁仪器厂;AE-6401垂直电泳仪槽 日本ATTO公司;HH-S型水浴锅 巩义市予华仪器有限责任公司;CF16RXII离心机 日本株式会社日立制作所;XW-80A旋涡振荡器 上海精科实业有限公司;Infinite200 NANO酶标定量测定仪 瑞士Tecan公司;UV-5200型紫外-可见分光光度计 上海元析仪器有限公司;TS.B-108往复式脱色摇床 海门市其林贝尔仪器制造有限公司;MF-Chemi BIS 2.0凝胶成像仪以色列DNR成像系统有限公司。
1.2 方法
1.2.1 刺参肠自溶的诱导
根据前期优化的刺参肠自溶最优条件[15],将置于冰上缓化的刺参肠匀浆处理后,经58 μW/cm2紫外线照射30 min,于48 ℃诱导自溶3 h,采用McIIvaine’s(0.2 mol/L)缓冲体系(pH 2.2、4.4或8.0),进行蛋白酶抑制剂对刺参肠自溶中蛋白质降解及TCA可溶性寡肽释放的影响研究,并采用水相体系(自然pH值)研究糖苷酶抑制剂对刺参肠自溶中还原糖释放量的影响作用。
1.2.2 蛋白酶抑制剂对刺参肠蛋白质降解作用的影响
根据Laemmli[17]的方法并作适当修改。取1.2.1节所得经紫外照射或未经照射的刺参肠匀浆液300 μL,加入900 μL的200 mmol/L McIIvaine’s缓冲溶液(Pepstain pH 2.2、SBTI pH 8.0、丝氨酸蛋白酶抑制剂pH 4.4)后,于48 ℃孵育3 h。加入等体积的5×上样缓冲溶液(8 mol/L尿素、5% SDS、5%巯基乙醇、250 mmol/L pH 7.5 Tris-HCl),煮沸5 min后样品于摇床过夜。10 000×g离心10 min后,取上清液10 μL,进行SDS-PAGE分析,浓缩胶质量浓度5 g/100 mL,分离胶质量浓度15 g/100 mL,每块胶浓缩胶电流8 mA,分离胶电流15 mA,电泳缓冲液采用SDS-Tris-甘氨酸体系。电泳完毕后,利用考马斯亮蓝R-250往复振荡染色,采用凝胶成像仪进行成像。以未自溶的刺参肠组为空白对照,以未添加蛋白酶抑制剂的自溶组为阳性对照。
1.2.3 蛋白酶抑制剂对刺参肠自溶中TCA可溶性寡肽释放的影响
利用Lowery法测定TCA可溶性寡肽含量[18]。取1.2.2节所得自溶或未自溶的刺参肠样品煮沸5 min后,加入等体积的20%的TCA溶液,静置20 min,经12 000×g离心10 min,取100 μL稀释一定倍数的上清液,加入Folin-酚甲液500 µL,振荡后静置10 min,再加入Folin-酚乙液50 μL,立即振荡后静置30 min,500 nm波长处测定吸光度。甲液由2 g/100 mL碳酸钠溶液及0.4 g/100 mL氢氧化钠混合溶液-2 g/100 mL酒石酸钾钠溶液-1 g/100 mL硫酸铜(100∶1∶1,V/V)溶液混合,现用现配,乙液为Folin-酚溶液。以牛血清蛋白为标准品获得标准曲线y=0.629x+0.006 (R2= 0.998)。以未自溶的新鲜刺参肠组为空白对照,以未添加蛋白酶抑制剂的自溶组为阳性对照。根据标准曲线计算TCA可溶性寡肽含量,设空白组样品为数值为1,计算TCA可溶性寡肽相对含量。
1.2.4 糖苷酶抑制剂对刺参肠自溶中还原糖释放的影响
利用3,5-二硝基水杨酸法测定还原糖[19],并稍作修改。取1.2.1节所得经紫外照射或未经照射的刺参肠匀浆液300 μL,加入900 μL去离子水,加入淀粉酶抑制剂α-Amylase及β-1,3-葡聚糖酶抑制剂Nojirimycin于50 ℃孵育3 h。经12 000×g离心10 min后取上清液500 μL,加入DNS试剂500 μL,于沸水浴中加热5 min,取出后立即浸入冰上冷却至室温,摇匀,在540 nm波长处测定吸光度。以葡萄糖为标准品绘制标准曲线y=0.000 9x-0.031(R2=0.998 4)。以未自溶的新鲜刺参肠组为空白对照,以未添加糖苷酶抑制剂的自溶组为阳性对照。根据标准曲线计算还原糖的释放量,设空白组样品的还原糖含量为1,计算还原糖的相对含量。
1.2.5 数据处理及统计学分析
2 结果与分析
2.1 胃蛋白酶对刺参肠自溶的影响
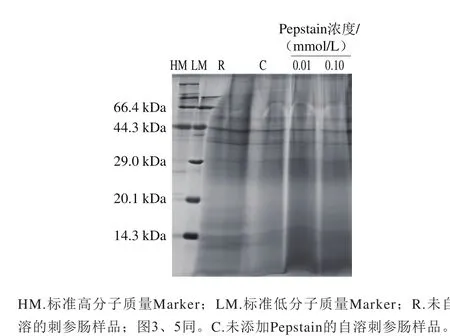
图1 Pepstain对刺参肠自溶过程中蛋白质降解作用的影响Fig. 1 Effects of pepstatin on proteolysis during autolysis of sea cucumber guts
利用SDS-PAGE检测pH 2.2条件下不同浓度的Pepstain对刺参肠蛋白质降解的影响作用,结果如图1所示。刺参肠本身所含蛋白质较多,约为干质量的70.9%[15],未自溶样品电泳条带呈现弥散状。经自溶诱导后条带整体变浅。Pepstain在0.01 mmol/L和0.1 mmol/L这两种浓度下对刺参肠蛋白质的降解作用有一定抑制,表现为29 kDa以下弥散条带加深。这表明胃蛋白酶参与刺参肠自溶过程中蛋白质的降解。有研究表明,蛋白酶的活性受pH值的影响很大,硬骨鱼类的胃蛋白酶只有在强酸中才能有效地分解蛋白质[20-21],一般最适pH值在2.0~3.0之间[22]。刺参肠中含有酸性蛋白酶,Fu Xueyan等[11]利用SDS-PAGE法证明刺参肠中的酸性蛋白酶最适pH值在2.0~5.0之间。前期研究显示刺参肠在pH 4.4条件下,自溶效果最好,在本研究显示刺参肠在pH 2.2条件下,蛋白质降解程度并不强烈,这与前期发现一致。
为进一步明确Pepstain对刺参肠自溶的抑制作用,在pH 2.2条件下,进一步考察0.01 mmol/L和0.1 mmol/L的Pepstain对刺参肠自溶过程中TCA可溶性寡肽释放量的影响,如图2所示。在pH 2.2条件下,刺参肠经自溶诱导后,其TCA可溶性寡肽含量显著提高(P<0.05),向自溶样品中加入一定浓度的Pepstain后,与自溶组相比,TCA可溶性寡肽的含量显著降低(P<0.05)。且随着浓度提高抑制效果加强,结合SDS-PAGE检测结果,说明胃蛋白酶参与刺参肠自溶过程。

图2 Pepstain对刺参肠自溶过程中TCA可溶性寡肽释放的影响(pH 2.2)Fig. 2 Effects of pepstatin on the release of TCA-soluble oligopeptide during autolysis of sea cucumber guts at pH 2.2
2.2 胰蛋白酶对刺参肠自溶的影响

图3 SBTI对刺参肠自溶过程中蛋白质降解作用的影响Fig. 3 Effects of trypsin inhibitor on proteolysis during autolysis of sea cucumber guts
采用SDS-PAGE分析pH 8.0条件下SBTI对刺参肠自溶过程中蛋白质降解的影响,结果见图3。经自溶诱导后,与未自溶样品对比,44.3 kDa以上的蛋白质降解明显,29 kDa以下产生很多的降解产物。在pH 8.0的自溶环境下,SBTI在0.05 mg/mL质量浓度下对刺参肠蛋白质的降解仅有略微的抑制作用,表现为44.3 kDa以上的蛋白质条带与自溶样品相比仅略微加深。大量研究表明水产动物如虹鳟(Oncorhynchus mykiss)[23]、金枪鱼(Thunnus albacores)[24]及嘉陵江鲇[25]等,其胰蛋白酶在pH 8.0条件下活性较高,本实验结果说明,在pH 8.0条件下胰蛋白酶对刺参肠的自溶影响微弱。
为进一步明确SBTI对刺参肠自溶的抑制效果,考察pH 8.0条件下,0.05 mg/mL和0.1 mg/mL质量浓度的SBTI对刺参肠自溶过程中TCA可溶性寡肽释放量的影响,结果如图4所示。在pH 8.0条件下,刺参肠经自溶诱导后,TCA可溶性寡肽含量显著提高(P<0.05),TCA可溶性寡肽的相对含量仅为2.68±0.03,小于pH 2.2酸性条件下的TCA可溶性寡肽的相对含量为3.33±0.07,说明酸性条件更有利于刺参肠的降解。向自溶样品中加入一定浓度的SBTI后,与自溶组相比,TCA可溶性寡肽的含量显著降低(P<0.05),但两种浓度作用基本相同(P>0.05),综合SDS-PAGE分析和TCA可溶性寡肽两项指标,表明胰蛋白酶虽参与刺参肠的自溶,但作用微弱。
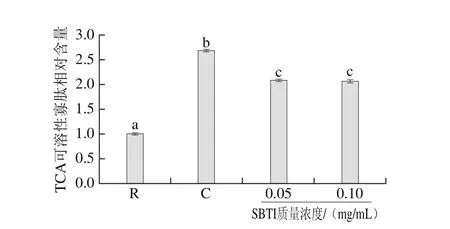
图4 SBTI对刺参肠自溶过程中TCA可溶性寡肽释放的影响Fig. 4 Effects of trypsin inhibitor on the release of TCA-soluble oligopeptide during autolysis of sea cucumber guts
2.3 丝氨酸蛋白酶抑制剂对刺参肠自溶的影响
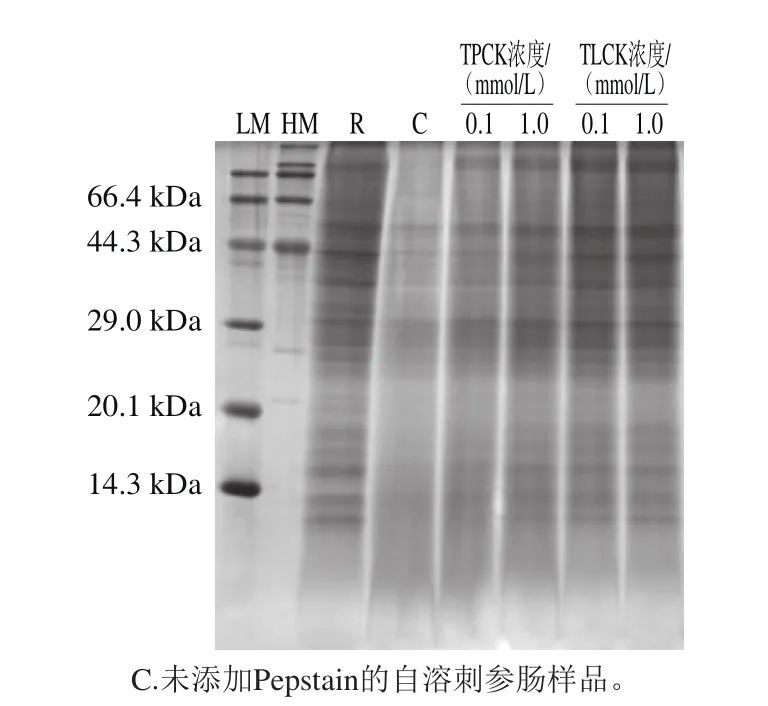
图5 丝氨酸蛋白酶抑制剂对刺参肠自溶过程中蛋白质降解作用的影响Fig. 5 Effects of serine protease inhibitors on proteolysis during autolysis of sea cucumber guts
Yan Longjie等[26]成功从海参肠中纯化得到一种丝氨酸蛋白酶,由此可见海参肠中含有含量丰富的丝氨酸蛋白酶,利用SDS-PAGE分析pH 4.4条件下不同浓度的丝氨酸蛋白酶抑制剂,TLCK、TPCK对刺参肠蛋白质降解的影响作用,如图5所示。经自溶诱导后,与未自溶样品对比刺参肠蛋白质降解剧烈。在pH 4.4的自溶条件下,丝氨酸蛋白酶抑制剂TPCK在0.1 mmol/L和1 mmol/L两种浓度下对刺参肠蛋白质的降解均有一定的抑制作用,表现为分子质量大于29.0 kDa及小于20.1 kDa的蛋白质的条带加深,与TPCK相似,TLCK对自溶刺参肠的蛋白质降解有明显的抑制作用,上述结果说明,丝氨酸蛋白酶参与刺参肠自溶过程中。
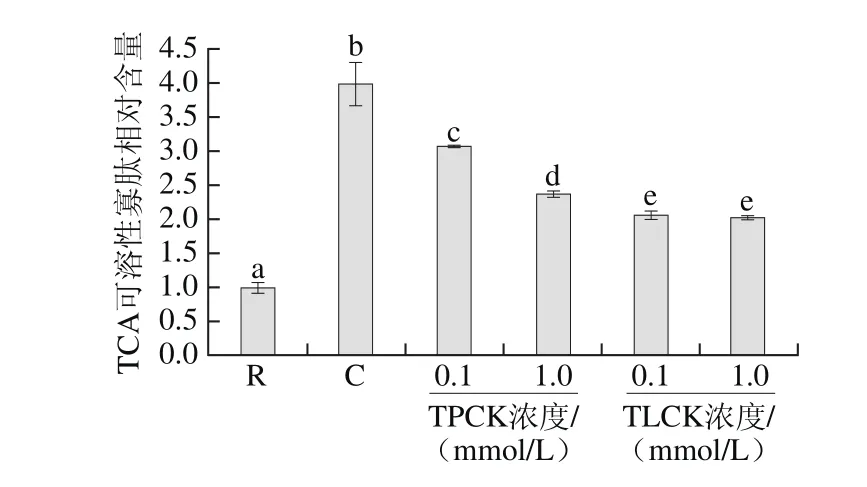
图6 丝氨酸蛋白酶抑制剂对刺参肠自溶过程中TCA可溶性寡肽释放的影响Fig. 6 Effects of serine protease inhibitors on the release of TCA-soluble oligopeptide during autolysis of sea cucumber guts
考察pH 4.4条件下,0.1 mmol/L和1 mmol/L浓度下的两种丝氨酸蛋白酶抑制剂TLCK、TPCK对刺参肠自溶过程中TCA可溶性寡肽释放量的影响作用,如图6所示。在pH 4.4条件下,刺参肠经自溶诱导后,TCA可溶性寡肽含量显著提高(P<0.05),其相对含量可达到3.98±0.31,强于在pH 2.2和pH 8.0条件下的刺参肠TCA可溶性寡肽相对含量,这与前期发现一致[15]。向自溶样品中加入一定浓度的丝氨酸蛋白酶抑制剂后,与自溶组相比,TCA可溶性寡肽的含量显著降低(P<0.05),且TLCK的作用效果强于TPCK。均与SDS-PAGE检测结果一致。上述结果说明,丝氨酸参与刺参肠的自溶,相比于胃蛋白酶和胰蛋白酶,其作用效果较强。研究发现,刺参肠的天然pH值为6.0±0.02,呈现弱酸性,由于消化酶的活性受pH值影响较大,因此本实验在应用各种蛋白酶抑制剂时,对于消化酶选择其最适pH值条件下进行,而对于丝氨酸蛋白酶,选择在刺参肠最适的pH值下进行,这可能导致不同抑制剂对刺参肠自溶作用不同的原因。
2.4 糖苷酶对刺参肠自溶中还原糖释放的影响
α-淀粉酶抑制剂是属于糖苷水解酶抑制剂中的一种,它能有效地抑制淀粉酶的活性[27]。β-1,3-葡聚糖酶抑制剂是一类新的抗真菌抗生素,它通过抑制葡聚糖合成酶,而干扰细胞壁的合成,从而产生抗真菌作用[28]。β-1,3-葡聚糖苷酶主要分布于海洋无脊椎动物动物中,有研究表明该酶参与海洋无脊椎动物对藻类食物的消化,并在其胚胎发育过程中发挥着重要的作用[29-30]。为明确糖苷酶抑制剂对刺参肠自溶中还原糖释放量的影响,分别考察自然pH值条件下,0.01 mmol/L和0.05 mmol/L两种浓度的糖苷酶抑制剂,α-Amylase、Nojirimycin的作用,如图7所示。自然pH值条件下,刺参肠经自溶诱导后,还原糖释放量显著提高(P<0.05),这与前期结果一致[8],向自溶样品中加入一定浓度的β-1-3-葡聚糖酶抑制剂和α-淀粉酶抑制剂后,与自溶组相比,自溶过程中的溶出的还原糖明显下降(P<0.05),上述结果表明淀粉酶和β-1,3葡萄糖苷酶均参与了刺参肠的自溶过程。

图7 糖苷酶抑制剂对刺参肠自溶过程中还原糖释放量的影响Fig. 7 Effects of glycosidase inhibitors on the release of reducing sugar during autolysis of sea cucumber S. japonicus guts
3 结 论
刺参肠自溶后,其蛋白质会发生明显的降解,同时TCA可溶性寡肽和还原糖释放量显著提高。结合SDSPAGE检测,发现刺参肠自溶过程中,多种酶参与其中,胃蛋白酶、胰蛋白酶、丝氨酸蛋白酶、α-淀粉酶和β-1,3-葡萄糖苷酶均参与了刺参肠自溶过程。
[1] 朱蓓薇. 海珍品加工理论与技术的研究[M]. 北京: 科学出版社,2010(9): 3-5.
[2] NGO D H, WIJESEKARA I, VO T S, et al. Marine food-derived functional ingredients as potential antioxidants in the food industry:an overview[J]. Food Research International, 2011, 44(2): 523-529.DOI:10.1016/j.foodres.2010.12.030.
[3] 农业部渔业局. 中国渔业年鉴[M]. 北京: 中国农业出版社, 2016:57-58.
[4] ANDERSON S C, FLEMMING J M, WATSON R, et al. Serial exploitation of global sea cucumber fisheries[J]. Fish & Fisheries,2011, 12(3): 317-339. DOI:10.1111/j.1467-2979.2010.00397.x.
[5] ZHU B W, ZHENG J, ZHANG Z S, et al. Autophagy plays a potential role in the process of sea cucumber body wall “Melting” induced by UV irradiation[J]. Wuhan University Journal of Natural Sciences,2008, 13(2): 232-238. DOI:10.1007/s11859-008-0220-3.
[6] ZHAO C C, YANG Y, WU H T, et al. Characterization of proteolysis in muscle tissues of sea cucumber Stichopus japonicus[J]. Food Science and Biotechnology, 2016, 25(6): 1529-1535. DOI:10.1007/s10068-016-0237-x.
[8] 郑杰, 吴海涛, 董秀萍, 等. 基于主要化学成分变化建立的海参自溶评价指标[J]. 大连工业大学学报, 2010, 29(6): 391-395.
[9] GAO F, YANG H S, XU Q, et al. Effect of water temperature on digestive enzyme activity and gut mass in sea cucumber Apostichopus japonicus (Selenka), with special reference to aestivation[J]. Chinese Journal of Oceanology and Limnology, 2009, 27(4): 714-722.DOI:10.1007/s00343-009-9202-3.
[10] SUN L M, ZHU B W, WU H T, et al. Purif i cation and characterization of Cathepsin B from the gut of the sea cucumber (Stichopus japonicas)[J].Food Science and Biotechnology, 2011, 20(4): 919-925. DOI:10.1007/s10068-011-0127-1.
[11] FU X Y, XUE C H, MIAO B C et a1. Study of a highly alkaline protease extracted from digestive tract of sea cucumber (Stichopus japonicus)[J]. Food Research International, 2005, 38(3): 323-329.DOI:10.1016/j.foodres.2004.09.014.
[12] MCGETTIGAN S, CANNING M, O’CUINN G, et al. Peptide hydrolases in holothurian intestinal mucosa[J]. Comparative Biochemistry and Physiology Part C: Comparative Pharmacology,1981, 69(1): 169-170. DOI:10.1016/0306-4492(81)90123-4.
[13] ZHU B W, ZHAO J G, YANG J F, et al. Purification and partial characterization of a novel β-1,3-glucanase from the gut of sea cucumber Stichopus japonicus[J]. Process Biochem, 2008, 43(10):1102-1106. DOI:10.1016/j.procbio.2008.06.001.
[14] 郑杰, 吴海涛, 朱蓓薇, 等. 海参肠自溶水解物抗氧化活性的研究[J].大连工业大学学报, 2011, 30(5): 313-317.
[15] ZHENG J, WU H T, ZHU B W, et al. Identif i cation of antioxidative oligopeptides derived from autolysis hydrolysates of sea cucumber(Stichopus japonicus) guts[J]. European Food Research and Technology,2012, 234(5): 895-904. DOI:10.1007/s00217-012-1708-9.
[16] WU H T, LI D M, ZHU B W, et al. Proteolysis of noncollagenous proteins in sea cucumber, Stichopus japonicus, body wall:characterisation and the effects of cysteine protease inhibitors[J].Food Chemistry, 2012, 141(2): 1287-1294. DOI:10.1016/j.foodchem.2013.03.088.
[17] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[18] LOWRY, O H, ROSENBROUGH, N J, FAIR, A L, et al.Proteinmeasurement with the Folin-phenol reagents[J]. Journal of Biological Chemistry, 1951, 193(1): 265-275.
[19] 张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社, 1999:10-12.
[20] VYS W, HECHT T. Assay on the digestive enzymes of sharp tooth catifish clarias gariepinus (Pisces: clariidae)[J]. Aquaculture, 1987,63(1/2/3/4): 301-310. DOI:10.1016/0044-8486(87)90080-9.
[21] VIELMA J, RUOHONEN K, LALL S P. Supplemental citric acid and particle size of fi sh bone-meal inf l uence the availability of mineraIs in rainbow trout Oncorhynehus mykiss (Walbaum)[J]. Aquaculture Nutrition, 1999, 5(1): 65-71. DOI:10.1046/j.1365-2095.1999.00092.x.
[22] 周景样, 陈勇, 黄权, 等. 鱼类消化酶的活性及环境条件的影响[J].北京大学学报, 2001, 2(1): 70-83.
[23] HIDALGO M C, UREA E, SANZ A. Comparative study of digestive enzymes in fish with different nutritional habits: photolytic and amylase activities[J]. Aquaculture, 1999, 170(3/4): 267-283.
[24] ALEJANDRO B J, CAMILO P, DANIEL M, et al. A preliminary study of digestive enzyme activities and amino acid composition of early juvenile yellowfin tuna (Thunnus albacaras)[J]. Aquaculture,2011, 312(4): 205-211. DOI:10.1016/j.aquaculture.2010.12.027.
[25] 向枭, 周兴华, 陈建, 等. pH对嘉陵江鲇消化酶活性的影响[J]. 淡水渔业, 2013, 43(4): 13-17.
[26] YAN L J, ZHAN C L, CAO M J, et al. Purif i cation, characterization,cDNA cloning and in vitro expression of a serine proteinase from the intestinal tract of a sea cucumber (Stichopus japonicus) with collagen degradation activity[J]. Journal of Agriculatural and Food Chemistry,2014, 62(20): 4769-4777. DOI:10.1021/jf500923y.
[27] 吕凤霞, 陆兆新. α-淀粉酶抑制剂的研究进展[J]. 食品科学, 2002,23(3): 152-155.
[28] 顾觉奋, 张绍谭. β-1,3-葡聚糖合成酶抑制剂类抗真菌抗生素[J]. 药品评价, 2004, 1(4): 300-304.
[29] 赵军岗, 董秀萍, 朱蓓薇, 等. 海参肠道β-1,3-葡聚糖酶的提取条件及其酶学性质[J]. 大连轻工业学院学报, 2007, 26(4): 289-294.
[30] KOZHEMYAKO V B, REBRIKOV D V, LUKYANOV S A, et al. Molecular cloning and characterization of an endo-1,3-β-D-glucanase from the mollusk Spisula sachalinensis[J]. Comparative Biochemistry and Physiology Part B, 2004, 137(2): 169. DOI:10.1016/j.cbpc.2003.10.018.
Effect of Endogenous Enzymes on Autolysis of Sea Cucumber Stichopus japonicus Guts
LI Aoting, DU Yinan, DUAN Xiuhong, CHAI Xiaoqian, WU Chao, TANG Yue, YU Cuiping, WU Haitao*
(National Engineering Research Center of Seafood, School of Food Science and Technology,Dalian Polytechnic University, Dalian 116034, China)
The effect of endogenous enzymes on the autolysis of sea cucumber (Stichopus japonicas) guts was studied by addition of various protease inhibitors. The autolysis was evaluated by the release of trichloroacetic acid (TCA)-soluble oligopeptides and reducing sugar, and detected by sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE).The results indicated that different inhibitors, including pepsin inhibitor, trypsin inhibitor, serine protease inhibitor, amylase inhibitor and β-1,3-glucanase inhibitor showed inhibitory effects on the autolysis of S. japonicus guts in a certain range of concentration. The serine protease inhibitor N-tosyl-L-phenylalaninyl-chloromethyl ketone (TPCK) showed relatively higher inhibitory effect than the other inhibitors. These results suggest endogenous enzymes, including pepsin, trypsin, serine proteases, amylase and β-1,3-glucanase, may be involved in the autolysis of S. japonicus guts.
Stichopus japonicus; guts; autolysis; endogenous enzymes; serine proteases
10.7506/spkx1002-6630-201802014
TS254
A
1002-6630(2018)02-0088-05
李傲婷, 杜椅楠, 段秀红, 等. 内源酶对刺参肠自溶的作用[J]. 食品科学, 2018, 39(2): 88-92.
10.7506/spkx1002-6630-201802014. http://www.spkx.net.cn
LI Aoting, DU Yinan, DUAN Xiuhong, et al. Effect of endogenous enzymes on autolysis of sea cucumber Stichopus japonicus guts[J]. Food Science, 2018, 39(2): 88-92. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201802014. http://www.spkx.net.cn
2016-11-02
国家自然科学基金面上项目(31370037);大连市高层次人才创新支持计划项目(2015R083)
李傲婷(1992—),女,硕士研究生,研究方向为食品生物技术。E-mail:756574359@qq.com
*通信作者简介:吴海涛(1980—),女,副教授,博士,研究方向为食品生物技术。E-mail:wht205@163.com
