pH偏移结合热处理对大豆蛋白柔性与乳化性的影响
2018-07-24徐晔晔高婷婷王喜波江连洲
王 健,徐晔晔,于 洁,高婷婷,王喜波*,江连洲
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
大豆分离蛋白(soy protein isolate,SPI)因其良好的功能性质、营养价值及潜在的健康益处而成为国内外的研究热点并被广泛应用于食品的多个领域[1-3]。蛋白质的柔性可以理解为蛋白质所处外部环境变化时,其结构能够发生改变的能力,反映出蛋白质结构对环境变化的敏感性[4-6]。因其在决定蛋白功能性质尤其是界面性质中的关键作用而受到越来越多学者的关注。耿蕊等[7]研究发现pH偏移结合加热处理在一定程度上改善了SPI的乳化性。Jiang Jiang等[8]研究发现,SPI经过酸性pH偏移处理后会形成“熔球态”的结构,即在保持蛋白原有二级结构不变的基础上,其三级结构和四级结构发生了改变,在这种状态下SPI的乳化能得到了显著的提升。但目前鲜见从蛋白柔性的角度研究pH偏移结合热处理对SPI结构与功能性质关系的影响的报道。
以SPI对胰蛋白酶的敏感性表征量化柔性,研究pH偏移结合热处理对SPI柔性的影响,并探索SPI柔性与乳化性质的相关性,为进一步探索柔性在蛋白结构和功能性质中的作用提供理论依据。
1 材料与方法
1.1 材料与试剂
大豆 东北农业大学大豆研究所;大豆油 九三集团哈尔滨惠康食品有限公司;三氯乙酸 永华精细化学品有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三羟甲基氨基甲烷(tris(hydroxymethyl)methyl aminomethan,Tris)、胰蛋白酶、8-苯氨基-1-萘磺酸铵盐(8-anilinonaphthalene-1-sulfonic acid, azane, hydrate,ANS)荧光探针 美国Sigma公司;5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB) 美国Merck公司;其他试剂均为分析纯。
1.2 仪器与设备
T18 Basic型高速分散机/匀浆机 德国IKA公司;LD4-2A低速离心机 北京医用离心机厂;TU-1800型紫外-可见分光光度计 北京普析通用仪器有限责任公司;ALPHA 1-4 LSC型冷冻干燥机 德国Christ公司;ALC-310.3型分析天平 德国艾科勒公司;UV2600紫外分光光度计 美国布鲁克海文仪器公司;F-4500荧光分光光度计 日本日立公司;HH-6恒温数显水浴锅常州赛普实验仪器厂;DSX-208B灭菌锅 上海申安医疗器械厂。
1.3 方法
1.3.1 SPI制备
参照Sorgentini等[9]的方法并略作改动。原料大豆用粉碎机粉碎后过60 目筛,索氏抽提,脱脂后的低温脱脂豆粕与蒸馏水以质量比1∶10的比例混合,调体系pH值至8.5,室温低速搅拌2 h。离心(4 000×g)20 min,取上清液,调pH值至4.5,4 ℃静置过夜,取沉淀进行离心(4 000×g,5 min),水洗沉淀2 次,复溶后调pH值至7.0,预冻后进行冷冻干燥。
1.3.2 SPI成分测定
蛋白含量:参考GB 5009.5—2010《食品中蛋白质的测定》凯氏定氮法测定;水分含量:参考GB 5009.3—2010《食品中水分的测定》直接干燥法测定;灰分含量测定:参考GB 5009.4—2010《食品中灰分的测定》;粗脂肪含量测定:参考GB/T 14772—2008《食品中粗脂肪的测定》。
1.3.3 样品前处理
将SPI溶于去离子水,质量浓度为20 mg/mL,22 ℃搅拌2 h,10 000 r/min分散处理1 min,静置12 h。
1.3.4 样品处理
将制备好的样品调pH值分别为pH 2.0、pH 7.0和pH 11.0。温度分别为90、120 ℃处理15 min,迅速冰水冷却5 min后调pH值至7.0备用。
1.3.5 柔性测定
参照Kato等[10]的方法略作修改。利用SPI对胰蛋白酶的敏感性来表征柔性。取250 μL1 mg/mL(0.05 mol/L、pH 8.0 Tris-HCl缓冲液)酶液加入到4 mL1 mg/mL处理后SPI蛋白溶液中(蛋白∶酶=16∶1),38 ℃保温酶解5 min,酶解反应结束后,加4 mL 5%三氯乙酸终止反应,离心后取上清液测定其在波长280 nm吸光度,用吸光度A表征量化柔性。
1.3.6 浊度测定
参照Kurganov等[11]的方法并略作改动,将处理后的SPI样品溶液稀释至3 mg/mL,混合均匀后在波长400 nm处测定其吸光度,所得吸光度表示浊度,所有测定结果重复3 次。
1.3.7 游离巯基含量测定
参照Beveriger等[12]的方法并略作改动。取1 mL不同条件处理后SPI样品(10 mg/mL)加入到5 mL的Tris-甘氨酸缓冲溶液(0.086 mol/L Tris、0.09 mol/L甘氨酸、0.004 mol/L乙二胺四乙酸、8 mol/L尿素,pH 8.0)中,然后加入20 μL DTNB试剂,振荡混匀,在室温条件下静止反应15 min,在波长412 nm处测定吸光度,以不加DTNB的溶液做空白调零。游离巯基浓度按公式(1)计算:

式中:A412nm为412 nm波长处的吸光度;C为固形物质量浓度/(mg/mL);D为稀释系数。
1.3.8 表面疏水性测定
参照Schmal等[13]方法并略作改动。用0.01 mol/L的磷酸盐缓冲液(pH 7.0)将SPI样品溶液稀释到样品质量浓度分别为0.1、0.05、0.0025 mg/mL和0.001 25 mg/mL,加入20 μL的ANS(8 mmol/L,溶于0.01 mol/L的磷酸盐缓冲液,pH 7.0)荧光探针,混匀后在室温条件下避光15 min后测定SPI样品的荧光强度,同时设定激发波长为390 nm,发射波长为470 nm,狭缝宽度5 nm,测得的荧光强度对蛋白溶液浓度作图,选择线性关系良好的回归线的斜率作为蛋白质表面疏水性指数。
1.3.9 粒径测定
将处理过后的SPI样品用去离子水稀释到1 mg/mL,在粒度测定仪上进行粒度的测定,每个蛋白样品检测3次。
1.3.10 紫外扫描
参照Liang Hanni等[14]的方法并略作改动。处理后的SPI样品稀释至0.2 mg/mL后进行紫外扫描,扫描波长范围190~500 nm,扫描速率100 nm/min,分辨率0.2 nm,所有测定结果重复3 次。
1.3.11 内源性色氨酸荧光光谱测定
参照Liu Yan等[15]的方法并略作改动。处理后的SPI样品稀释到0.2 mg/mL进行测定,同时设定激发波长为290 nm,发射波长范围为300~460 nm,狭缝宽度均为2.5 nm,电压为700 mV进行荧光光谱扫描,所有测定结果重复3 次。
1.3.12 乳化性测定
参照Tang等[16]的方法。将处理后的SPI蛋白样品稀释到2 mg/mL,处理后蛋白样品与大豆油以体积比3∶1混合,分散机(10 000 r/min)处理1 min,迅速吸取底部乳液50 μL加入到5 mL 0.1% SDS溶液中,在旋涡混合器上混合均匀。分别测定0 min和10 min吸光度,乳化活性用吸光度A0表示,乳化稳定性按公式(2)计算:
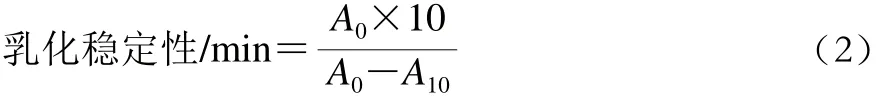
式中:A0为0 min时测得的吸光度;A10为10 min时测得的吸光度。
1.4 数据统计分析
每次实验做3 次平行,结果以 ±s表示,数据间差异显著性采用SPSS 17.0进行统计分析,实验数据用Origin 9.0软件绘图。
2 结果与分析
2.1 SPI的组成

表1 SPI的基本成分及含量Table1 Proximate composition of SPI
如表1所示,实验所制得的SPI蛋白质、水分、灰分和粗脂肪质量分数分别为(90.22±0.44)%、(3.24±0.67)%、(3.39±0.53)%和(0.47±0.06)%,符合实验要求。
2.2 不同pH偏移结合热处理对SPI柔性影响
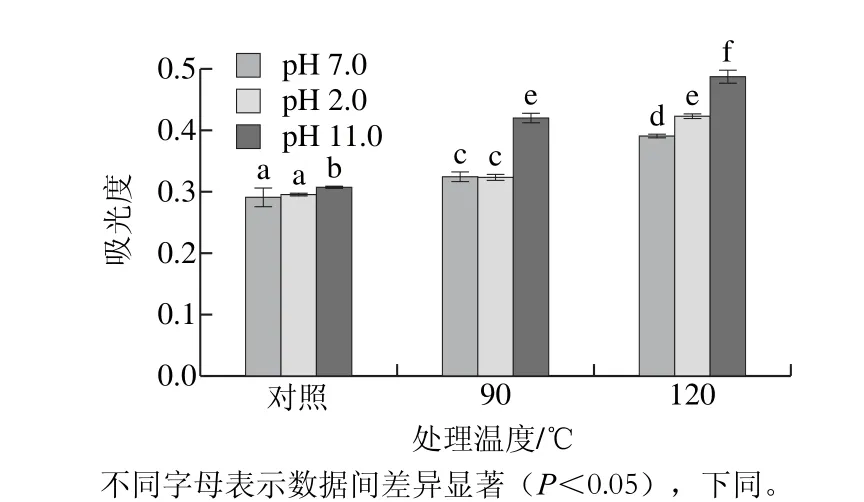
图1 不同pH偏移结合热处理对SPI柔性的影响Fig.1 Eeffect of pH-shifting combined with heating treatment on flexibility of SPI
由图1可知,在各个pH偏移处理条件下,SPI柔性随着处理温度的升高而增大,在处理温度为90 ℃时,pH 2.0和pH 7.0偏移处理条件下柔性无显著性差异,而pH 11.0处理条件下,柔性则显著上升。处理温度为120 ℃时,pH 11.0偏移处理条件下SPI柔性最高,其次分别为pH 2.0和pH 7.0。pH 2.0和pH 11.0偏移处理结合热处理促进了SPI在加热过程中柔性的增加,其中pH 11.0偏移处理结合热处理对柔性影响更为强烈。单独的pH 2.0和pH 11.0偏移处理会导致柔性轻微的上升,已有研究表明酸碱度的变化可以引起SPI结构的变化[17],Ishino等[18]研究发现SPI溶液在pH值大于11.0的碱性条件下会发生蛋白构象变化而变性。pH偏移结合热处理能有效破坏SPI分子天然的刚性结构,导致SPI柔性的增加。
2.3 不同pH偏移结合热处理对SPI表面疏水性影响
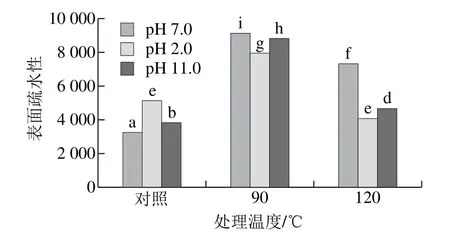
图2 不同pH偏移结合热处理对SPI表面疏水性的影响Fig.2 Effect of pH-shifting combined with heating treatment on surface hydrophobicity of SPI
SPI分子内的疏水相互作用是维系其三级结构的主要作用力,它对蛋白结构的稳定具有关键作用。由图2可知,在各个pH偏移处理条件下,处理温度为90 ℃时,SPI表面疏水性显著上升,随后当处理温度为120 ℃时,表面疏水性却显著降低。与其他处理条件相比,SPI在pH 7.0、90 ℃处理条件时表面疏水性最高,这与顾龙建等[19]的结果相似,研究发现90 ℃热处理会导致SPI表面疏水性的增加。Wang Jinmei等[20]认为SPI在90 ℃条件下进行热处理时可以导致SPI蛋白的变性,其结构更加舒展,原来隐藏在分子内层的疏水性基团暴露出来,所以SPI表现出很高的表面疏水性。相反,在120 ℃处理SPI时,蛋白之间产生的过度疏水作用导致聚集体形成,从而导致SPI表面疏水性降低。
而单独pH 2.0和pH 11.0偏移处理会导致SPI表面疏水性的增加,其中pH 2.0偏移处理增加幅度更大,原因可能是酸碱偏移处理可以使SPI蛋白结构舒展,蛋白不能完全恢复最初的天然状态,从而暴露出分子内部部分疏水性基团,导致表面疏水性的增加。
2.4 不同pH偏移结合热处理对SPI游离巯基含量影响
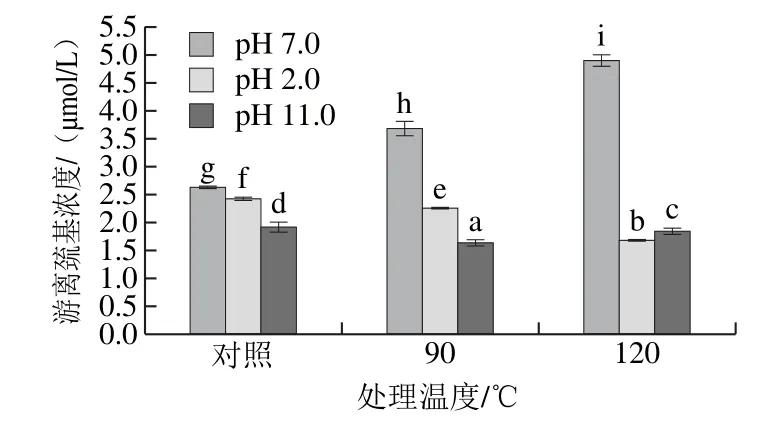
图3 不同pH结合热处理对SPI游离巯基含量的影响Fig.3 Effect of pH-shifting combined with heating treatment on the content of free sulfhydryl groups in SPI
有2 种情况会导致蛋白分子中游离巯基含量的改变,一种情况是蛋白由于外界作用导致结构展开,原来在分子内部巯基的暴露。另一种情况可能是蛋白亚基的解离导致二硫键断裂从而生成新的游离巯基[18]。一般来说,游离巯基含量变化意味着蛋白结构改变,由图3可知,在pH 7.0条件下,热处理温度的上升会导致SPI游离巯基含量的上升,相反,在pH 2.0和pH 11.0偏移处理条件下热处理温度的升高会导致SPI游离巯基含量的降低,可能的解释是由于热处理,SPI分子内或分子间形成二硫键,同时还可能伴随有氧化反应的发生,从而使得巯基含量下降[23]。而单独pH 2.0和pH 11.0偏移处理会导致SPI游离巯基含量的下降,这与耿蕊等[19]的研究一致。另外,Hwang等[24]研究发现,酸处理能够显著降低大豆蛋白的二硫键,使巯基含量升高。在pH 7.0条件下游离巯基含量随处理温度的升高而增加,可能是由于热处理导致二硫键的断裂,而二硫键的断裂,可能是造成pH 7.0条件下柔性上升的主要原因[25]。
在pH 2.0和pH 11.0偏移处理条件下,120 ℃热处理使SPI蛋白拥有柔性更高的构象,而表面疏水性和游离巯基含量却下降,可能的解释是由于120 ℃热处理导致SPI发生疏水相互作用形成聚集体,此过程使部分游离巯基内卷于聚集体内部,而非形成新的二硫键,维持了蛋白的柔性构象[20]。
2.5 不同pH偏移结合热处理对SPI浊度影响
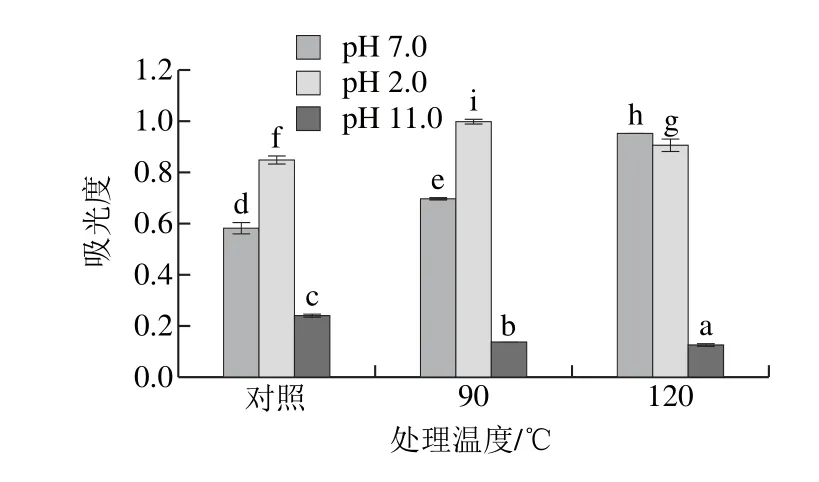
图4 不同pH偏移结合热处理对SPI浊度的影响Fig.4 Effect of pH-shifting combined with heating treatment on turbidity of SPI
由图4可知,在pH 7.0条件下,热处理温度的上升会导致SPI浊度的上升。在pH 2.0偏移处理条件下,处理温度为90 ℃时,SPI浊度达到最大,在120 ℃时又略有下降。在pH 11.0偏移处理条件下,热处理温度的上升会导致SPI浊度的下降。在pH 7.0条件下,热处理导致蛋白分子之间形成聚集体,故浊度上升。pH 2.0偏移处理条件下浊度显著增大的变化趋势可能是由于在调pH值回7.0过程中,蛋白重新形成了较大的聚集体,导致体系中浊度增大。
在pH 11.0偏移处理条件下,热处理温度的上升会导致SPI浊度显著下降,可能是由于碱性条件下,SPI分子中亚基解离,这一点在粒度分析和内源性色氨酸荧光光谱分析中得到了证实,而亚基的解离,可能是pH 11.0偏移结合热处理使SPI柔性显著上升的原因之一。
2.6 不同pH偏移结合热处理对SPI粒径影响

图5 不同pH偏移结合热处理对SPI粒径的影响Fig.5 Effect of pH-shifting combined with heating treatment on particle size of SPI
由图5可知,在pH 7.0条件下,SPI粒径会随着处理温度的升高而降低,这与浊度的结果相反。在pH 2.0偏移处理条件下处理温度为90 ℃会导致SPI粒径的降低,而当处理温度为120 ℃时SPI粒径明显增大,表明120 ℃处理导致SPI分子间发生了聚集,导致较大聚集体的形成。在pH 11.0偏移处理条件下,与pH 7.0未经热处理的条件相比,SPI粒径明显降低,表明在pH 11.0条件下SPI解离,蛋白粒子变小,这与体系浊度变化趋势一致。在pH 11.0偏移处理条件下,90 ℃热处理会导致SPI粒径的降低,而120 ℃热处理则导致SPI粒径略有增加,这可能是源于部分解聚的SPI蛋白质分子重新生成新的聚集体导致SPI平均粒度增大。单独pH 2.0和pH 11.0偏移处理会导致SPI粒径的降低。pH 11.0偏移处理结合热处理造成SPI蛋白粒度的降低,表明SPI蛋白分子发生了解离,这可能是造成SPI柔性增加的原因之一。
2.7 不同pH偏移结合热处理对SPI内源性色氨酸荧光光谱分析
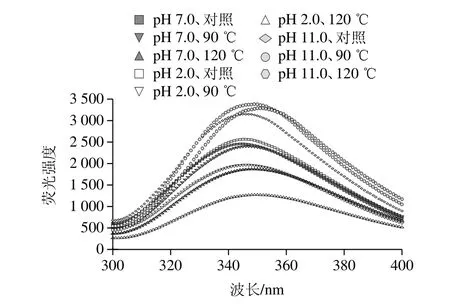
图6 不同pH偏移结合热处理对SPI内源性色氨酸荧光光谱Fig.6 Effect of pH-shifting combined with heating treatment on typical intrinsic emission fluorescence spectrum of SPI
由图6可知,在pH 7.0条件下,SPI内源性荧光强度随着处理温度的上升而减弱,在pH 2.0偏移处理条件下,SPI内源性荧光强度也随着处理温度的上升而减弱,但降低幅度比在pH 7.0条件下更大,推测可能是在pH 2.0偏移处理条件下,由于聚集体的形成,发色基团重新隐藏在SPI分子内部导致荧光强度的降低(2.5节和2.6节结果)。在pH 11.0偏移处理条件下,90 ℃处理温度会导致内源性荧光强度增加,但在处理温度为120 ℃时又略有下降。单独pH 2.0和pH 11.0偏移处理会导致SPI内源性色氨酸荧光强度增加。已有研究表明,蛋白在发生亚基解离的时候,内源荧光扫描的最大吸收波长会向长波长的方向移动(红移)[26]。由图6可知,在pH 11.0偏移处理条件下,SPI内源荧光扫描的最大吸收波长向长波长方向明显移动,这说明SPI在pH 11.0偏移处理条件下发生了亚基的解离,其中热处理会促进亚基的解离。
2.8 不同pH偏移结合热处理对SPI紫外扫描光谱分析
由图7可知,在pH 7.0条件下,随着处理温度的上升,SPI紫外吸收强度也随之上升,这与柔性的变化趋势一致,紫外吸收强度的增加表明SPI分子内部发色基团暴露在外部,SPI结构变得更加舒展。在pH 2.0偏移处理条件下,未进行热处理的SPI紫外吸收强度明显上升,表明单独的pH 2.0偏移处理会造成SPI结构的改变,热处理为90 ℃和120 ℃时会导致pH 2.0偏移处理条件下SPI紫外吸收强度的降低,推测可能是由于聚集体的形成(2.5节和2.6节结果)。聚集体的形成导致暴露在外部发色基团重新隐藏在分子内部。在pH 11.0偏移处理条件下,热处理会造成SPI紫外吸收强度的降低,可能是由于浊度的降低从而导致紫外吸光度的降低。
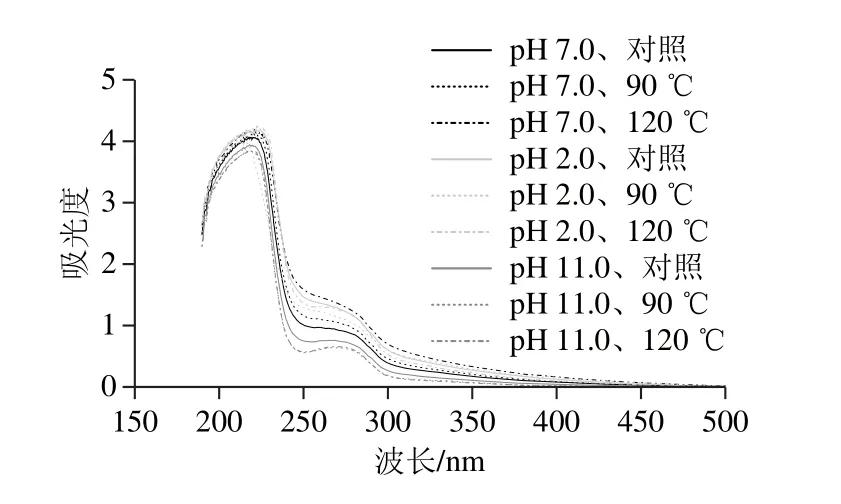
图7 不同pH偏移结合热处理下SPI紫外图谱Fig.7 Effect of pH-shifting combined with heating treatment on UV spectrum of SPI
2.9 不同pH偏移结合热处理对SPI乳化活性和乳化稳定性影响
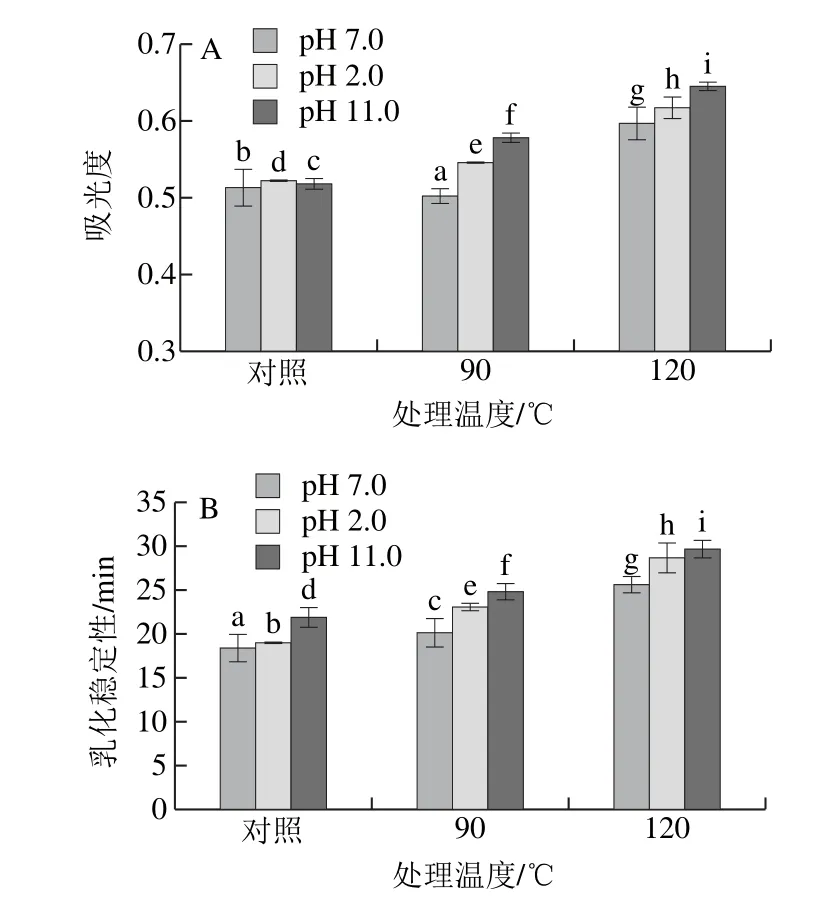
图8 不同pH偏移结合热处理对SPI乳化活性(A)和乳化稳定性(B)的影响Fig.8 Effect of pH-shifting combined with heating treatment on emulsifying activity (A) and emulsion stability (B) of SPI
由图8可知,在各个pH偏移处理条件下,SPI乳化活性和乳化稳定性随着处理温度的升高而增加,pH 2.0和pH 11.0偏移处理结合热处理有利于SPI乳化性质(乳化活性和乳化稳定性)的增加。这与柔性变化趋势一致。pH偏移结合热处理使蛋白分子逐渐展开,分子的形态由紧密的球型结构向松散结构转换,蛋白具有更好的柔性,更加有利于蛋白吸附在油水界面上并展开[27-28]。Tang Chuanhe等[29]认为柔性的增加有利于牛血清蛋白界面的初始吸附和随后的结构重排,从而增加了蛋白的乳化活性。Matsudomi等[30]研究发现,极端酸性pH偏移处理对SPI的结构和表面性质有显著影响。Jiang Jiang等[8]也发现酸性pH偏移处理可引发SPI的结构向熔球态结构转变,造成其乳化性的改善。部分变性和/或展开的蛋白通常表现为蛋白柔性的增强(相对于天然蛋白),这将有利于它们的乳化性能的提高。
2.10 不同pH偏移结合热处理条件下SPI柔性与乳化性的相关关系

图 9 不同pH偏移结合热处理条件下柔性与乳化活性(A)和乳化稳定性(B)的关系Fig. 9 Relationships between flexibility and emulsifying activity (A) or emulsion stability (B) of SPI under different treatment conditions
如图9所示,相关性分析指出,在各个处理条件下SPI柔性与乳化活性和乳化稳定性呈显著正相关关系,相关系数分别为0.945和0.936。而相关性分析指出,各个pH偏移结合热处理条件下SPI表面疏水性与乳化活性和乳化稳定性分别呈正相关关系和显著正相关关系,相关系数分别为0.823和0.912。
不同pH偏移处理条件下SPI结构随柔性的变化趋势各不相同。pH 7.0条件下,蛋白柔性随着热处理温度的升高而增加,SPI表面疏水性在热处理温度90 ℃时显著升高,在120 ℃又明显下降。pH 7.0条件下,只有游离巯基含量随热处理温度的升高而上升,在此条件下SPI柔性的增加可能是由于SPI分子内二硫键的断裂造成的。pH 2.0偏移处理条件下随着热处理温度的升高,柔性逐渐增加,SPI表面疏水性在90 ℃热处理时显著升高,在120 ℃时又明显下降,游离巯基含量随热处理温度升高而下降,处理温度为90 ℃会导致SPI粒径的降低,当处理温度为120 ℃时SPI粒径明显的增大。说明聚集体的形成不会导致柔性的降低,原因可能是维系聚集体刚性结构的化学键与天然的SPI分子内部的化学键相比,化学键(如疏水相互作用和新生成的二硫键)之间的结合力更加容易受到破坏,导致蛋白对外部环境变化更加的敏感,从而聚集体也表现出较好的柔性。pH 11.0偏移处理条件下热处理会造成柔性的增加,SPI表面疏水性在90 ℃热处理时显著升高,在120 ℃时又明显下降。游离巯基浓度随热处理温度升高而下降。热处理90 ℃和120 ℃会导致SPI粒径的降低,内源性色氨酸荧光光谱的结果表明SPI亚基发生了解离。在此条件下SPI柔性的增加可能是由于SPI分子解离造成的。
3 结 论
在各个pH偏移处理条件下,SPI柔性随着处理温度的升高而增加。相比于pH 7.0条件,pH 2.0和pH 11.0偏移处理促进了SPI在加热过程中柔性的增加,其中pH 11.0条件下热处理对柔性影响更加强烈。
pH 7.0条件下,游离巯基含量随热处理温度的升高而增加,SPI柔性的增加与SPI内二硫键的断裂有关。pH 11.0偏移处理条件下,SPI在加热过程中发生了解离,SPI柔性增加。紫外扫描、内源性色氨酸荧光光谱研究发现随着柔性的增加,SPI结构变的更加舒展。
在实验条件下,SPI柔性与乳化活性和乳化稳定性呈显著正相关,相关系数分别为0.945和0.936。
