麦芽糖浆糖基化改性玉米醇溶蛋白及在胶囊壳中的应用
2018-07-24张慧君陈又铭辛德慧沙迪昕王文霞姜宁宁张慧敏
张慧君,陈又铭,辛德慧,沙迪昕,王文霞,姜宁宁,郭 浩,张慧敏
(齐齐哈尔大学食品与生物工程学院,黑龙江 齐齐哈尔 161006)
传统的食用药用胶囊是以动物的骨头、皮和结缔组织为原料,经一系列复杂的理化处理后制得的高蛋白、无脂肪、易被人体吸收的明胶制品。然而该胶囊存在易失水硬化、吸水软化,在贮藏过程中对湿、氧敏感药物保护作用差,与醛类物质易发生交联反应,胶囊壳有崩解延迟及药物溶出度降低等缺陷[1-2]。另外,由于动物疫情(疯牛病)近年来的频繁爆发,牛源性的明胶胶囊被禁用[3-4]。而且明胶制得的胶囊成本较高使得一些不法厂商使用重金属铬超标的工业明胶冒充食用明胶来生产药用胶囊。因此,由于全球动物资源有限,引起了人们对胶囊壁材料的关注,在医药和食品工业中植物胶囊替代明胶胶囊已经成为发展趋势。
玉米黄粉是玉米湿法生产淀粉的副产物,玉米醇溶蛋白是玉米黄粉的主要成分。由于其蛋白分子中存在大量的疏水氨基酸和含硫氨基酸,缺少带电的极性氨基酸,这些氨基酸分子间常以二硫键、疏水键和氢键连接在一起,具有良好的成膜特性[5-6]。玉米醇溶蛋白可在无需添加鞣制剂的条件下制成具有较强阻湿、阻氧以及肠溶性的可食性薄膜[7]。这种优良的成膜特性加上原料的绿色可食性,使得玉米醇溶蛋白膜成为近年来人们研究的热点。然而这种膜材质较脆,机械力学稳定性差,不能满足作为包装材料(如食用或药用胶囊)的力学强度以及产品货架期的要求,不能真正意义用于实际生产[8-9]。
加入塑化剂是一种提高膜机械性能的蛋白质酰化改性的常用方法[10-15],酰化改性是蛋白质的亲核基团如氨基、羟基与酰化试剂的亲电基团的反应[16-17]。由于酰化试剂大多为化学增塑剂,因此作为食用药用胶囊存在安全隐患。也有研究表明,蛋白质琥珀酰化程度提高,会干扰蛋白质生物利用率,有碍消化吸收[18]。
基于美拉德反应的蛋白质糖基化是指还原糖中的羰基与蛋白质的α-或ε-氨基共价连接而形成糖基化蛋白的过程[19],糖的引入可改善蛋白质的功能性质,如提高溶解性、抗氧化性和机械强度等[20-22]。糖基化反应中的氨基酸来源有3 个,有自由氨基酸、蛋白质或多肽的N端胺以及蛋白质中的赖氨酸和精氨酸[23]。羰基供体选择可食用的、具有还原能力的单糖、低聚糖或多糖,将反应控制在反应初期和中期阶段,保证了产品的安全性。
赖氨酸是玉米醇溶蛋白糖基化反应的有效接枝位点[24],本研究通过氨基酸分析结果确定提取玉米醇溶蛋白的溶剂。选择淀粉糖的主要产品麦芽糖浆作为糖基化反应还原糖供体,它是通过α-1,4糖苷键将2 个单位葡萄糖连接在一起的双糖。考察玉米醇溶蛋白和麦芽糖浆糖基化改性后玉米醇溶蛋白的机械性能并制备植物蛋白的胶囊壳,为玉米深加工提供一条新思路。
1 材料与方法
1.1 材料与试剂
玉米黄粉 黑龙江省镜泊湖农业开发股份有限公司;麦芽糖浆 中粮公主岭生化能源有限公司;低分子质量标准蛋白(14.1~29 kDa)辣根过氧化物酶、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上海蓝季科技发展有限公司;三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris) 上海生工生物工程股份有限公司;甲叉双丙烯酰胺(分析纯) 德国默克集团;邻苯二甲醛(o-phthalaldehyde,OPA)(化学纯) 天津光复精细化工研究所;无水乙醇(分析纯) 天津市东丽区天大化学试剂厂。
1.2 仪器与设备
QTS-25质构仪 美国博乐飞公司;Q-20DSC差示扫描量热仪 美国TA公司;s-3400扫描电子显微镜、L-8800氨基酸分析仪 日本日立公司;WSL-1000D超声波信号发生器 南京顺流仪器有限公司;LYOQUEST-85真空冷冻干燥机 西班牙泰士达公司;Thermo702超低温冰箱 赛默飞世尔科技有限公司;ECP3000三恒多用电泳仪 北京六一仪器厂。
1.3 方法
1.3.1 原料预处理
取适量玉米黄粉,经酶法除淀粉、丙酮脱色后的样品,用不同体积分数乙醇溶液浸提2 h,5 000 r/min离心15 min,取上清液,匀速倒入5 倍浸提液体积的0 ℃冰水,搅拌,滴加1 mol/L NaOH溶液调pH 6左右,出现白色沉淀,经5 000 r/min离心3 min,得到沉淀,水洗3 次,冷冻干燥,得到玉米醇溶蛋白样品,备用。
1.3.2 玉米醇溶蛋白氨基酸组成分析
分别采用体积分数60%、70%、80%和95%乙醇溶液浸提去除色素以后的玉米黄粉,提取玉米醇溶蛋白。准确称取不同体积分数乙醇溶液提取玉米醇溶蛋白0.050 0 g,在安瓿瓶中加入6.67 mol/L盐酸9 mL,氮吹仪充氮封瓶口,置于110 ℃烘箱中24 h,酸水解后用6 mol/L NaOH溶液8.50 mL定容。调pH 2.2,用柠檬酸钠缓冲溶液定容至100 mL,过滤,上机分析,检测波长为280 nm,流动相流速为1.8 mL/min,柱温为室温。
1.3.3 玉米醇溶蛋白和玉米醇溶蛋白-麦芽糖浆的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)
样品制备:准确称取玉米醇溶蛋白和玉米醇溶蛋白-麦芽糖浆的冻干样品,用不同体积分数乙醇溶液溶解,配制成质量浓度为3 g/L溶液,取200 μL溶液于1.00 mL离心管中与样品缓冲溶液(0.5 mol/L Tris-HCl,pH 6.8、甘油、10% SDS、0.1%溴酚兰、β-巯基乙醇、双蒸水)1∶1混合,10 000 r/min离心5 min,取上清液沸水浴中煮沸5 min后冷却备用。
电泳实验:分别配制12%的分离胶,5%的浓缩胶。首先灌分离胶,水封,30 min后弃去水。灌浓缩胶胶,30 min后梳胶,置于电泳槽内,注入电极缓冲液。每孔进样量为10 μL,连接电泳仪,恒压控制,浓缩胶上所置电压为80 V,当染料前沿进入分离胶后,电压将提高到设定120 V,当样品带迁移到距离胶板底部1 cm左右,关闭电源。
玉米醇溶蛋白染色和脱色:蛋白质样品在电泳完毕,用固定液(含12.5%三氯乙酸,30%甲醇)固定1 h,然后将胶片放入染色液(含0.1%考马斯亮蓝R-250、10%甲醇、10%冰乙酸)染色2~4 h,然后用脱色液(冰乙酸-甲醇-水,1∶1∶8,V/V)脱色3~10 h,期间更换脱色液,至背景清楚。
玉米醇溶蛋白-麦芽糖浆染色(PAS染色)和脱色:用糖蛋白固定液(12.5%三氯乙酸)固定胶片15 min,双蒸水水洗2 次,1%高碘酸氧化15 min,振荡水洗3 次,每次5 min,在希夫试剂避光染色,30 min,用脱色液(0.5%亚硫酸钠)振荡水洗5 次,至条带清晰。
1.3.4 糖基化改性及膜的制备
用70%的乙醇溶液溶解玉米醇溶蛋白,配制蛋白为8%的乙醇溶液,按一定物料比加入麦芽糖浆,调溶液的pH值,超声波处理,70 ℃水浴条件下发生糖基化反应。反应结束后,反应产物置于70 ℃烘箱烘干成膜,取出置于30 ℃,相对湿度为43%干燥器内平衡48 h,备用。
1.3.5 蛋白膜抗拉强度测定
抗拉强度是衡量蛋白膜机械强度的一个重要指标,表示在单位面积截面上所能承受的拉力。将膜剪成4 cm×1 cm的矩形长条,置于质构仪拉伸探头上,固定好,夹距设定为20 cm,拉伸速率为5 mm/s。按公式(1)计算抗拉强度:

式中:F为最大拉力/N;L为膜样品的厚度/mm;在膜上均匀取10 个点,测厚仪测定其厚度,取平均值;W为膜样品宽度/mm。
1.3.6 接枝度的测定
采用OPA法[25]测定。
试剂1:准确称取0.040 0 g的OPA溶解在1 mL的甲醇中,再加入3 mL的蒸馏水,混匀后,将其保存于棕色试剂瓶中备用。
试剂2:称取质量分数20%的SDS 2.5 mL,0.1 mol/L的硼砂25mL和β-巯基乙醇100 μL,最后用蒸馏水定容至50 mL。
测定时,分别移取0.3 mL试剂1和3.7 mL试剂2于试管中混匀,加入蛋白质量浓度为10 mg/mL样品液200 μL,再次混匀后于35 ℃水浴反应2 min,在波长340 nm处测吸光度。
OPA溶液中加入200 μL赖氨酸代替样品液为空白,二者吸光度差值为游离氨基的净吸光度,赖氨酸作出标准曲线,y=2.869 3x-0.001 8,r2=0.998 9,根据净吸光度计算样品中游离氨基的含量。接枝度按公式(2)计算:
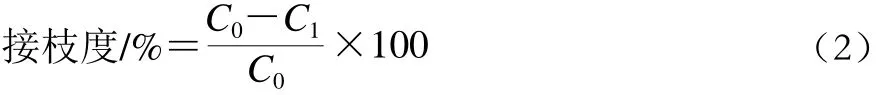
式中:C0为未改性前溶液中游离氨基浓度/(mol/L);C1为改性后溶液中游离氨基的含量/(mol/L)。
1.3.7 正交试验设计
为确定玉米醇溶蛋白-麦芽糖浆的最佳成膜条件,根据单因素试验结果分析,选取物料比、pH值、超声功率、加热时间进行4因素3水平的正交试验。本研究旨在通过改性,提高蛋白质的机械性能,制备具有一定柔韧度的胶囊壳。因此,检测指标仅定为抗拉强度一个指标(以下同),试验设计如表1所示。
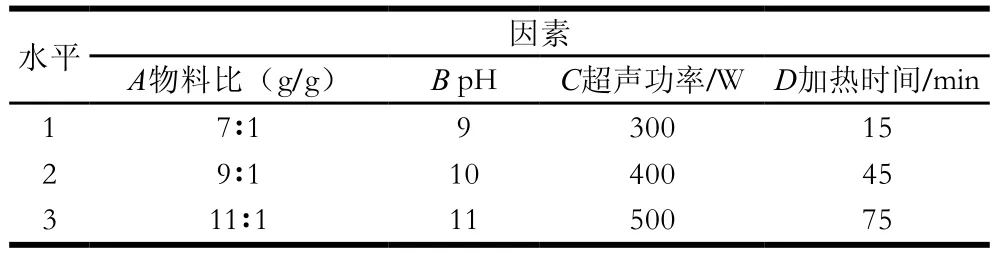
表1 正交试验因素与水平Table1 Coded levels and corresponding actual levels of factors used for orthogonal array design
1.3.8 胶囊壳的制备与检测
采用70%乙醇溶液溶解玉米醇溶蛋白-麦芽糖浆,制成8%左右的溶胶,70 ℃搅拌30 min制备成胶囊溶胶,备用。将涂有甘油的胶囊壳模具在烘箱70 ℃预热、蘸胶、干燥后拔壳。
将制备空心硬胶囊壳,按照《中华人民共和国药典》(2015版)[26],对制备的药用胶囊在外观、胶囊体胶囊帽的松紧度、脆碎度、干燥质量损失、灼烧残渣检测。
1.4 数据处理
实验测定均平行3 次,以 ±s表示。图像处理采用Excel软件,数据统计分析采用SPSS 19.0软件,并进行Duncan多重比较。
2 结果与分析
2.1 玉米醇溶蛋白提取试剂的确定
分别采用不同体积分数的乙醇溶液提取玉米醇溶蛋白得到的氨基酸组分含量略有差异。目前玉米醇溶蛋白的提取,主要考虑总蛋白的得率,本实验玉米醇溶蛋白的提取为后期糖基化提供氨基供体,因此应选择赖氨酸含量高的作为提取试剂。
2.1.1 玉米醇溶蛋白氨基酸组成分析
分别采用不同体积分数乙醇溶液提取玉米醇溶蛋白,其氨基酸的组成及相对含量如表2所示。不同体积分数乙醇溶液提取的玉米醇溶蛋白,其氨基酸组成没有差异,但氨基酸含量有差别,整体上非极性氨基酸含量较高,与文献[27]一致。另外70%乙醇溶液提取的玉米醇溶蛋白中赖氨酸含量高于其他提取,蛋白质糖基化反应主要是蛋白质中的赖氨酸和精氨酸与糖中的羧基发生化学反应,生成酰胺化合物。因此玉米醇溶蛋白中赖氨酸和精氨酸含量高将有利于蛋白质糖基化反应的发生。本研究将重点考察体积分数60%和70%乙醇溶液提取玉米醇溶蛋白,并进行实验。

表2 玉米醇溶蛋白氨基酸组成Table2 Amino acid composition of zein
2.1.2 玉米醇溶蛋白的SDS-PAGE分析
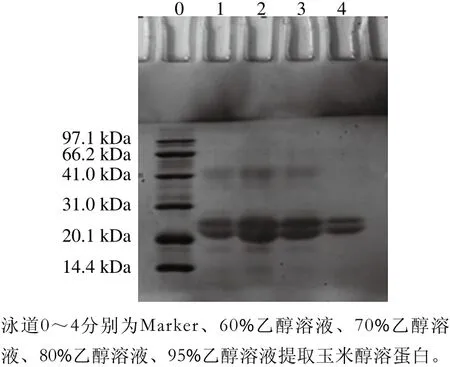
图1 玉米醇溶蛋白组分电泳图Fig.1 SDS-PAGE profiles of zein components
由图1可知,体积分数60%、70%、80%乙醇溶液提取玉米醇溶蛋白的电泳谱带中均出现2 条清晰条带,且位置基本相同,分别位于22 kDa和27 kDa,说明所得组分基本一致。体积分数95%乙醇溶液提取的玉米醇溶蛋白仅在27 kDa位置出现一条细的条带,说明体积分数95%乙醇溶液提取的玉米醇溶蛋白组分与其他乙醇溶液提取出来的组分不一样。体积分数70%较80%乙醇溶液提取醇溶蛋白的条带颜色较深、条带粗,与体积分数60%、95%乙醇溶液的提取物相比,其组分的含量也高。综合考虑,本实验采用体积分数70%乙醇溶液提取玉米醇溶蛋白,并进行后面的实验。
2.2 最佳改性成膜工艺确定
2.2.1 改性蛋白成膜工艺物料比的确定
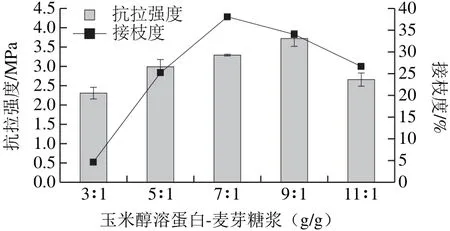
图2 不同物料比对改性后膜抗拉强度和接枝度的影响Fig.2 Effect of diff erent ratios between ingredients on tensile strength and degree of graft of films
配制质量分数8%的玉米醇溶蛋白溶液,调整pH 9的反应体系,功率400 W超声10 min,水浴70 ℃,30 min条件下,进行糖基化反应,并制备成膜,考察不同玉米醇溶蛋白和麦芽糖浆的物料质量比(g/g)对接枝度和对膜抗拉强度的影响,如图2所示。湿法糖基化玉米醇溶蛋白产物玉米醇溶蛋白-麦芽糖浆的接枝度随着玉米醇溶蛋白与麦芽糖浆间的物料比增加呈现先增大后减小的趋势,当物料比7∶1时达到最高值,继续增加物料比接枝度开始下降。当物料比小时,也就是玉米醇溶蛋白的添加相对较少,麦芽糖浆添加量相对较多,麦芽糖浆与玉米醇溶蛋白间的空间位阻增大,反应物的分子碰撞几率减少,对其接枝反应不利。随着玉米醇溶蛋白的添加量的逐渐增加,糖和蛋白分子的接触几率增加,接枝度也越来越大,当接枝度达到最高值,继续增加物料比,接枝度开始呈现下降趋势,可能是因为部分玉米醇溶蛋白将麦芽糖浆的作用位点包埋住,致使部分玉米醇溶蛋白的作用位点未能与麦芽糖浆发生有效的碰撞接触,不利于糖基化反应,使糖基化反应不够彻底。
蛋白和糖的分子间的共价键合是在一定的基团间进行的,为了得到具有一定抗拉强度的膜,要求采用合适的氨基与羰基供体物配比,实现最佳比例的反应[28]。由图2可知,抗拉强度随着玉米醇溶蛋白与麦芽糖浆间的物料比增加同样呈现先增大后减小的趋势,当物料比9∶1时达到最高值,继续增加物料比,抗拉强度开始下降。抗拉强度越大表现出制成的膜柔韧性越好,脆性越低。在糖基化改性过程中,由于蛋白质与小分子的还原糖发生反应,可使蛋白质分子发生一定程度的伸展,促使蛋白分子成膜时疏水基团和巯基交联,可以增加膜的机械性能。然而当物料比11∶1,由于接枝度下降,蛋白质的交联不够,因此膜的机械性能改善不够。本研究的最终目的是通过改性提高膜的机械性能,因此选择物料比9∶1。
2.2.2 改性蛋白成膜工艺中pH值的确定
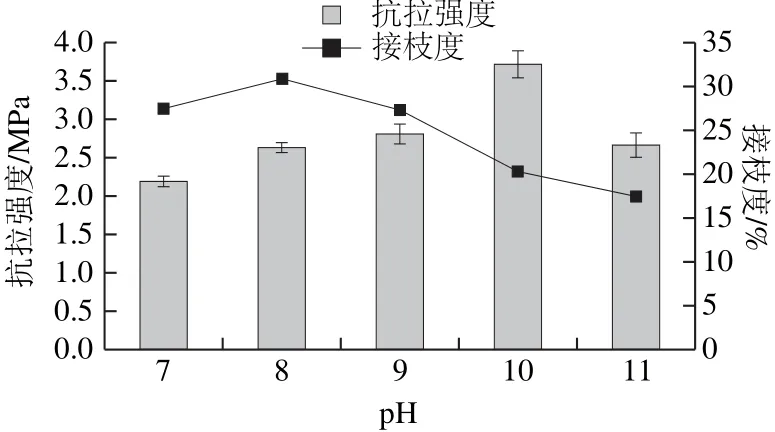
图3 不同pH值对改性蛋白膜接枝度和抗拉强度的影响Fig.3 Effect of different pH values on tensile strength and degree of graft of films
配制质量分数8%的玉米醇溶蛋白溶液,按照玉米醇溶蛋白-麦芽糖浆的物料质量比(g/g)9∶1,在功率400 W条件下超声10 min,水浴70 ℃,30 min进行糖基化反应,考察在玉米醇溶蛋白-麦芽糖浆体系中,不同pH值对接枝度与对膜抗拉强度的影响,如图3所示。湿法糖基化体系中过高的pH值可以引发蛋白质的变性,在较低的pH值条件下,反应并不充分[29]。因为湿法糖基化反应的本质是碱催化的反应,所以在碱性条件下更有利于玉米醇溶蛋白与麦芽糖浆进行接枝反应,本研究设定的体系pH值范围取7~11。
玉米醇溶蛋白-麦芽糖浆的接枝度变化范围均在15%~30%左右之间。玉米醇溶蛋白-麦芽糖浆反应体系pH值越高,接枝度越低。在pH值达到10以后接枝度都呈下降趋势。这是因为当反应体系的碱性过强时,氨基酸就会发生胱赖反应,产生有毒化合物,不利于玉米醇溶蛋白与麦芽糖浆接枝反应的进行[28]。
玉米醇溶蛋白-麦芽糖浆膜的抗拉强度变化趋势相同,即呈现起初随pH值增加而增加,达到最高点又开始下降。其中玉米醇溶蛋白-麦芽糖浆膜在pH 10时达到最佳的抗拉强度。
2.2.3 改性蛋白成膜工艺中超声功率的确定
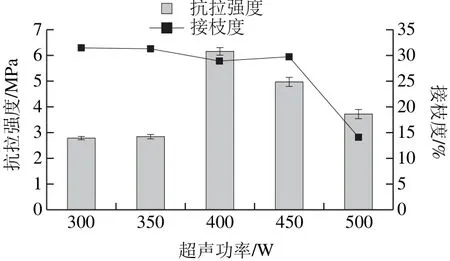
图4 超声功率对改性蛋白膜接枝度和抗拉强度的影响Fig.4 Effect of different ultrasonic powers on tensile strength and degree of graft of films
配制质量分数8%的玉米醇溶蛋白溶液,按照物料质量比(g/g)玉米醇溶蛋白-麦芽糖浆为9∶1混合,调整玉米醇溶蛋白-麦芽糖浆反应体系pH 9,超声反应10 min后,糖基化加热70 ℃反应30 min条件下,考察不同超声功率对接枝度与对膜抗拉强度的影响,如图4所示。超声功率在300~450 W之间,玉米醇溶蛋白-麦芽糖浆的接枝度变化不明显,趋于稳定。说明适当的超声功率,一方面会提高玉米醇溶蛋白在70%乙醇溶液中的溶解性,另一方面会使游离氨基酸的含量增加,促进该反应的进行。当超声功率增大时,在溶液中形成更高频率的振荡,蛋白质分子的一级空间结构受到破坏,致使肽键断裂,游离氨基数量增多,导致N-末端残基数目过度增多,自由氨基也过度增多,麦芽糖浆与赖氨酸的碰撞几率变小,导致了玉米醇溶蛋白的接枝度下降;当超声功率过高,会致使溶液的局部温度过高,加剧了反应体系溶液中麦芽糖浆自身发生焦糖化的反应,体系褐变程度升高[29]。对于抗拉强度,玉米醇溶蛋白-麦芽糖浆的变化趋势与接枝度的变化趋势类似,过高的功率不适合膜机械性能的改变,与文献[30]一致。综上所述,糖基化反应的最佳超声功率是400 W。
2.2.4 改性蛋白成膜工艺中加热时间的确定

图5 糖基化加热时间对改性蛋白膜接枝度和抗拉强度的影响Fig.5 Effect of different heating times on tensile strength and degree of graft of films
配制质量分数8%的玉米醇溶蛋白溶液,按照玉米醇溶蛋白-麦芽糖浆的物料质量比9∶1,玉米醇溶蛋白-麦芽糖浆反应体系pH 9,在超声功率400 W条件下作用10 min以后,考察不同糖基化加热时间对接枝度与对膜抗拉强度的影响,如图5所示。在玉米醇溶蛋白-麦芽糖浆糖基化反应过程中,其接枝度随加热时间的延长而增加,玉米醇溶蛋白-麦芽糖浆膜的抗拉强度的变化规律随着加热时间的延长,呈现逐步上升的趋势,在45~60 min趋于平稳,继续延长反应时间,抗拉强度下降。这是因为蛋白质与多糖的反应中,随着加热时间的延长,蛋白质结构部分展开,多糖与蛋白质受热逐步结合,促进蛋白质球状分子伸展,疏水基团暴露[31]。但是随着加热时间的延长,一方面使糖浆中的还原性羰基与蛋白质中的赖氨酸结合,另一方面造成了蛋白质结构的伸展,增加了蛋白质分子的相互作用,导致凝聚和沉淀,成膜性下降,而且随着时间的延长,混合样品的颜色由浅变深。因此,在该反应条件下,玉米醇溶蛋白-麦芽糖浆反应时间为45 min。
2.2.5 正交试验设计与结果
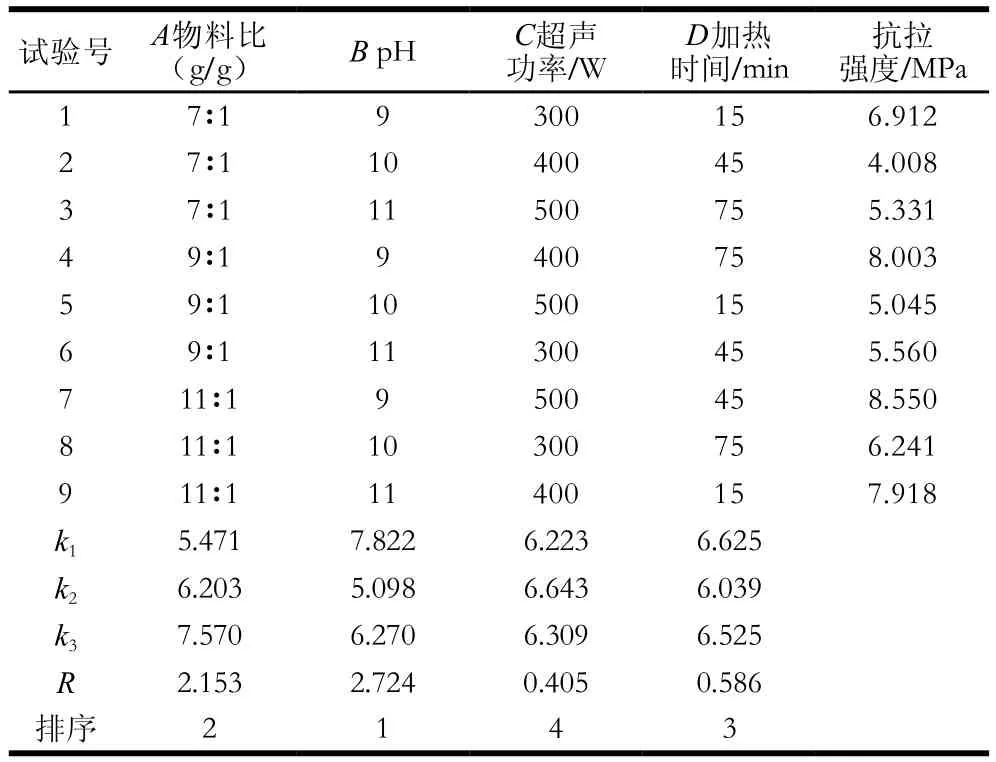
表3 正交试验设计及结果Table3 Orthogonal array design with analysis of experimental results
由表3可知,各因素对改性玉米醇溶蛋白膜的抗拉强度影响程度依次为pH值>物料比>加热时间>超声功率,最佳工艺条件为物料比11∶1、pH 9、超声功率400 W、加热时间15 min,经验证实验此时,接枝度为34.96%,抗拉强度为9.22 MPa,约为未改性玉米醇溶蛋白膜(4.2 MPa)的2 倍。
2.3 玉米醇溶蛋白和玉米醇溶蛋白-麦芽糖浆的SDSPAGE分析
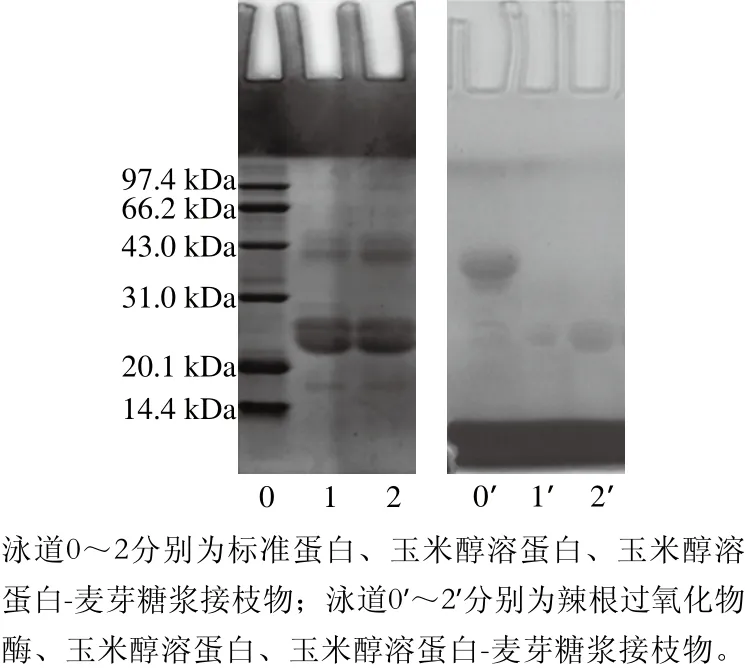
图6 SDS-PAGE考马斯亮蓝和糖蛋白染色图Fig.6 SDS-PAGE profiles of the samples stained for proteins and glycosylated proteins
如图6所示,Marker分别为14 400~97 400 Da的低分子质量标准蛋白和辣根过氧化物酶。由图6可知,考马斯亮蓝染色测定改性后产物玉米醇溶蛋白-麦芽糖浆的分子质量变化不明显,这是因为麦芽糖浆属于小分子糖,因此,反应后的接枝产物分子质量变化不明显。以辣根过氧化物酶作为阳性对照,采用高碘酸希尔法与接枝物中糖分子进行颜色反应,从而检测糖分子的存在,结果表明糖蛋白染色显示红色条带,说明糖基化样品中糖基的存在,确认玉米醇溶蛋白中导入了糖分子,证明麦芽糖浆与玉米醇溶蛋白发生了糖基化反应,生成了蛋白质和糖的交联产物。
2.4 胶囊壳的制备
经过溶胶、蘸胶制备胶囊壳,按照《中华人民共和国药典》(2015版)[26],对制备的药用胶囊在外观、胶囊体胶囊帽的松紧度、脆碎度、干燥质量损失、灼烧残渣检测结果如图7和表4所示。

图7 制备的胶囊壳Fig.7 Visual appearance of capsule shells
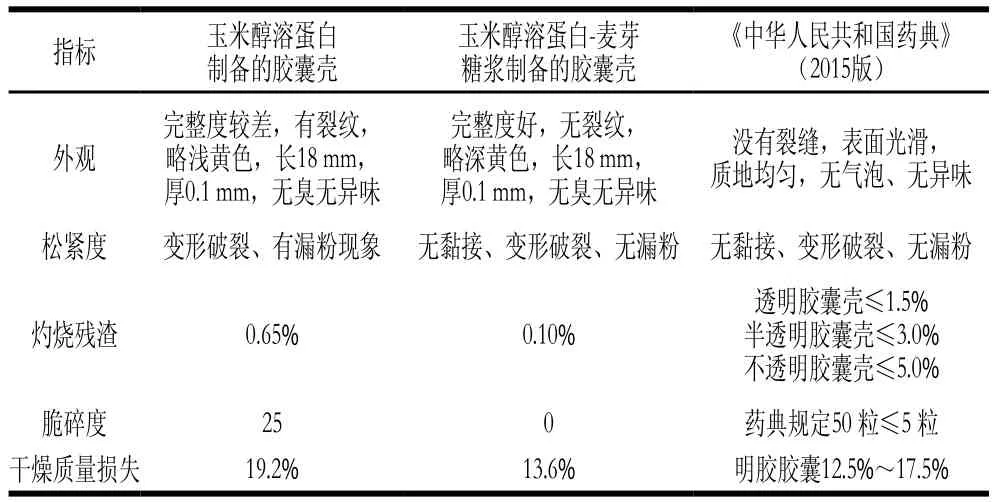
表4 检测指标Table4 Physicochemical parameters of capsule shells
由玉米醇溶蛋白和麦芽糖浆-玉米醇溶蛋白制备的2 种胶囊壳,其中玉米醇溶蛋白胶囊壳,由于脆性较大,胶囊壳从模具上退下的时候不完整,会有裂痕,外观不合格。而玉米醇溶蛋白-麦芽糖浆制备胶囊壳的各项检测结果都符合国家药典标准,没有裂缝,无漏粉现象,表面光滑,质地均匀,没有气泡。其松紧度、脆碎度和干燥质量损失均合格。
3 结 论
关于提高玉米醇溶蛋白膜的抗拉强度,目前文献主要是采用添加增塑剂和交联剂的方法,虽然提高了玉米醇溶蛋白膜的抗拉强度,但是增塑剂和交联剂不能用于食品和药品。本研究的胶囊壳生产原料均是食品级,无化学残留,糖基化羰基的供给原料为麦芽糖浆,其本身也是天然甜味剂,因此可作为保健食品或药品的胶囊壳材料。本研究证明以玉米醇溶蛋白和麦芽糖浆为原料,通过湿法糖基化改性可显著改善玉米醇溶蛋白膜的机械性能,适合制备胶囊壳,替代明胶胶囊。
与传统明胶胶囊壳作对照,本实验说明采用糖基化的方式可有效地改善其机械性能,适当的交联可提高膜的抗拉强度,该强度适合制备植物蛋白胶囊壳。
