应用简并PCR方法检测转cry1A基因作物
2018-07-24李葱葱董立明龙丽坤李飞武
李葱葱,闫 伟,夏 蔚,董立明,龙丽坤,李飞武*
(吉林省农业科学院农业质量标准与检测技术研究所,吉林 长春 130033)
尽管转基因作物在全球已推广应用超过20 a,且种植面积和产生的经济社会效益逐年增长,社会公众对转基因技术及其产品的安全性仍然存在疑虑[1]。鉴于此,许多国家和地区制定了相应的法律法规,对转基因作物及其产品实施严格的标识监管政策,并设定了相应的标识阈值,欧盟和俄罗斯为0.9%,新西兰、巴西为1%,日本、印尼、泰国为5%[2]。对某一产品的监管内容主要包括是否含有转基因成分、特定转基因成分的含量是多少、是否超过标识阈值等,因此,建立转基因成分特异、灵敏的检测方法,是保障安全监管政策法规有效实施的技术支撑。
聚合酶链式反应(polymerase chain reaction,PCR)是当前国内外应用最为广泛的转基因作物成分检测技术,许多学者利用常规PCR[3]、多重PCR[4-5]、实时荧光定量PCR[6-7]、数字PCR[8-9]等方法建立了一系列转基因成分精准检测方法。检测靶标包括启动子、终止子等通用调控元件、外源目的基因、载体构建序列、转基因作物转化体特异性序列等[10-14]。转基因成分检测的一般流程是先开展针对常见调控元件或外源基因的筛选检测,若发现含有转基因成分,再进行转化体身份确定。
cry1A基因是一类抗虫基因的总称,包括cry1Ab、cry1Ac、cry1A.105、mcry1Ac、cry1Ab/Ac等,是抗虫转基因作物中使用频次最高的外源基因,在已商业化的49 个抗虫转基因作物转化体中有32个含有cry1A基因,占65.3%。此外,我国自主研发的抗虫转基因玉米、水稻、棉花的靶标基因以cry1A居多,可见,cry1A基因在转基因检测工作中可作为一种具有广泛代表性的靶标。国内外报道了cry1A基因的一系列PCR检测方法,用于检测Bt11玉米、Bt176玉米、TT51-1水稻等转基因作物,其中有些方法已转化为欧盟标准或我国的行业标准[15-31]。但是,由于转基因作物研发者往往会对cry1A基因进行序列改造或密码子修饰,导致不同转化体中的同一类型的cry1A基因在核苷酸序列上也有较大变异,而上述cry1A基因检测方法建立时仅在部分转化体进行了验证,其是否适用于其他转cry1A基因作物还不得而知,存在假阴性风险。
本研究拟采用序列比对分析方法,对已报道的cry1A基因PCR检测方法进行评价,在此基础上,根据不同转基因作物中cry1A基因的保守区序列,开发一种可对已知转cry1A基因作物进行全覆盖的筛选检测方法,为此类转基因作物的监管和检测提供一种新的技术手段。
1 材料与方法
1.1 材料与试剂
转cry1Ab基因玉米MON810、Bt11、Bt176、C0030.3.5、双抗12-5;转cry1A.105和cry2Ab基因玉米MON89034;转mcry1Ac基因玉米Bt506;转cry1Ab/Ac基因水稻TT51-1;转cry1Ac基因大豆MON87701;转cry1Ac基因棉花MON531、MON15985;其他转基因玉米混合样品(转cry3Bb基因玉米MON863、转cry1F基因玉米TC1507、转cry3A基因玉米MIR604、转vip3Aa基因玉米MIR162、转cry34Ab和cry35Ab玉米59122、转CP4-EPSPS基因玉米NK603);非转基因玉米样品;非转基因大豆水稻混合样品。以上样品均由本实验室收集保存。
植物基因组DNA提取试剂盒(离心柱型) 北京天根生物技术有限公司;HS Taq DNA聚合酶、dNTPs等PCR试剂 大连宝生物工程有限公司;其他生化试剂(均为分析纯) 北京鼎国生物科技公司。
1.2 仪器与设备
C1000型梯度PCR仪、GelDoc XR+凝胶成像系统美国Bio-Rad公司;ND1000核酸微量分析仪 美国Thermo Fisher公司。
1.3 方法
1.3.1 基因组DNA提取
将所有样品研磨成粉末,按照北京天根公司的植物基因组DNA提取试剂盒操作说明书,提取样品基因组DNA,用核酸微量分析仪测定DNA质量和浓度,用1×TE缓冲液将纯化的DNA溶液稀释至25 mg/L,4 ℃冷藏保存备用。
1.3.2 序列比对
通过查询网络数据库、国内外专利、科技论文等方式,收集不同转基因作物中的cry1A基因序列及已报道的cry1A基因检测方法所使用的引物序列,利用Vector NTI Advance 11.5软件(美国Thermo Fisher公司)进行序列比对分析。
1.3.3 引物设计
以转基因作物中cry1A基因的相对保守序列为模板,利用Primer premier 5.0软件进行引物设计。由于cry1A基因的序列差异较大,很难在不同基因序列中找寻到完全一致的引物结合位点,为提高检测体系的覆盖度,本研究采用简并引物策略,筛选出1对cry1A基因PCR检测引物,cry1A-F:5’-ACCGGYTACACYCCCATCGACATC-3’;cry1A-R:5’-GGCGSWGTTCATGTCGTTGAA-3’,扩增产物大小为330 bp。引物由上海生工有限公司合成,用1×TE缓冲液稀释至10 μmol/L的工作液。
1.3.4 简并PCR
优化后的PCR体系包括:10×PCR buffer 2.5 μL、10 mmol/L dNTPs混合溶液2 μL、10 μmol/L上下游引物各0.5 μL、HS Taq DNA聚合酶1 U、DNA模板100 ng,用ddH2O补齐至25 μL。优化后的PCR扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,进行35 个循环;72 ℃延伸7 min;4 ℃保存。PCR扩增结束后,取10 μL扩增产物用2%的琼脂糖凝胶进行电泳分析。
2 结果与分析
2.1 序列比对分析
根据转基因作物商业化应用数据库(http://www.isaaa.org/gmapprovaldatabase)的统计,有32 个已商业化种植的转化体使用cry1A基因作为目的基因,还有一批转化体处于研发过程中。本研究共收集到转基因玉米MON810、C0030.3.5、Bt176、SK12-5、Bt11、MON89034、Bt506、转基因水稻TT51-1、转基因大豆MON87701、转基因棉花MON15985、MON531共11 种转cry1A基因作物材料,并获得了对应的cry1A基因序列信息,见表1。
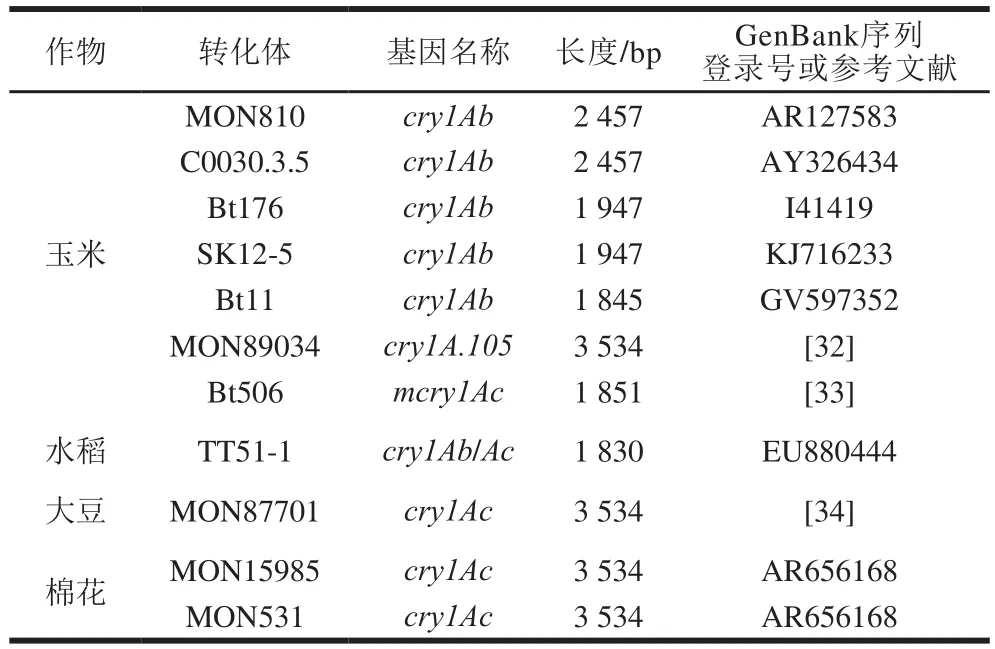
表1 转基因作物中cry1A基因基本信息Table1 Information about cry1A genes used in transgenic crops
对获得的cry1A基因序列进行比对分析,发现部分基因序列间的同源性非常高,如:Bt176和SK12-5的cry1Ab基因仅有2 个碱基差异,MON810和C0030.3.5的cry1Ab基因仅有1 个碱基差异,MON531和MON15985的cry1Ac基因序列完全一致,且与MON87701仅1 个碱基差异,但11 个cry1A基因整体的同源性较差,仅为59.3%。从5’端向3’端逐段扫描未发现连续15 个以上的一致性碱基,表明采用特定引物序列同时检测这些cry1A基因是很难实现的,需采取简并引物策略。
2.2 已报道的cry1A基因检测方法评价
从转基因生物检测方法数据库(http://gmdd.sjtu.edu.cn)中检索到cry1A基因的21 种不同检测方法,标注为M1~M20,其中普通PCR方法15 种、实时荧光PCR方法6 种,这些方法中有5 种已转化为行业标准或国家标准,每种方法使用的引物及其他信息见表2。将这些方法的引物与上述cry1A基因序列进行比对,结果显示没有1 种方法的引物序列能够同时与11 个cry1A基因序列完全配对,每对引物的错配碱基数均大于3 个,且许多错配发生在引物的3’端。此外,部分方法的引物序列在有的基因上没有结合位点,如:M3、M7和M12方法的上游引物在TT51-1水稻的cry1Ab/Ac基因无结合位点,M15方法的上游引物在MON89034玉米的cry1A.105基因无结合位点,M18和M20方法的上下游引物仅能与cry1Ac基因匹配,而与cry1Ab和cry1A.105不能匹配。上述序列比对分析结果表明,文献报道的这些cry1A基因检测方法理论上仅适用于特定靶标基因,不能用于表1中所列11种cry1A基因的高效筛查。
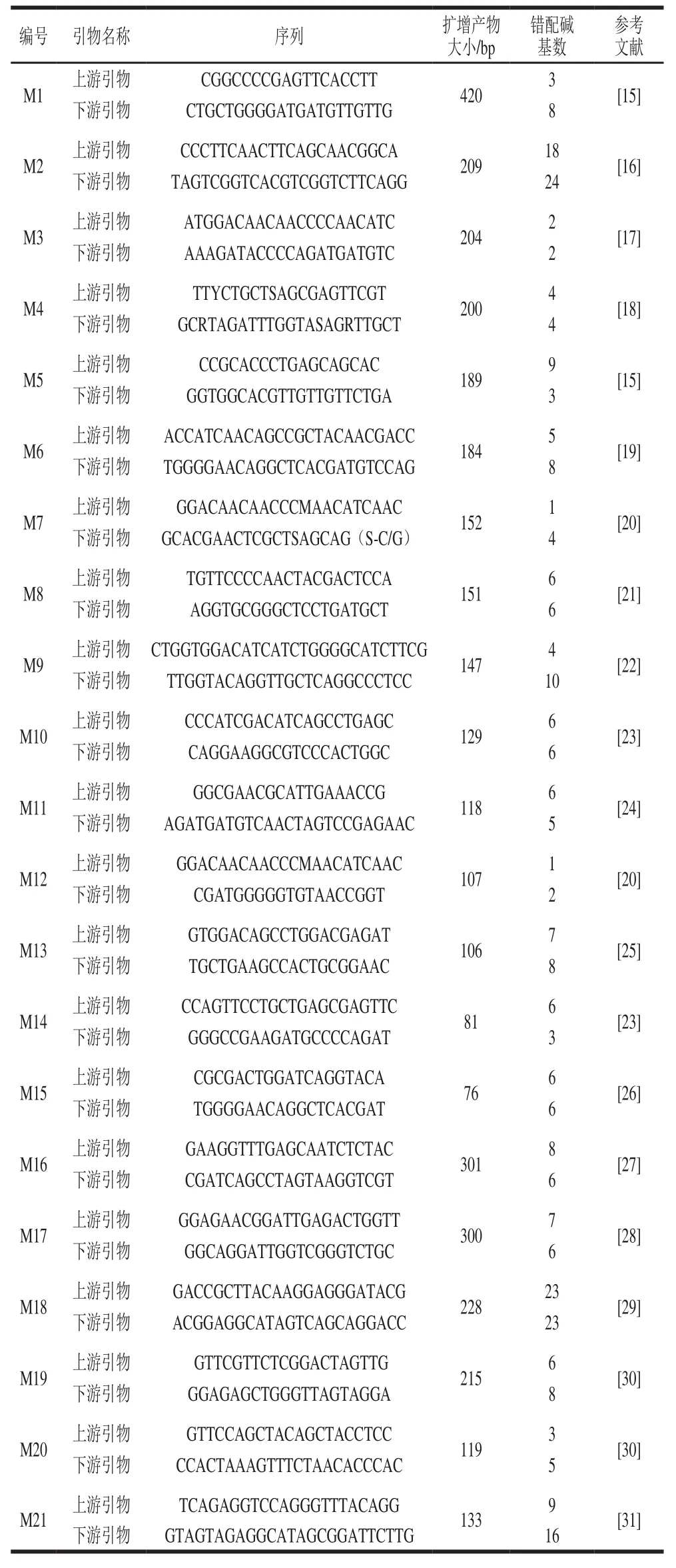
表2 已报道的cry1A基因PCR检测方法Table2 Reported PCR primers for detecting cry1A genes
2.3 cry1A基因简并PCR引物设计
尽管11 个cry1A基因整体的同源性不足60%,但5’端序列表现出较好的同源性,选取了5’端1~600 位碱基序列作为模板,应用Primer Premier V5.0软件筛选到1 对适用于PCR扩增的简并引物,上、下游引物各有2 个简并碱基,见图1的下划线部分,扩增产物大小为330 bp。
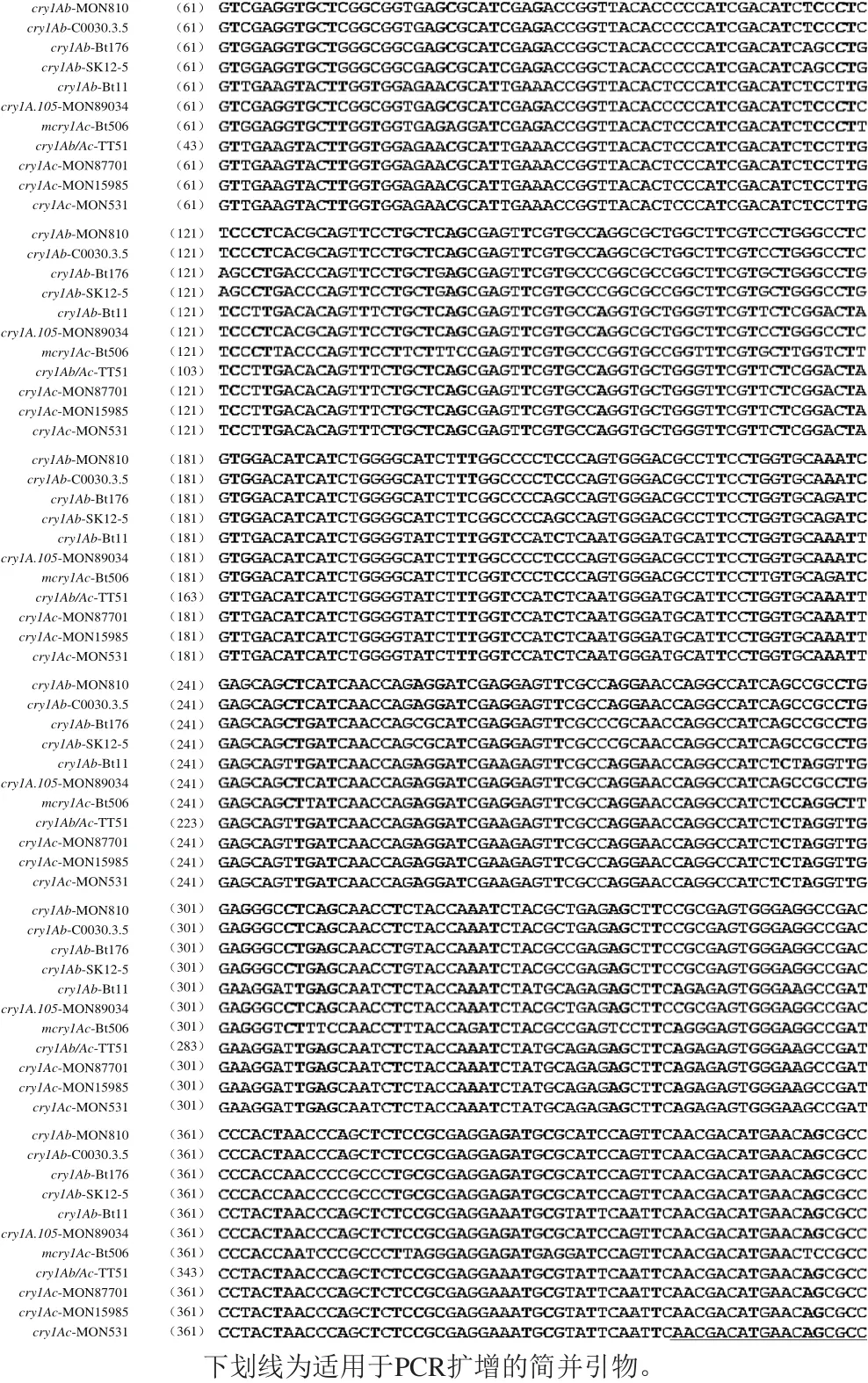
图1 cry1A基因序列比对结果及引物结合位点Fig.1 Alignment of nucleotide sequences and primer-binding sites for cry1A genes
2.4 简并PCR体系的特异性分析
以1.1节所列的转基因作物及非转基因作物为检测对象,测试cry1A基因简并PCR体系的特异性。扩增结果表明,仅从含有cry1A基因的MON810、MON89034、Bt11、Bt176、Bt506、C0030.3.5、SK12-5、TT51-1、MON87701、MON531、MON15985样品中获得预期330 bp的特异性PCR产物,而在转其他基因玉米及非转基因作物中均未扩增出该产物(图2),表明建立的cry1A基因简并PCR方法能够特异性地用于11 种cry1A基因作物的筛选检测,可对目前已知的cry1Ab、cry1Ac、cry1Ab/Ac、cry1A.105和mcry1Ac等cry1A类基因进行高效筛查。
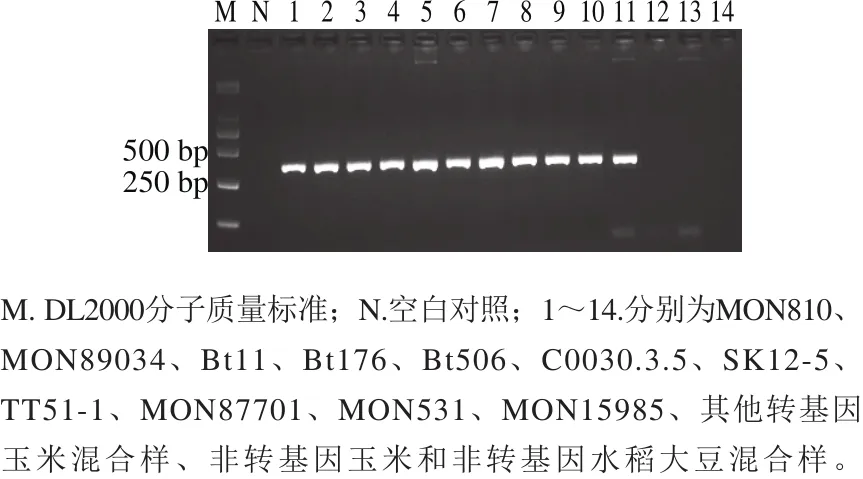
图2 cry1A基因PCR方法的特异性测试结果Fig.2 Specif i city of the PCR assay
2.5 简并PCR体系的灵敏度分析
选取转cry1Ab基因玉米MON810为检测对象,将MON810玉米粉与非转基因玉米粉按质量比混合配制成MON810质量分数分别为1%、0.5%、0.1%、0.05%、0.01%、0.005%的梯度样品,提取基因组DNA,进行cry1A基因的PCR扩增。结果显示,利用本方法可从MON810玉米质量分数为0.01%以上(含0.01%)的样品中稳定扩增出预期DNA片段,而在0.005%的样品中未得到扩增,表明本方法对MON810玉米的检测灵敏度可达到0.01%(图3)。
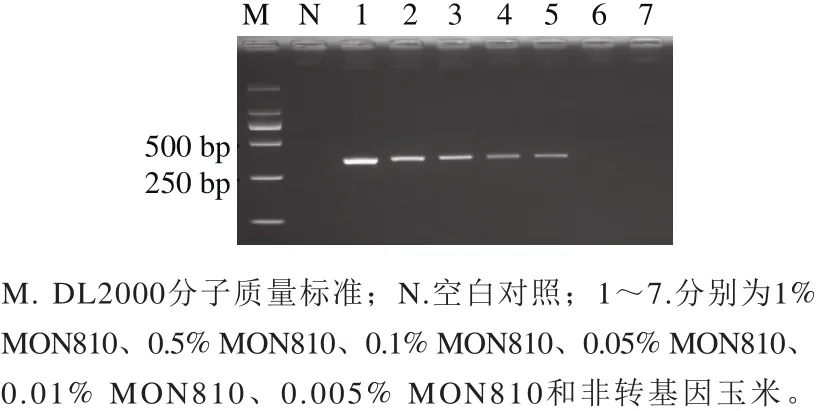
图3 cry1A基因PCR方法的灵敏度测试结果Fig.3 Sensitivity of the PCR assay
在使用普通PCR进行转基因成分定性检测时,一般要求方法的检测限应稳定达到0.1%。根据国际公认的检测限判定程序,随机称取60 份MON810质量分数为0.1%的玉米样品,提取基因组DNA,用cry1A基因简并PCR方法进行扩增。如图4所示,60 份试样中均能稳定扩增出与预期大小一致的PCR产物,表明本方法的检测限可达0.1%,适用于对cry1A基因的高灵敏检测。
为进一步测试本方法对其他转cry1A基因作物的检测灵敏度,以非转基因玉米、大豆、水稻等量混合物为填充物,制备了9 份测试样品,用cry1A基因简并PCR方法进行扩增。如图5所示,无论是在cry1A基因含量为0.1%的Bt11、MON89034、TT51、MON531、MON87701单一转基因成分样品,还是在Bt11/MON87701、TT51/MON531、Bt11/MON531、MON89034/TT51混合样品中,均能获得与预期大小一致的特异性扩增产物,表明本方法对不同组分的转cry1A基因作物均能进行很好地筛查。

图4 cry1A基因PCR方法的检测限测试结果Fig.4 Determination of the limit of detection (LOD) of the PCR assay
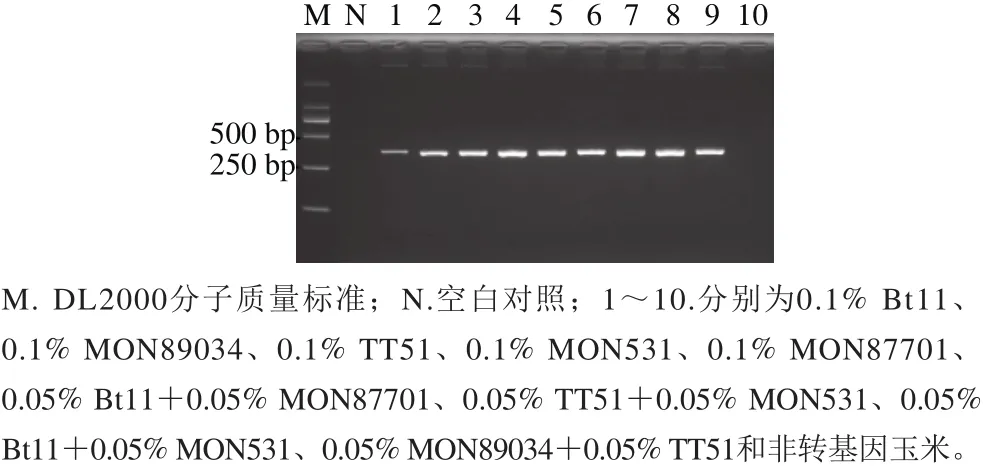
图5 cry1A基因PCR方法的检测限验证结果Fig.5 Validation of the LOD of the PCR assay
2.6 简并PCR体系的稳定性测试

图6 cry1A基因PCR方法退火温度的稳定性测试Fig.6 Stability of the PCR assay at different annealing temperatures
为评价退火温度和引物用量波动对方法稳定性的影响,选取MON810、MON89034、Bt11等9 个样品,对5 种退火温度和3 种引物终浓度进行测试。结果显示,当引物终浓度设定为0.2 µmol/L,退火温度分别为56、58、60、62 ℃和64 ℃时,均能从转cry1A基因作物中扩增出预期DNA片段,而在阴性对照和空白对照中未获得该扩增产物(图6)。当退火温度设定为60 ℃,引物终浓度分别为0.1、0.2 µmol/L和0.3 µmol/L时,同样能够获得与预期一致的结果(图7)。表明本方法在退火温度和引物用量发生一定程度的波动时,也能保持很好的稳定性。

图7 cry1A基因PCR方法引物用量的稳定性测试Fig.7 Stability of the PCR assay at different dosages of primers
3 结 论
cry1A基因是当前商业化应用的抗虫转基因作物中最常见的外源目的基因,而且,从近年来全国转基因作物监测的情况来看,转cry1A基因作物的扩散风险较高,是监管的重中之重。因此,建立具有广泛适用性的cry1A基因定性PCR检测方法,对于完善我国转基因作物检测手段具有十分重要的意义。
由于不同作物的密码子偏好性差异,科学家们在作物遗传改良时常常会对目的基因的核苷酸序列进行修改,导致不同转基因作物中的同一种cry1A基因序列存在较大差异,给检测方法研究带来一些挑战,有时需针对一种靶标基因建立多种方法以确保覆盖度,增加了检测工作量。应用简并PCR策略能在一定程度上解决这一问题,若多个基因序列的某一段区域呈现较高的一致性时,可利用1 对简并引物实现对多个靶标基因的筛选检测。
本研究在系统比较分析11 种转基因作物中的cry1A基因序列基础上,筛选出具有通用性的cry1A基因简并引物,并经过特异性、灵敏度、检测限、稳定性测试,建立cry1A基因简并PCR方法。该方法可对11 种常见转cry1A基因作物进行全覆盖检测,方法的灵敏度稳定达到0.1%,为转基因作物的筛选检测提供了一种高效的技术手段。
