丙二醛、视黄醇与多囊卵巢综合征发病机制关系的探索
2018-07-24王虎生阮祥燕李扬璐程姣姣谷牧青金凤羽AlfredMueck
王虎生 阮祥燕,2* 李扬璐 程姣姣 谷牧青 杜 娟 金凤羽 Alfred O. Mueck,2
(1.首都医科大学附属北京妇产医院妇科内分泌科,北京 100026;2. 德国图宾根大学妇产医院妇女健康部与妇女健康研究中心, 图宾根 D-72076,德国)
多囊卵巢综合征 (polycystic ovary syndrome, PCOS) 又称 Stein-Leventhal 综合征,由 Stein 和 Leventhal[1]于 1935 年首次报道,在育龄妇女中,其患病率约为 5% ~ 10%[2],根据2003 年鹿特丹诊断标准[3],全球PCOS患病率为6%~21%[4],是育龄期女性无排卵性不孕的最常见病因。以雄激素过高的临床或生物化学表现、稀发排卵或持续无排卵、卵巢多囊改变为特征,常伴有胰岛素抵抗、肥胖、血脂紊乱等代谢异常,是常见的生殖内分泌代谢性疾病,严重影响患者的生命质量、生育及远期健康[5]。
PCOS的病因和发病机制尚不十分清楚,可能是由于某些遗传基因与环境因素相互作用所致。PCOS患者体内存在氧化应激(oxidative stress, OS),OS会破坏卵泡的正常结构和功能,但具体发病机制尚不清楚。目前鲜有对多种氧化应激指标的共同研究,本研究比较了PCOS患者与对照组各氧化应激指标,深入研究PCOS氧化应激指标丙二醛(malondialdehyde, MDA)、视黄醇(retinol, RET) 与内分泌代谢指标的关系,将有利于进一步探索PCOS的发病机制,协助PCOS的诊断、早期预防及临床治疗。
1 对象与方法
1. 1 研究对象
本研究选取2017年7月至10月就诊于首都医科大学附属北京妇产医院内分泌科被确诊为PCOS的患者65例作为研究组,年龄21~40岁。同时选取因女方输卵管因素或男方因素而不孕或正常体检的健康育龄女性24例作为对照组。所有患者均充分知情并自愿参加本研究。排除标准:①所有患者三个月内均无激素类药物治疗史;②心肝肾功能正常;③排除妊娠;④既往未服用降糖药物、降压药物、抗血小板聚集药物等任何可能影响机体氧化应激状态的药物。纳入标准参照鹿特丹诊断标准[3]。
1. 2 PCOS诊断标准
依据 2003 年美国生殖医学会(American Society for Reproductive Medicine, ASRM) 和欧洲人类生殖与胚胎学会(European Society of Human Reproductive and Embryology, ESHRE) 提出的 PCOS 鹿特丹诊断标准[3]:① 稀发排卵或无排卵(oligo-anovulation, OA); ②高雄激素血症(hyperandrogenism, HA) 或高雄激素的临床表现(如多毛、痤疮等)。③卵巢多囊样改变(polycystic ovary, PCO),即单侧卵巢内直径 2~ 9 mm 的卵泡≥12个或卵巢体积>10 mL。上述3条中符合2条即诊断为 PCOS。同时需排除高泌乳素血症、甲状腺疾病、分泌雄激素肿瘤、非典型先天性肾上腺增生、库欣综合征等其他引起内分泌紊乱的相关性疾病。
1. 3 测量指标
1)一般指标: 年龄、身高、体质量、体质量指数 (body mass index, BMI)=体 质 量(kg) /身高2(m2)。
2) 内分泌代谢指标: 卵泡刺激素(follicle stimulating hormone, FSH)、黄体生成素(luteinizing hormone, LH)、 睾酮(testosterone, TT)、 抗苗勒管激素 (anti-Müllerian hormone, AMH)、抑制素B(inhibin B, INHB)、空腹胰岛素(fasting insulin,FINS)、空腹血糖(fasting blood glucose,FBG)。稳态胰岛素指数(homeostasis model assessment insulin resistance,HOMA-IR)=FBG(mmol·L-1)×FINS(mIU·L-1)/22.5,HOMA-IR 反映胰岛素抵抗情况。采血时间:月经规律者取月经第 3 ~ 5 天,无规律者或闭经者任意时间。
3)血清学指标的测定:患者均充分睡眠,于早晨8∶00 ~ 10∶00 空腹肘静脉采血。内分泌代谢指标的测定采用美国拜耳公司生产的 Centaur 全自动化学发光免疫分析仪,其中AMH通过酶联免疫吸附试验(enzyme-linked immuno sorbent assay, ELISA) 试剂盒测定,批内及批间误差分别为 3.3% 和 6.7%。血清 INHB 通过 ELISA 试剂盒测定,批内及批间差异分别为 4.52% 及 3.91%。另抽取静脉血2 mL,于室温状态下静置10~20 min,使血液自然凝固。然后将样本以3 000 r/min的速度离心约10 min,仔细收集上层血清,暂冻存于-20 ℃低温冰箱中。
4) 氧化应激指标测定:通过南京建成生物工程研究所试剂盒比色法测定总抗氧化活性(total antioxidant activity,TAA)、超氧化物歧化酶(superoxide dismutase, SOD)、MDA、氧化型谷胱甘肽(oxidized glutathione, Glut oxyd,)、维生素E(vitamin E, VE)、维生素C(vitamin C,VC),武汉优尔生试剂盒ELISA法测定RET。
1. 4 统计学方法

2 结果
2.1 PCOS组与对照组人体测量学和内分泌代谢指标
PCOS组患者的年龄、身高、体质量、BMI、腰围、臀围、FSH、血清INHB浓度、FBG与对照组组间差异均无统计学意义(P>0.05);PCOS组的LH、TT、血清AMH浓度、FINS、HOMA-IR均高于对照组(P<0.05,表 1)。
2.2 PCOS组与对照组各氧化应激指标的比较
PCOS组血清抗氧化指标Glut oxyd、总抗氧化活性(total antioxidant activity,TAA)、VC、VE浓度与对照组相比差异无统计学意义(P>0.05); PCOS组RET血清浓度低于对照组,差异有统计学意义(P<0.05),而PCOS组MDA、SOD均高于对照组差异有统计学意义(P<0.05,表 2)。

表1 PCOS与对照组人体测量学与内分泌指标特点Tab.1 Characteristics of anthropometric and various endocrine and metabolicindicators in PCOS group and control group

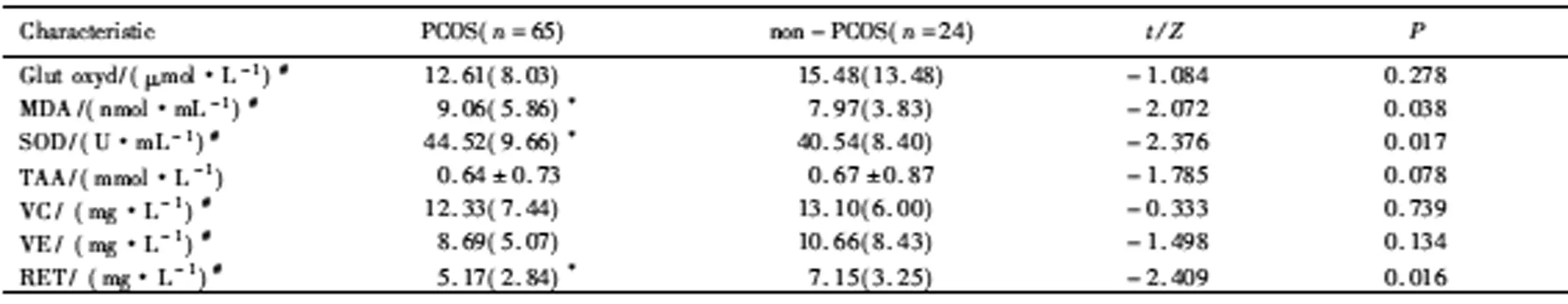
表2 PCOS组与对照组各氧化应激相关指标的比较Tab.2 Comparison of oxidative stress indexes in PCOS group and control group

2.3 氧化应激指标与内分泌代谢指标相关分析
将两组研究对象的内分泌代谢指标分别与MDA、RET行相关分析结果显示MDA与AMH呈正相关(r=0.208,P=0.05),与TT、FINS、HOMA-IR无相关性(P>0.05);RET与AMH呈负相关(r=-0.232,P<0.05),与TT、FINS、HOMA-IR无明显相关性(P>0.05),详见表3。

表3 氧化应激指标与内分泌代谢指标相关分析Tab.3 Correlation analysis between oxidative stressindexes and endocrine and metabolic indicators (n=89)
3 讨论
本研究比较了PCOS组与对照组人体测量学指标、内分泌代谢指标的特点,结果显示PCOS组的血清AMH浓度高于对照组(P<0.05),这与本团队前期研究[6]得出的结论一致,有研究[7-9]也对此结论有所证明。主要原因为PCOS最常见的临床表现就是超声下窦卵泡数量的显著增加,而AMH主要在窦前卵泡和小窦状卵泡表达,这导致PCOS 患者的血清AMH的增高,使得AMH对PCOS的诊断有很好的预测价值。本研究PCOS组FINS、HOMA-IR、TT高于对照组(P<0.05),此结果验证了PCOS常伴有高雄激素血症、胰岛素抵抗的临床表现。
本研究比较了两组各氧化应激指标的水平,结果显示PCOS组的MDA高于对照组(P<0.05)。MDA是具有代表性的氧化应激指标,它是过量的ROS生成脂质过氧化物的终末产物。ROS是有氧代谢的重要产物[10],在生理情况下,ROS的产生和清除保持动态平衡,机体具有使ROS维持在细胞功能所必需的非常低的水平。如果ROS的产生速度(氧化速度)超过了机体对其清除的能力(抗氧化能力),可使机体内ROS堆积,机体则处于一种应激的状态,即OS状态,从而造成机体的损伤,研究[11-13]显示,卵巢的卵泡微环境内也存在氧化与抗氧化的动态平衡,这种动态平衡与卵泡的成熟密切相关。MDA在PCOS组表达的增高提示MDA的增多超出了机体自身抗氧化的负荷,以致卵泡的发育受到影响。SOD作为抗氧化酶,有研究[14]显示PCOS组低于对照组,也有研究[15]显示PCOS组高于对照组,本研究结果显示在PCOS组SOD表达高于对照组,这与Murri 等[16]的Meta分析研究结果一致,研究[17]显示SOD是在窦状卵泡内膜细胞中发挥抗氧化作用,PCOS组中SOD表达水平的增加可能与PCOS患者窦卵泡数量的显著增加有关,但此结论仍需要深入研究进行验证。PCOS组RET低于对照组(P<0.05),其余抗氧化指标总抗氧化活性、非酶性抗氧化剂包括VE、VC可能因为样本量受限均差异无统计学意义(P>0.05),提示PCOS患者总体抗氧化能力呈下降趋势。而梅玲蔚等[18]的研究显示在不明原因的不孕症患者腹腔中发现较高的 ROS,特别是脂质过氧化标志物MDA明显高于抗氧化物浓度,以及谷胱甘肽和维生素 E 等抗氧化物浓度低下,而PCOS也是不孕症患者的一部分,且本研究也提示PCOS患者体内的氧化应激水平增加,由此推测PCOS导致的不孕可能也与氧化应激有关。
本研究还对氧化应激指标与内分泌代谢指标行相关性分析显示,MDA作为OS的代表性指标,与AMH呈正相关(r=0.208,P=0.05),RET是一种脂溶性抗氧化剂,与AMH呈负相关(r=-0.232,P<0.05),而有研究[19]证实PCOS患者血清AMH浓度增高,提示MDA、RET引起氧化应激水平的失衡可能参与了PCOS的发病机制。Özer等[20]的研究显示MDA与胰岛素抵抗呈正相关,而Enli等[21]研究显示MDA与胰岛素抵抗无显著相关性,本研究得出MDA、RET与TT、FINS、HOMA-IR相关性均无统计学意义(P>0.05),此结论仍有争议,也可能由于本研究样本量小,后续仍需要扩大样本量对此结论进行验证。
综上所述,PCOS患者体内氧化应激水平的增加及抗氧化能力水平的降低打破了卵巢卵泡微环境的生理动态平衡,可能导致卵泡发育不成熟,从而影响女性月经及不孕。因此,深入研究氧化应激与PCOS的关系可能有助于阐明PCOS的发病机制。
