ACE2/Ang(1-7)对小鼠脂肪组织脂肪合成的影响
2018-07-24马池发史婷婷刘敬怡宋丽妮冯建萍袁明霞杨金奎
马池发 史婷婷,2 刘敬怡,2 宋丽妮,2 冯建萍,2 袁明霞,2* 杨金奎,2
(1.首都医科大学附属北京同仁医院内分泌科,北京100730;2.糖尿病防治研究北京市重点实验室,北京100730)
肾素-血管紧张素系统(renin-angiotensin system,RAS)经典作用是调节血压及维持水电解质平衡,近年来研究[1-4]证实RAS系统参与调解糖代谢及脂代谢。RAS系统新发现的成员血管紧张素转化酶 2(angiotensin-converting enzyme 2,ACE2),可将血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)分解为血管紧张素(1-7)[angiotensin (1-7), Ang(1-7)],后者通过Mas受体发挥作用,形成ACE2/Ang(1-7)/Mas轴与经典的ACE/AngⅡ/AT1轴相拮抗。脂肪组织是胰岛素作用的重要的靶器官,也是重要的内分泌器官,能分泌多种细胞因子、激素影响糖脂代谢。RAS系统的成员在脂肪组织表达[5],并参与调解脂肪组织脂代谢,AngⅡ促进脂肪合成[6],促进脂肪细胞释放炎性反应因子[7]。但是ACE2/Ang(1-7)对脂肪组织脂代谢的作用目前研究较少。本研究选用两种不同的动物模型,研究ACE2/Ang(1-7)对脂肪组织脂肪合成的影响。
1 材料与方法
1.1 实验动物与分组
选取雄性8周龄ACE2基因敲除(angiotensin-converting enzyme 2-knockout,ACE2KO)小鼠8只,以体质量相当的雄性8周龄C57BL/6 (wild-type,WT)小鼠8只作为对照,给予高脂饮食[20%(质量分数)蛋白、35%(质量分数)碳水化合物、45%(质量分数)脂肪]饲养。
选取体质量接近的雄性8周龄2型糖尿病db/db小鼠,采用数字表法随机分为3组,每组8只,予普通饮食。于无菌条件下皮下植入ALzet 微量泵(型号1002),分别给予A779[D-Ala7-Ang(1-7)](500 μg·kg-1·d-1)、Ang(1-7)(500 μg·kg-1·d-1)+A779 (500 μg·kg-1·d-1)以及相同剂量的0.9%(质量分数)氯化钠注射液干预4周。Ang(1-7)(货号H1715)及A779(货号H2888)购于瑞士Bachem公司。
所有动物购于南京大学模式动物研究所,实验所使用动物均经过首都医科大学附属北京同仁医院动物委员会批准。动物饲养环境为SPF级别,自由摄水,每天光照12 h。 温度18~23 ℃,湿度50%~60%,实验动物许可证号:SCXK(苏)2005-0001。
1.2 检测体质量、取材、计算体脂率
饲养4周后测小鼠体质量。将小鼠断颈处死,PBS灌流组织,留取附睾脂肪及皮下脂肪称质量,计算小鼠体脂率(脂肪质量与体质量之比)。
附睾脂肪同一部位放入4%(质量分数)多聚甲醛固定以做HE染色,剩余部分放入液氮转入-80 ℃冰箱冻存留作Western blotting法检测。
1.3 血脂测定
小鼠处死前毛细管内眦取血800 μL,4 ℃ 4 000 r/min 离心10 min,留取血清测血脂。血浆三酰甘油(triglyceride,TG)测定采用GPO-PAP法。总胆固醇(total cholesterol,TC)测定采用CHOD-PAP法。 试剂盒购于中生北控生物科技股份有限公司。分别对标准品、对照品和待测样品进行测量,采用Bio-Rad酶标仪读取测定。
1.4 附睾脂肪组织HE染色
附睾脂肪组织4%(质量分数)多聚甲醛固定、乙醇脱水、二甲苯透明、石蜡包埋、切片、制成5 μm石蜡切片,HE 染色后显微镜下观察。
1.5 Western blotting法检测
用RIPA强裂解液(加入PMSF100X,Cocktail25X)裂解小鼠附睾脂肪,用BCA蛋白浓度测定试剂盒测定样品蛋白浓度。每个样本取30 μg蛋白进行SDS聚丙烯酰胺凝胶电泳并转至PVDF上,用含5%(质量分数)脱脂奶粉的TBST溶液封闭1.5 h,加入稀释的一抗于 4 ℃孵育过夜。TBST漂洗3次,每次5~10 min,加入 1∶2 000辣根过氧化物酶标记的二抗,室温孵育1 h,TBST漂洗3次,每次10 min,肌动蛋白(β-actin)为内参,滴加增强化学发光法(enhanced chemiluminescence,ECL)化学发光液,用Chemi-Doc Touch凝胶成像系统显影成像,并用Image Lab 软件灰度分析。乙酰辅酶A 羧化酶ɑ(acetyl-CoA carboxylase ɑ,ACCɑ)抗体购于美国Santa Cruz公司(货号Sc-30212),β-actin(货号8457)及脂肪酸合成酶(fatty acid synthetase,FAS)抗体(货号3180) 抗体购于美国Cell Signaling Technology公司。脂肪型脂肪酸结合蛋白(adipocyte fatty acid binding protein,aP2)(货号ab23693)抗体购于英国Abcam公司。
1.6 统计学方法

2 结果
2.1 ACE2敲除后对小鼠体质量及体脂率的影响
高脂饮食喂养小鼠4周后,ACE2 基因敲除小鼠与野生对照小鼠相比,体质量无明显变化;肉眼观察脂肪组织大体标本,ACE2基因敲除鼠脂肪量明显多于野生对照鼠;体脂率测定明显高于野生对照鼠(P<0.05)(图1)。
2.2 ACE2敲除后对小鼠血脂的影响
高脂饮食喂养小鼠4周,ACE2基因敲除小鼠血清TG浓度较对照组明显升高(P<0.05),TC浓度在两组间比较,差异有统计学意义(图2)。
2.3 ACE2敲除后对小鼠附睾脂肪细胞形态学的影响
HE染色结果显示,野生对照小鼠附睾脂肪细胞排列较紧密,细胞边缘较清晰;ACE2基因敲除鼠附睾脂肪细胞体积与对照小鼠相比增大,且细胞边缘更模糊(图 3)。
A:weight;B:adipose tissue of WT mice;C:adipose tissue ofACE2KO mice;D:body fat percentage;*P<0.05,n=6;WT:wild type;ACE2:angiotensin-converting enzyme 2;ACE2KO:angiotensin-converting enzyme 2-knockout.

图2 ACE2基因对小鼠血脂的影响Fig.2 Effect of ACE2 gene on serum cholesterol andtriglyceride in mice
A:TG;B:TC;*P<0.05,n=6.ACE2:angiotensin-converting enzyme2;ACE2KO:angiotensin-converting enzyme2-knockout;TG:triglycerides;TC:total cholesterol;WT:wild type.

图3 ACE2基因敲除鼠和野生鼠附睾脂肪细胞HE染色Fig.3 Hematoxylin and eosin staining of epididymaladipocytes in ACE2KO and WT mice(HE,400×)
A:epididymal adipocytes of WT mice;B:epididymal adipocytes ofACE2KO mice;WT:wild-type;ACE2:angiotensin-converting enzyme 2 ;ACE2KO:angiotensin-converting enzyme2-knockout.
2.4 ACE2基因敲除后对附睾脂肪合成因子的影响
Western blotting法检测结果示,ACE2基因敲除鼠附睾脂肪ACCα、FAS的蛋白表达高于野生对照小鼠,差异有统计学意义,ACE2基因敲除鼠的aP2蛋白表达有高于野生对照小鼠的趋势,差异无统计学意义(P>0.05, 图4)。

图4 ACE2基因对小鼠附睾脂肪组织脂肪合成因子蛋白表达的影响Fig.4 Effect of ACE2 on the lipogenesis related genesexpression in epididymal adipose tissue of mice
A:representative Western blotting for ACCɑ,FAS and aP2;B:statistical analysis for protein level;ACE2:angiotensin-converting enzyme 2;ACE2KO:angiotensin-converting enzyme2-knockout ;WT:wild-type;ACCɑ:acetyl-CoA carboxylase ɑ;FAS:fatty acid synthetase;aP2:adipocyte fatty acid binding protein;*P<0.05.
2.5 Ang(1-7)对db/db小鼠体质量的影响
Ang(1-7)皮下泵干预小鼠4周后,小鼠体质量与0.9%(质量分数)氯化钠注射液处理组相比没有明显变化。应用Ang(1-7)的拮抗剂A779拮抗Ang(1-7)后对体质量无明显影响(图5)。
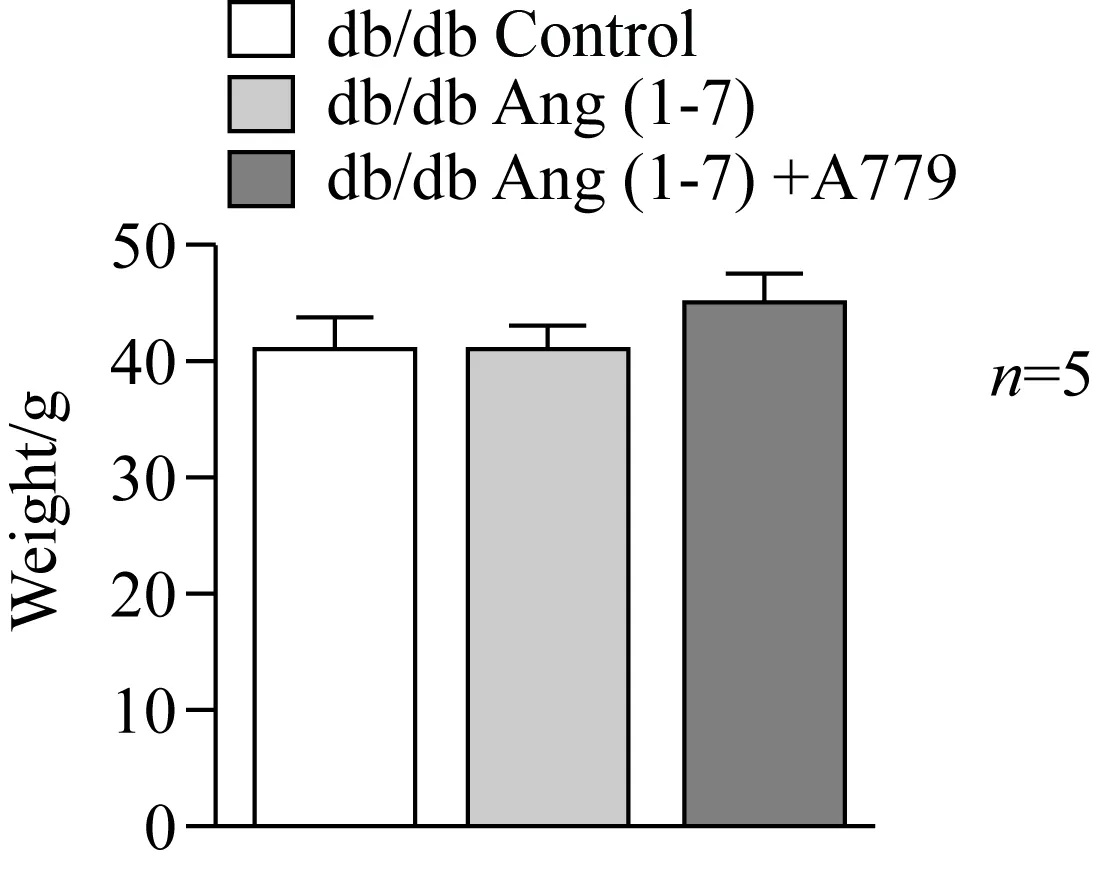
图5 Ang(1-7)及Ang(1-7)+A779干预对小鼠体质量的影响Fig.5 Effect of Ang(1-7) and Ang(1-7)+A779 onbody weight in db/db miceAng(1-7):angiotensin (1-7); A779: D-Ala7-Ang(1-7).
2.6 Ang(1-7)对db/db小鼠附睾脂肪合成因子的影响
Ang(1-7)干预db/db小鼠4周后, 其附睾脂肪ACCα及FAS蛋白的表达较0.9%(质量分数)氯化钠注射液处理组下调,加用Ang(1-7)的拮抗剂A779干预后ACCα及FAS蛋白的表达较Ang(1-7)干预组上调,差异有统计学意义(图6)。

图6 Ang(1-7)、Ang(1-7)+A779干预对db/db小鼠附睾脂肪组织脂肪合成因子蛋白表达的影响Fig.6 Effect of Ang(1-7),Ang(1-7)+A779 onlipogenesis related genes expression in epididymaladipose tissue of db/db mice
A:representative Western blotting for ACCɑ and FAS;B:statistical analysis for protein level;Ang(1-7): angiotensin(1-7);A779: D-Ala7-Ang(1-7);ACCɑ:acetyl-CoA carboxylase ɑ;FAS:fatty acid synthetase;*P<0.05,**P<0.01.
3 讨论
哺乳动物白色脂肪组织主要功能是以TG的形式存贮能量,同时它也是重要的内分泌器官,分泌激素、细胞因子等通过自分泌、内分泌、旁分泌方式发挥作用[8]。白色脂肪在高血糖、高血压、脂代谢紊乱、肥胖等代谢综合征及胰岛素抵抗发生中起重要作用。肥胖患者中RAS系统是过度激活的[9],与胰岛素抵抗密切相关。研究[10]表明,RAS系统中ACE2/Ang(1-7)/Mas轴拮抗ACE/AngⅡ/AT1轴的作用。ACE/AngⅡ/AT1轴的经典作用有收缩血管,引起醛固酮的释放、保钠、保水,近年来更多的研究[1, 11]是关注其对糖脂代谢的影响。Ang(1-7)可对抗AngⅡ的血管收缩、促纤维化、促生长效应[12],可改善脂肪细胞氧化应激,增加葡萄糖摄取[13]。
目前关于RAS对脂肪代谢的影响有一些相关报道。AngⅡ可通过AT1受体抑制脂肪细胞分化[14]和脂肪分解[11],缺乏AT1a受体可减轻饮食诱导的肥胖[15],但是目前ACE2/Ang(1-7)/Mas轴对脂肪代谢并没有深入探讨。有研究[16]表明,Ang(1-7)能上调FAS、ACC、aP2等因子表达促进脂肪细胞形成,也有研究[17-18]证实ACE2受体激动剂三氮脒(diminazene aceturate,DIZE)下调ACCα及FAS等因子抑制脂肪合成。为了更加明确ACE2/Ang(1-7)对脂肪合成的影响,本研究中选用ACE2敲除及2型糖尿病db/db小鼠两种动物模型,以其附睾脂肪作为白色脂肪的代表,正反两方面论证ACE2/Ang(1-7)对白色脂肪组织脂肪合成的影响。结果发现,ACE2基因敲除后,小鼠的体脂率及血脂浓度明显升高,同时,Western blotting法检测结果显示ACE2敲除后脂肪合成关键因子ACCα及FAS的蛋白表达升高。这些结果表明,ACE2敲除后小鼠的脂肪合成是上调的。本研究同时应用Ang(1-7)干预2型糖尿病db/db小鼠,发现Ang(1-7)抑制了附睾脂肪组织脂肪合成因子的表达,同时这一作用被Ang(1-7)的拮抗剂A779所拮抗。这一发现与ACE2基因敲除小鼠的结果相吻合。
本研究证明了ACE2/Ang(1-7)对白色脂肪合成的抑制作用,但是仍有不足之处:(1)Ang(1-7)的受体主要为Mas受体,本研究未针对Mas受体对脂肪代谢的影响进行研究。下一步本课题组将构建Mas基因敲除小鼠进一步研究Mas基因对小鼠脂肪组织脂代谢的影响。(2)本实验选用ACE2基因敲除小鼠,不排除器官之间相互影响,课题组拟构建ACE2脂肪特异性敲除小鼠进一步研究脂肪组织局部RAS对脂代谢的影响。
综上所述,本研究结果表明, ACE2/Ang(1-7) 抑制小鼠白色脂肪组织的脂肪合成,其机制可能是通过抑制脂肪合成关键因子的表达发挥作用。这一结果对研究RAS系统参与胰岛素抵抗发生的机制及发现改善胰岛素抵抗的新靶点可能提供新的思路。
