脂多糖对肠道α-突触核蛋白表达的影响
2018-07-24刘梦茹宫晓丽王晓民
刘梦茹 宫晓丽 王 乐 刘 玚 张 婷* 王晓民*
(1.首都医科大学基础医学院神经生物学系, 北京 100069;2.首都医科大学教育部神经变性病重点实验室, 北京 100069;3,首都医科大学基础医学院生理与病理生理学系, 北京 100069)
帕金森病(Parkinson’s disease, PD)是一种运动症状伴发非运动症状的全身性疾病,在65岁以上的中老年人群中发病率仅次于阿尔兹海默症,位居第二。静止性震颤、肌僵直、运动迟缓和姿势不稳是PD后期的主要运动功能障碍的表现,所以PD患者在中晚期时没有能力自己照料生活,给患者的家庭和社会带来了沉重的负担。从PD被发现至今已201年,但其发病机制仍不明确。
一直以来,中脑黑质部位多巴胺神经元的进行性死亡和以α-突触核蛋白(α-synuclein, α-syn)为主要组成成分聚集而成的路易小体的出现是PD的主要病理表现。近年来的研究[1]显示除了运动障碍之外,PD患者还表现出一些非运动症状,包括:嗅觉减退、失眠、心悸、便秘、抑郁、痴呆等。有文献[1-2]显示,在PD临床症状确诊前20年,便可检测到胃肠道组织中发生α-syn的聚集或出现路易小体,并伴有便秘、胃食管反流等非运动症状,随时间的延长胃肠道的功能障碍会不断加重。另有研究[3-4]表明A53T 和 A30P 突变型的α-syn转基因小鼠胃、结肠、回肠组织均出现α-syn蛋白的异常聚集,且早于中枢神经系统发生。
炎性反应是PD发病进程中的早期重要影响因素。在PD患者和动物模型中,脑内唯一的固有免疫细胞——小胶质细胞发生激活,肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)等促炎因子大量释放。对PD患者外周组织的临床研究[5]也显示,PD患者的胃肠道炎性反应水平显著升高。然而,外周炎性反应与胃肠道组织内α-syn蛋白表达的关系,目前仍不明确。本研究利用腹腔注射细菌脂多糖(lipopolysaccharide, LPS)构建炎性反应诱导的PD小鼠模型,观察炎性反应急性期和慢性期小鼠结肠内源性α-syn的表达,以及胃肠道组织内炎性反应小体NOD样受体家族蛋白3(NOD-like receptor protein 3,NLRP3)和TNF-α的水平。
1 材料和方法
1.1 动物
雄性C57BL/6J小鼠购买和饲养于首都医科大学动物部SPF级小鼠饲养室,实验动物许可证号为SYXK(京)2018-0002。每笼小鼠不超过5只,室内温度控制在(23 ± 2) ℃,湿度50%~55 %,并保持12 h/12 h昼夜循环,小鼠可以自由饮水和摄食。本实验所有操作均符合《中华人民共和国动物保护法》,并通过首都医科大学动物伦理委员会的批准。
1.2 模型制备及分组
将野生型C57BL/6J小鼠采用数字表法随机分为0.9%(质量分数)氯化钠注射液对照组和LPS模型组,模型组小鼠按照体质量单次腹腔注射5 mg/kg的LPS(购自美国Sigma公司),注射体积为0.2 mL,对照组注射相同体积的0.9%(质量分数)氯化钠注射液,每组20只。LPS注射后1、3、12 h和1个月后分别取3~6只小鼠进行实验。
1.3 酶联免疫吸附反应法检测TNF-α
取模型组和对照组小鼠的外周血,将血样本在37 ℃孵箱内孵育30 min,随后放入4 ℃离心机内以2 000 r/min的转速离心10 min,取上清使用双抗夹心法TNF-α ELISA试剂盒(购自上海依科赛公司)测量各组小鼠血液中TNF-α蛋白含量,用多功能酶标仪(Spectra Max Paradigm I3,美国Molecular Devices公司)测量标准品和样本在540 nm吸收峰检测吸光度值,根据标准品浓度计算出样本的浓度。
1.4 Western blotting法检测蛋白浓度
在LPS注射3 h后,取对照组和模型小鼠结肠组织,加入含有蛋白酶和磷酸酶抑制剂的RIPA裂解液裂解,剪刀剪碎组织,用超声裂解后室温静置30 min,4 ℃离心机以12 000 r/min的转速离心15 min后取上清,用BCA法测定各组中蛋白的浓度。将蛋白按4∶1加入SDS上样缓冲液,95 ℃变性5 min,混匀后得到配制好的上样蛋白样本。将等量蛋白上样样本按顺序缓慢匀速加入聚丙烯凝胶的孔中,恒压120 V电泳、恒流200 mA电转180 min,将蛋白转移到孔径为0.22 μm的硝酸纤维素膜上,封闭液室温孵育1 h,一抗α-syn抗体(1∶1 000,购自美国BD公司)、NLRP3抗体(1∶200,购自美国Sigma公司)、内参抗体ACTIN(1∶3 000,购自美国Sigma公司)依次孵育,4 ℃冰箱过夜。随后室温避光孵育二抗1 h,然后PBST洗膜3次,每次5 min,最后用Odyssey红外成像系统(美国Licor公司)进行扫描成像,用Image J软件统计条带。
1.5 RT-qPCR法检测TNF-α的mRNA
在LPS注射1 h后,取对照组和模型小鼠结肠组织,用Trizol法提取组织总mRNA,用Nanodrop 微量分光光度计(Nano Drop 2000, 美国Thermo公司)检测mRNA浓度。使用Luna Universal One-Step RT-qPCR Kit试剂盒(购自美国NEB公司),建立总体积为20 μL的RT-qPCR反应体系,QuantStudio 5 实时定量PCR仪中进行RT-qPCR反应。引物序列分别为:m- TNF-α 上游引物:5′-CCAGTGTGGGAAGCTGTCTT-3′,m-TNF-α 下游引物:5′- AAGCAAAAGAGGAGGCAACA-3′;m-GAPDH 上游引物:5′- AGAACATCATCCCTGCATCC-3′,m-GAPDH 下游引物:5′- CACATTGGGGGTAGGAACAC -3′。
1.6 统计学方法

2 结果
2.1 LPS腹腔注射引起小鼠外周血TNF-α增加和体质量下降
在LPS腹腔注射后12 h和1个月后,分别对小鼠的体质量进行检测,同时取血清进行ELISA检测TNF-α浓度。结果显示LPS模型组的小鼠体质量在腹腔注射后12 h下降至对照组小鼠体质量的91.79 %[(25.17 ± 0.85)gvs(22.13 ± 0.64)g],差异有统计学意义(P<0.000 1),而注射后1个月的小鼠体质量恢复至正常水平。同时,用ELISA的方法检测小鼠血清中炎性反应因子TNF-α的变化情况,结果表明在LPS腹腔注射后1 h血清TNF-α较对照组迅速升高了17.3倍[(24.67 ± 21.70)pg·μL-1vs(427.90 ± 291.6)pg·μL-1],差异有统计学意义(P=0.015),在1个月后恢复至正常水平,与对照组比较差异无统计学意义(图1)。
2.2 LPS注射后急性期结肠α-syn、NLRP3 和TNF-α表达增加
取腹腔注射LPS的模型小鼠结肠组织,通过Western blotting检测α-syn和炎性反应小体NLRP3的蛋白表达情况,结果显示LPS注射后3 h结肠内NLRP3的表达较对照组升高了(1.079 ± 0.26)倍(P=0.002),α-syn蛋白较对照组升高了(0.33 ± 0.12)倍(P=0.010 1),说明LPS可以刺激结肠的α-syn蛋白表达,同时伴随着炎性反应小体的激活。随后用RT-qPCR的方法检测炎性反应因子TNF-α的转录水平,结果显示TNF-α的mRNA在注射后1 h明显升高了(34 ± 4.30)倍(P=0.000 3)(图2)。以上结果说明,LPS刺激了结肠内α-syn的蛋白表达,激活了结肠炎性反应小体,促进了炎性反应因子TNF-α的表达。

图1 LPS腹腔注射引起小鼠外周血TNF-α增加和体质量下降Fig.1 LPS increased serum TNF-α level and decreased body weight
C57BL/6J mice were injected with LPS (5 mg/kg) intraperitoneally or saline as control group. Body weights were measured at 12 hours post-LPS injection(A). TNF-α protein in serum was tested at 1 hour post-LPS injection (B). Body weights (C) and TNF-α protein in serum (D) were also measured at 1 month post-LPS injection. Data were analyzed by unpaired Student’st-test.**P<0.01,***P<0.001vsNS group;LPS:lipopolysaccharide;NS:normal saline;TNF-α:tumor necrosis factor-α.
2.3 LPS注射后1个月结肠α-syn和NLRP3恢复,而TNF-α表达仍增高
LPS注射后1个月,检测小鼠结肠组织内α-syn和NLRP3的蛋白表达情况,结果显示α-syn的蛋白表达较对照组无明显改变,同时炎性反应小体NLRP3差异无统计学意义。随后用RT-qPCR的方法检测结肠内TNF-α的mRNA水平,LPS注射组较对照组仍升高了(21.3 ± 10.92)倍(P=0.027 9)(图3)。以上结果说明LPS注射小鼠的结肠组织,在慢性期α-syn表达恢复至正常水平,炎性反应小体也恢复,但结肠组织局部炎性反应因子TNF-α仍处于较高水平。
3 讨论
PD是一种运动症状伴发非运动症状的全身性疾病,其病理改变主要表现为黑质多巴胺能神经元进行性丢失和α-syn异常聚集形成的路易小体。2010年Kalia等[6]和Hawkes等[7]依据PD患者的组织学研究结果和临床表现提出假说认为,PD患者的非运动症状,如便秘、胃食管反流等症状可能早于运动症状20年发生,并伴有胃肠道内α-syn的聚集。但至今,PD的发病机制仍不清楚,胃肠道α-syn异常的原因不明。
α-syn是位于中枢神经系统神经突触前膜末梢的小分子可溶性蛋白,由140个氨基酸残基组成,相对分子质量为19 000, 结构上相对保守,主要分为囊泡结合型和膜结合型。α-syn的氨基酸序列可分为3个区域:氨基端,含有KTKEGV重复序列,易形成两性α螺旋;中间部NΑC区域,其疏水区易形成β片层结构,在体外极易聚集,且可促进α-syn的聚集;羧基端主要由酸性氨基酸组成,带有大量负电荷,具有较强的亲水性。α-syn丰富表达在神经元内,但在肌肉、血细胞等组织细胞中也有表达[8]。
PD是一种神经退行性疾病,其主要病理改变为黑质多巴胺能神经元进行性丢失以及α-syn异常聚集形成路易小体。PD症状分为运动症状和非运动症状,运动症状表现为静止性震颤、肌僵直等,非运动症状表现有胃食管反流、便秘、嗅觉障碍等[9]。在PD相关因素调查中,便秘与PD患病的相关性,是性别因素和年龄因素与PD发病相关性的6倍。肠道运动频率与PD患病率呈负相关。在PD发病的每个阶段都伴随着胃肠道损伤,尤其对于晚期PD患者胃肠症状变得更加严重[10-12]。临床数据[13]显示PD患者肠道通透性较对照组明显增高,这一现象与PD患者肠道大肠杆菌、血中脂多糖结合蛋白水平以及α-syn蛋白表达的增加密切相关。动物实验中也发现从LPS腹腔注射后2个月,小鼠肠道通透性开始增加同时伴随α-syn蛋白表达增多,且具有时间依赖性[14]。LPS腹腔注射后7个月,黑质多巴胺能神经元数目降低了23%,10个月时降低了47%[15]。同时还伴随着运动行为的改变。因此研究LPS诱导的炎性反应对于肠道α-syn表达的影响在PD发病早期肠道通透性增强等非运动症状的发生中具有重要的理论价值,同时也对PD的早期诊断具有重要的意义。

图2 LPS注射后急性期结肠α-syn、NLRP3 和TNF-α表达增加Fig.2 In the acute phase, LPS increased the expression of α-syn, NLRP3 and TNF-α in the intestine
The expression of α-syn and NLRP3 protein in the intestine were measured by Western blotting at 3 hours post-LPS injection (A-C). The mRNA level of TNF-α (D) was measured by reverse transcription-polymerase chain reaction at 1 hour after LPS injection. Data were analyzed by unpaired Student’st-test.*P<0.05,**P<0.01,***P<0.001vsNS group;LPS:lipopolysaccharide;NS:normal saline;NLRP3:NOD-like receptor protein 3;TNF-α:tumor necrosis factor-α;α-syn:α-synuclein;GAPDH: glyceraldehyde-3-phosphate dehydrogenase.
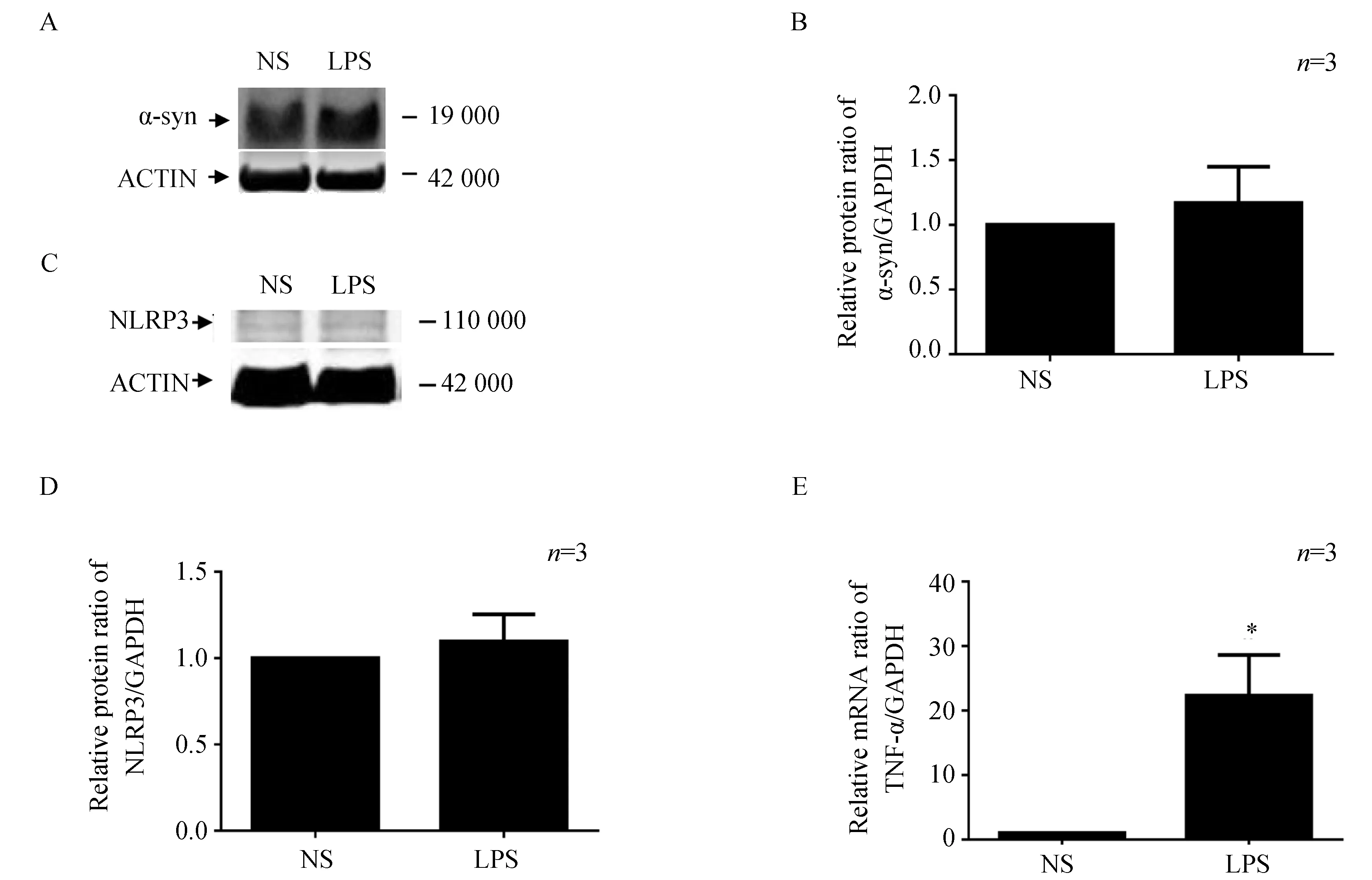
图3 LPS注射后1个月结肠α-syn和NLRP3恢复,而TNF-α表达仍增高Fig.3 Expression of α-syn and NLRP3 were recovered, while TNF-α still increased in theintestine at one month after LPS injection
The expression of α-syn (A,B) and NLRP3 protein (C,D) in the intestine were measured by Western blotting at one month post-LPS injection. The mRNA level of TNF-α (E) was measured by reverse transcription-polymerase chain reaction. Data were analyzed by unpaired Student’st-test,*P<0.05vsNS group;LPS:lipopolysaccharide;NS:normal saline;α-syn:α-synuclein;NLRP3:NOD-like receptor protein 3;TNF-α:tumor necrosis factor-α.
笔者给予野生C57BL/6J小鼠腹腔注射LPS后发现在急性反应期小鼠肠道内α-syn蛋白较对照组明显的增多,同时也伴随着炎性反应小体NLRP3和炎性反应因子TNF-α的表达增加,在LPS注射后一个月结肠α-syn的表达恢复接近至正常水平,但肠道组织TNF-α持续的高表达,还未有文献报道。提示肠道组织很可能与脑组织作用原理相似,LPS诱导的TNF-α持续的高表达导致LPS慢性反应期(注射后2~5个月)肠道α-syn表达增加、神经元丢失以及引起肠道功能障碍。该研究为炎性反应对PD早期肠道功能障碍的影响提供可能的理论依据。也为进一步的解释PD关键致病蛋白α-syn的机制、病理诊断和治疗提供可能的依据。
