江鳕类志贺邻单胞菌的分离鉴定及药敏试验
2018-07-24张效平李小义李正友商宝娣
张效平,杨 星,李小义,李正友,商宝娣
( 贵州省水产研究所,贵州 贵阳 550025 )
江鳕(Lotalota)属鳕形目、鳕科、江鳕属,是鳕科鱼类中唯一的淡水种类,分布于北纬45°以北的欧亚和北美内陆水域,在我国仅分布于新疆额尔齐斯河及黑龙江水系上游,是我国冷水鱼类珍稀物种,也是世界抢救性开发的品种之一[1-2]。江鳕具有较高的经济价值、药用价值和特殊的科学研究价值[3]。目前国内外研究主要集中在江鳕的生物学特性、人工繁育及驯养等方面[4-7],尚未见江鳕细菌性疾病的报道。我国已攻克了江鳕人工繁殖技术,可大批量培育出夏花鱼种。贵州省安顺市某养殖场于2013年从新疆建设兵团引进江鳕鱼种进行驯养。2014年7—8月,引进的江鳕出现以“鱼体瘦弱,进食减少,体表发黑;离群独游;下颌严重出血,腹部出血;鳍条腐烂;肝脏出血;肾脏有出血点;肠道内无食物;部分鱼头后背部有破损”为主要症状的疾病反应,持续时间为4周,约有50%的鱼体发病并死亡。笔者从该养殖场取部分症状明显的活体江鳕,实验室条件下从发病江鳕体内分离得到菌株LLL-K-1,通过形态学观察、生理生化特性检测、16S rDNA基因序列分析等试验结果鉴定该菌株为类志贺邻单胞菌(Plesiomonasshigellode)。菌株LLL-K-1回归感染健康江鳕,可表现出与自然发病江鳕相同的症状,并从濒死江鳕体内分离得到该菌,确定其为致病菌。并对致病菌的药物敏感性进行了研究,旨在为其防治提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 试验用鱼
患病江鳕取自贵州省安顺市某养殖场,体长(15.2±0.4) cm。
人工感染试验所用江鳕购于安顺市另一未发病养殖场,试验用鱼体色正常、体表无损伤、活力较好,平均体长(15±1.0) cm,暂养 7 d后用于试验。
1.1.2 主要试剂及试剂盒
TSA培养基、TSB培养基、细菌微量生化鉴定管、MH培养基、药敏试纸(购自杭州微生物试剂有限公司);Primer Star HS DNA聚合酶、EasyTaq DNA聚合酶、dNTP 混合物、DNA Marker DL2000[大连宝生物工程(Takara)有限公司];细菌DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒(天根生化科技公司);细菌16S rDNA通用引物(27F:AGA GTT TGA TCC TGG CTC AG和1492R:TAC GGT TAC CTT GTT ACG ACT T,生工生物工程股份有限公司合成)。
1.1.3 主要仪器
生化培养箱(LRH-250F)、PCR基因扩增仪(BioRad)、核酸蛋白检测仪(Eppendorf)、-80 ℃超低温冰箱(海尔)、凝胶成像系统(Tanon)、全自动高压灭菌锅(HVE-50, HIRAYAMA)、常量天平(TE601-L, Sartorius)、超净工作台(苏净安泰BLB-1300)、正置显微镜(尼康 50i)等。
1.2 临床诊断
现场观察病鱼的摄食情况、行为特点等。将病鱼放入白色的搪瓷盘中,检查病鱼眼晴、鳍条、体表和鳃丝等部位的充血、溃烂、发炎、黏液情况,腹部肿大及肛门肿胀情况;解剖后观察肝、肾、肠等器官病变反应。
1.3 实验室诊断
随机取6条症状明显的病鱼,塑料袋充氧迅速带回实验室做进一步检查。
1.3.1 病原菌分离
75%的酒精擦拭病鱼体表,无菌条件下解剖病鱼,对肝、肾组织进行采样,接种于TSA培养基,于28 ℃倒置培养24 h。平板上生长的菌落形态大小一致,随机挑取单菌落,再次划线TSA培养基,获得纯培养菌株共10株,来源于肾脏的8株编号为LLL-K-1~LLL-K-8,来源于肝脏的2株编号为LLL-L-1和LLL-L-2,10株分离菌呈一致的菌落特征,初步判定为1种菌,选择LLL-K-1为代表株进行后续试验。纯培养物接种胰蛋白胨培养基,28 ℃培养24 h,菌种保存于15%甘油保种液中,置于-80 ℃备用。
1.3.2 病原菌形态学观察
将细菌分离物接种于TSA培养基平板,28 ℃倒置培养过夜,肉眼观察单菌落形态。将菌株培养12 h后进行革兰氏染色观察。
1.3.3 生理生化鉴定
参照《伯杰氏系统细菌学手册》[8]中的细菌鉴定方法,采用细菌微量生化鉴定管对待测菌株进行各项生化指标的测定。
1.3.4 16S rDNA基因序列测定及系统发育分析
参照细菌DNA提取试剂盒说明书,提取病原菌DNA。以菌株基因组DNA为模板,细菌通用引物27F和1492R进行16S rDNA 序列的PCR扩增。PCR体系:5 μL 10×PCR缓冲液、2 μL 10 mmol/L dNTP、10 μmol/L引物各1 μL、1 μL DNA模板、1 μL 聚合酶、39 μL ddH2O。扩增条件:94 ℃预变性2 min;94 ℃变性1 min、55 ℃退火30 s、72 ℃延伸90 s、30 个循环;72 ℃ 10 min。
扩增产物参照琼脂糖凝胶DNA回收试剂盒说明书进行DNA回收纯化,由生工生物工程(上海)有限公司测序。
测序结果在GenBank数据库中进行Blast分析,从比对结果中选取相似度最高的菌株序列,使用Clustal X 1.83进行多重比对分析,然后通过Mega 4 软件及邻接法构建系统发育进化树,所建发育树各分支的置信度由Bootstrap进行1000次循环检验。
1.3.5 回归感染试验
将分离株接种于TSB培养基,28 ℃培养18 h,7200 r/min离心10 min,弃上清液,磷酸盐缓冲液漂洗3次,调节菌悬液密度为1.0×109、1.0×108、1.0×107、1.0×106、1.0×105cfu/mL。取暂养7 d的健康江鳕,随机分为6组,每组6尾。采用腹腔注射的方法,对5个试验组分别注射5种密度的菌悬液,0.3 mL/尾,同时设对照组,注射等量灭菌磷酸盐缓冲液。每个试验组均设置一平行组。每日观察、记录各组的发病症状和死亡数量,对刚死亡的病鱼进行细菌分离鉴定,试验周期为10 d。通过SPSS 13.0 软件计算半数致死密度。
1.3.6 病原菌药物敏感试验
根据纸片扩散法将药敏纸片贴于涂布有密度为5×106cfu/mL分离菌的MH琼脂平板上,28 ℃培养24 h,测量抑菌圈直径。所用的抗生素及含量为:氨苄青霉素(10 μg/片)、先锋霉素Ⅴ(30 μg/片)、克拉霉素(15 μg/片)、依诺沙星(10 μg/片)、氟苯尼考(30 μg/片)、庆大霉素(10 μg/片)、卡那青霉素(30 μg/片)、新霉素(30 μg/片)、哌拉西林(100 μg/片)、利福平(5 μg/片)、大观霉素(100 μg/片)、链霉素(10 μg/片)、复方新诺明[(23.75+1.25) μg/片]、四环素(10 μg/片)、妥布霉素(10 μg/片)、氧氟沙星(5 μg/片)、恩诺沙星(5 μg/片)、诺氟沙星(10 μg/片)、多西环素(30 μg/片)、氟氧头孢(30 μg/片)、多黏菌素B(30 IU/片)、头孢曲松(30 μg/片)、先锋霉素Ⅵ(30 μg/片)、青霉素G(10 U/片)。
2 结 果
2.1 患病江鳕临床表现及宏观病理变化
病鱼鱼体瘦弱,体表发黑,摄食量减少;离群独游;下颌严重出血,腹部出血;鳍条腐烂;肝脏出血;肾脏有出血点;肠道内无食物;部分鱼头后背部有破损。
2.2 病原菌形态特征
10株分离菌呈一致的菌落特征:在TSA琼脂培养基上菌落圆形、边缘整齐、中间凸起、白色不透明、表面湿润、直径为1~2 mm;在营养肉汤培养基中均匀浑浊生长,表面无菌膜形成。
革兰氏染色镜检结果显示,病原菌呈革兰氏阴性。
2.3 分离菌生理生化特征
分离株主要生理生化特征为氧化酶阳性,发酵葡萄糖产酸不产气,产赖氨酸脱羧酶、鸟氨酸脱羧酶、精氨酸脱氢酶,不产脲酶,不产硫化氢,产吲哚,硝酸盐还原阳性,能发酵肌醇、葡萄糖、麦芽糖、甘露糖,明胶液化、V-P试验、七叶苷发酵等指标阴性(表1)。结果显示,菌株LLL-K-1与类志贺邻单胞菌具有相似的表型特征。
2.4 16S rDNA基因序列测定及系统发育分析
PCR扩增获得长度约1500 bp的基因片段。经纯化测序,测定的菌株序列(登录号:KP284552)在GenBank 中进行Blast同源性比对,结果显示,菌株LLL-K-1所测序列与已上传的类志贺邻单胞菌16S rDNA核苷酸序列相似性达99%。选择GenBank中同源性较高的细菌16S rDNA序列,并以柱状黄杆菌(Flavobacteriumcolumnare)为外群,进行比对分析并构建系统发育树(图1),发现菌株LLL-K-1与类志贺邻单胞菌聚为一族。
综合常规生理生化和16S rDNA 基因序列分析结果表明,菌株LLL-K-1为类志贺邻单胞菌。
2.5 回归感染试验
用类志贺邻单胞菌LLL-K-1进行腹腔注射感染健康江鳕,回归感染试验表明,江鳕在注射1.0×109cfu/mL 菌悬液6 d后开始出现死亡,随着攻毒时间的延长各密度菌液对江鳕的累积死亡率结果见图2。由表2可知,注射菌液密度为1.0×105cfu/mL 组在攻毒后10 d内未出现死亡,1.0×106cfu/mL 组的累积死亡率为16.67%,1.0×107cfu/mL组的累积死亡率为33.33%,而1.0×109cfu/mL组和1.0×108cfu/mL组在10 d内的累积死亡率分别为83.33%和58.33%;在整个试验期间,空白对照组鱼未见异常。经计算,类志贺邻单胞菌LLL-K-1的半数致死密度为4.3×107cfu/mL。
经注射类志贺邻单胞菌LLL-K-1患病鱼出现病症与自然发病症状一致,主要表现为体表发黑,下颌出血,腹部出血,鳍条腐烂,解剖可见肝脏出血、肾脏有出血点。从人工感染发病的鱼体中重新分离到的菌株经生化鉴定和分子鉴定表明其与感染用的类志贺邻单胞菌LLL-K-1一致,由此可以确定该菌株为患病鳕鱼的病原菌。
2.6 药敏试验
K-B纸片扩散法进行药物敏感性测试,在24种供试药物中,类志贺邻单胞菌LLL-K-1对氧氟沙星、恩诺沙星、诺氟沙星、依诺沙星极度敏感,对先锋霉素Ⅴ、多西环素、新霉素高度敏感,对氟苯尼考、复方新诺明、四环素、大观霉素、氧氟头孢钠、多黏菌素B中度敏感,对哌拉西林、克拉霉素、妥布霉素、庆大霉素、氨苄青霉素、链霉素、卡那青霉素、利福平头孢曲松、先锋霉素Ⅵ、青霉素G耐药(表3)。
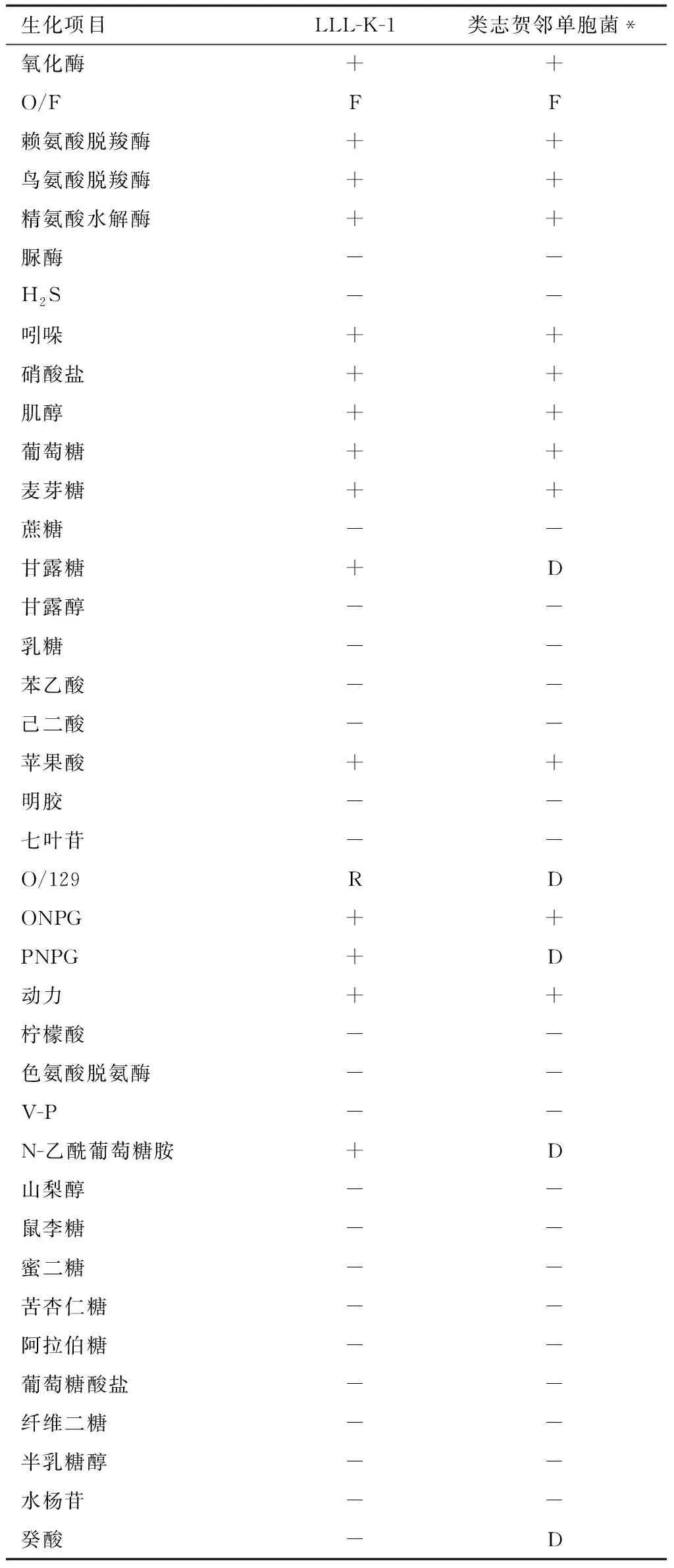
表1 分离株的生理生化试验结果
注:*,《伯杰氏系统细菌学手册》[8]中对类志贺邻单胞菌的描述;+,阳性反应;-,阴性反应;F,发酵反应;R,拮抗反应;D,菌株间有差异.
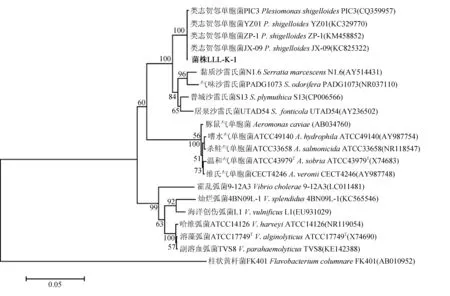
图1 基于16S rDNA序列构建的系统进化树
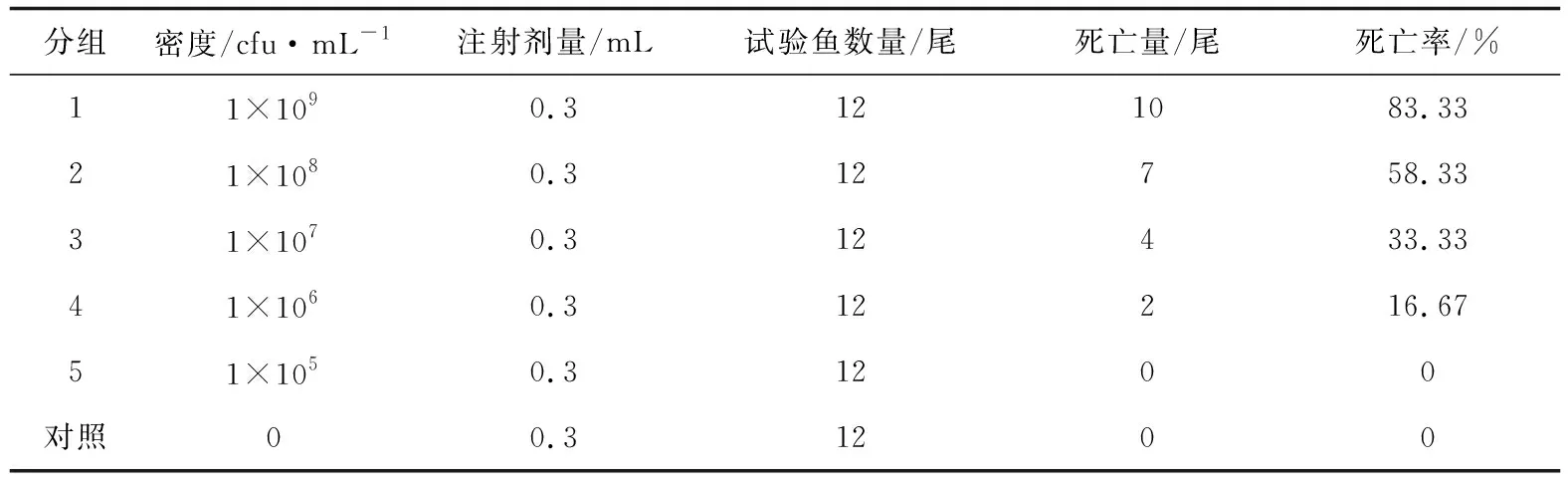
分组密度/cfu·mL-1注射剂量/mL试验鱼数量/尾死亡量/尾死亡率/%11×1090.3121083.3321×1080.312758.3331×1070.312433.3341×1060.312216.6751×1050.31200对照00.31200
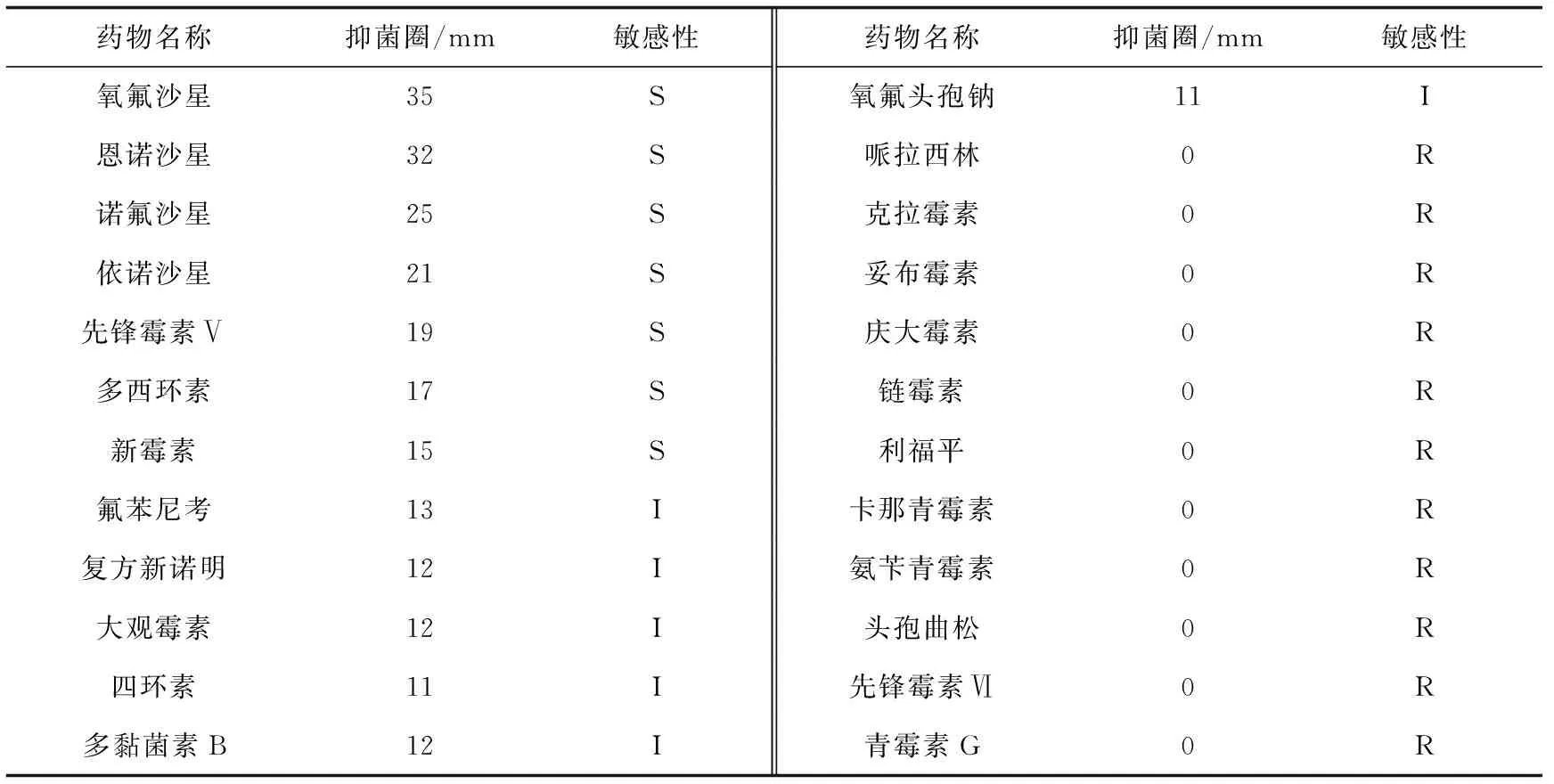
表3 类志贺邻单胞菌LLL-K-1的药敏试验结果
注:S,敏感(直径≥15 mm);I,中度敏感(10 mm<直径<15 mm);R,耐药(直径≤10 mm).
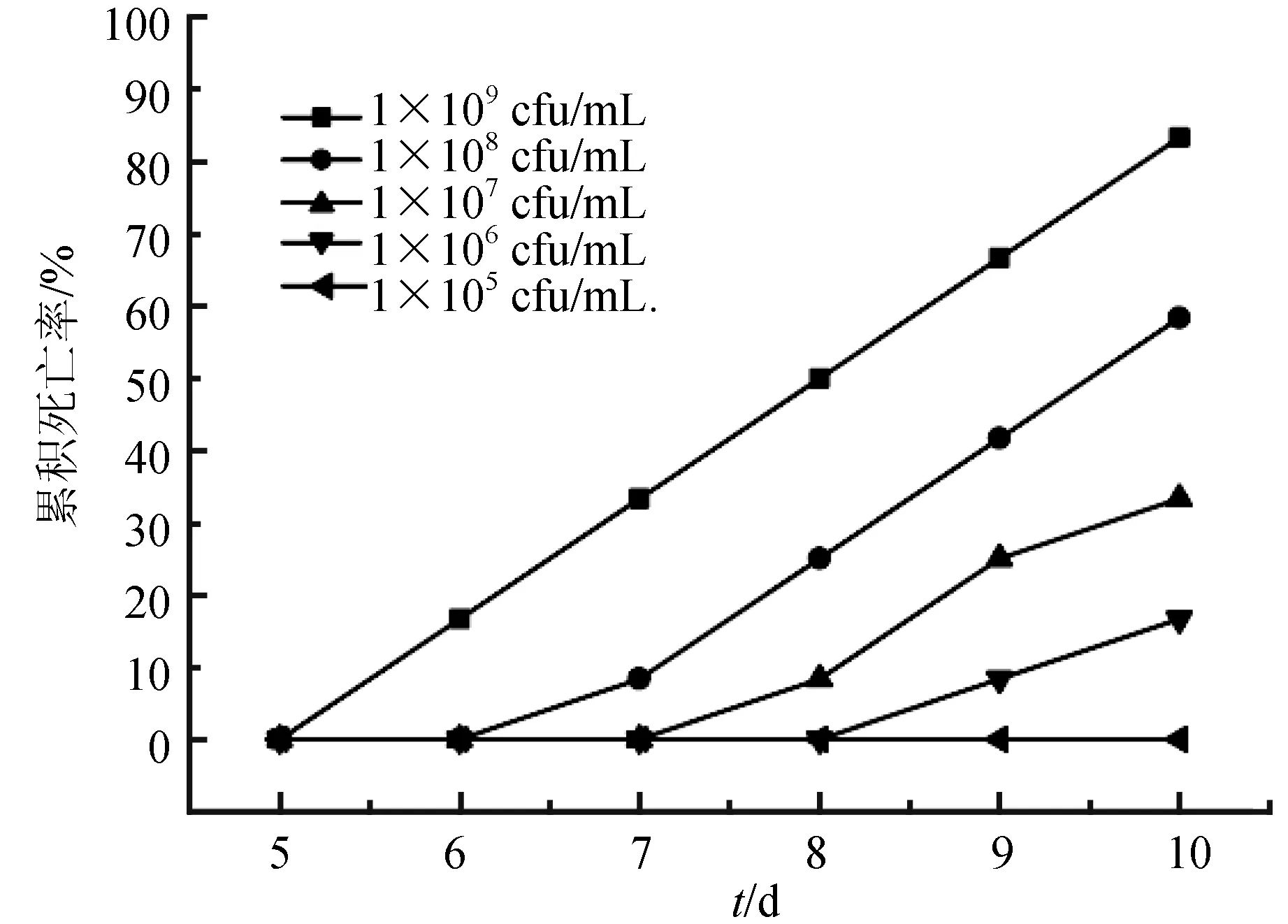
图2 随着攻毒时间的延长江鳕的累积死亡率
3 讨 论
3.1 类志贺邻单胞菌的分离鉴定
类志贺邻单胞菌是邻单胞菌属的唯一菌种,曾一度划归到弧菌科,后根据其在分子水平上与邻单胞菌和变形杆菌更为接近,于2005年《伯杰氏系统细菌学手册》(第2版)确立为肠杆菌科。

3.2 药物敏感试验及防控
超级菌(多重耐药菌)、药物残留、环境污染等问题已引起世界范围的高度重视。对分离到的类志贺邻单胞菌LLL-K-1进行药物敏感性分析发现,该菌对氧氟沙星、恩诺沙星、诺氟沙星、依诺沙星等几种药物敏感,对哌拉西林、克拉霉素、妥布霉素、庆大霉素等耐药。这些结果与Salgado-Miranda 等[16,20]的试验结果不同,可能是由于地域、环境和宿主不同引起的,也可能是由于分离株不同的药物接触史造成的,菌株间耐药性的差异给细菌病的治疗带来极大困难。所以在实际工作中要做到以防为主,改善养殖环境、保持良好水质、投喂优质饲料是防病的关键。在养殖过程中一旦发现江鳕有减食、停食、活动异常等情况时,应及时送检,根据药敏试验结果和渔用药物使用准则科学地选用药物,避免因误诊和延误治疗引起更大的经济损失,又可避免因乱用、滥用和长期反复使用同一种药物造成细菌产生耐药性。
