渔源乳酸菌降解养殖水体氨氮的效果研究
2018-07-24李咏梅任贻超姜森灏王金叶王仁杰
李咏梅,任贻超,2,姜森灏,王金叶,王仁杰,李 超
( 1.青岛农业大学 海洋科学与工程学院,山东 青岛 266109; 2.科拓恒通乳酸菌产业研究院,山东 青岛 266108; 3.盐城师范学院,江苏省滩涂生物资源与环境保护重点实验室, 江苏 盐城 224051 )
近年来,高密度、集约化水产养殖技术快速发展,水体自身污染问题也极为突出[1],养殖系统含氮营养盐过剩累积,水质恶化极易引起水生动物病害[2]。水体中氨氮达到一定含量后,非离子氨易透过细胞膜进入体内,使得水生动物自身的生理调节不能补偿高铁血红蛋白升高而引发的体内组织缺氧,即中毒症状[3],水体氨氮含量过高威胁水生生物生长、诱发鱼病[4]。近年来,利用有益微生物的代谢作用消除水体过量的氮取得了一定成效,如发现光合细菌(Rhodopseudomonassphaeroides)[5]、枯草芽孢杆菌(Bacillussubtilis)[6]、硝化细菌[7]、裂殖酵母菌(Schizosaccharomycessp.)[8]及短乳杆菌(Lactobacillusbrevis)[9]等均具有净化水质的作用。
乳酸菌是一类可代谢碳水化合物产生乳酸的革兰氏阳性细菌,能够在养殖动物肠道定殖,具有抑菌、提高免疫和促进生长的作用[10-11],常添加到饲料或泼洒到养殖水体中。针对鱼病爆发问题,渔源乳酸菌资源的筛选和应用备受关注,但是,乳酸菌对水质的作用效果还缺少足够的量化研究,严重限制了乳酸菌资源的深度开发利用。笔者自野生渔获物肠道中分离到抑菌型乳酸菌菌株,研究了不同渔源乳酸菌菌株去除养殖水体氨氮的效果,为益生菌在水产养殖环境的应用提供参考。
1 材料与方法
1.1 乳酸菌菌株分离
利用平板划线法,从野生和养殖的鲥鱼(Hilsareevesi)、沙丁鱼(Sardinopsmelanosticta)、褐牙鲆(Paralichthysolivaceus)、大菱鲆(Scophthalmusmaximus)等肠道内分离出渔源乳酸菌。采用MRS固体培养基加入1%溴甲酚紫染液,混匀后经120 ℃高压灭菌备用。菌株经溶钙圈法初步培养后,在溴甲酚紫染液的培养基划线,封口后置于37 ℃恒温箱培养48 h,进一步筛选革兰氏阳性、使溴甲酚紫由紫色变黄色的单菌落。利用牛津杯法检验菌株的抑菌效果,获得对金黄色葡萄球菌(Staphylococcusaureus)、鳗弧菌(V.anguillarum)、副溶血弧菌(V.parahemolyticus)有明显抑制效果的菌株。经过生理生化特征分析后,分别对菌株编号后进行16S rDNA鉴定,并利用Mega 6构建系统发育进化树,用邻接法基于核苷酸Kimura双参数模型构建系统发生树。
1.2 养殖海水制备及试验设计
从实验室养殖系统中获取鱼类养殖海水,水体中氨氮初始含量达0.28 mg/L。试验水温为25 ℃,盐度为35,pH为8.3。取1000 mL的锥形瓶,加入800 mL上述养殖海水,分别用单一菌株及4株菌的等量混合液处理。同时,每个处理分成2组,分别为添加10 mL菌体培养液组(G1组)和添加10 mL菌体培养液的离心菌体组(G2组),以不添加乳酸菌的处理为对照组(CG组),每个处理组设3个重复。试验初期在各处理组海水中乳酸菌菌体密度达107cfu/mL。分别于试验开始后的1、2、3、4、5 d取样,参照国家标准海洋监测规范(GB 17378.4—2007)第4部分海水分析的方法测定水体中氨氮的含量。
1.3 数据计算与处理
数据采用平均值±标准差表示,用SPSS 17.0 软件进行数据统计分析,不同处理组的氨氮水平比较分析采用单因子方差分析,采用Kolmogorov-Smirnov test进行正态分布检验,利用Levene′s test进行方差齐性检验,利用Duncan′s检验对数据进行比较分析,显著水平为0.05。
2 结果与分析
2.1 菌株鉴定结果
本研究得到对金黄色葡萄球菌、鳗弧菌、副溶血弧菌均具有明显抑制作用的菌株4株(编号分别为L8,L10,L11,L14)。所得4株菌株均为革兰氏阳性,能产生溶钙圈,使溴甲酚紫由紫色变为黄色。经生理生化特征及16S rDNA鉴定结果表明,菌株L8、L10、L11、L14分别为魏斯氏乳酸菌(Weissellaconfuse)、植物乳杆菌(L.plantarum)、粪肠球菌(Enterococcusfaecalis)、乳酸乳球菌(Lactococcuslactis)。筛选菌株的生理生化特征见表1,进化关系聚类分析见图1。
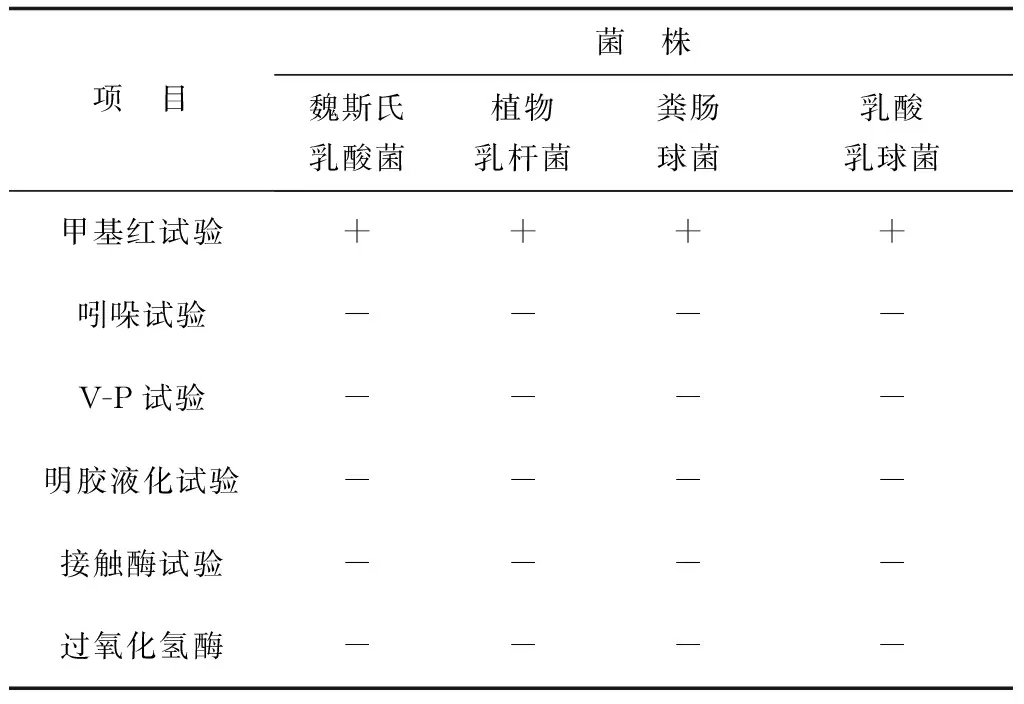
表1 分离菌株的生理生化特征
注:+表示阳性;-表示阴性.
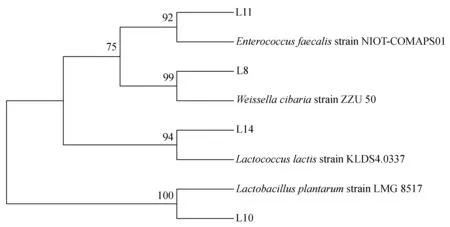
图1 基于16S rDNA的聚类分析图
2.2 单一乳酸菌菌株降解养殖水体氨氮的作用
试验期间,经4株乳酸菌菌株处理后,养殖海水中氨氮的含量显著低于空白对照组(P<0.05)。由图2~图5可知,不同乳酸菌的单菌株均能显著降低水体的氨氮含量,但降解能力存在差异。每个单一菌株处理的水体氨氮含量均在第1 d最高,接下来变化趋势相对稳定。在各处理组中,菌体营养液组和离心菌体组对氨氮的利用效果无显著性差异(P>0.05),其中,魏斯氏乳酸菌处理的水体24 h氨氮质量浓度降至0.15 mg/L和0.16 mg/L,降解率分别达41.48%和37.20%,至第5 d,养殖水体的氨氮质量浓度分别降至0.10 mg/L和0.10 mg/L,比对照组分别下降了30.52%和31.90%(图2);植物乳杆菌处理养殖水体24 h氨氮质量浓度分别降至0.15 mg/L和0.16 mg/L,降解率分别达35.10%和32.50%,截至第5 d,养殖水体氨氮水平分别降至0.08 mg/L和0.09 mg/L,比对照组分别下降44.50%和43.20%(图3);粪肠球菌处理的养殖海水氨氮质量浓度分别降至0.14 mg/L和0.15 mg/L,降解率分别达44.00%和42.10%,截至第5 d,养殖水体的氨氮水平降至0.08 mg/L和0.07 mg/L,比对照组分别下降45.10%和50.05%(图4);乳酸乳球菌处理水体经24 h后,水体氨氮质量浓度降至0.15 mg/L和0.16 mg/L,降解率分别达41.20%和36.40%,截至第5 d,水体的氨氮水平分别降至0.08 mg/L和0.09 mg/L,降解率为47.50%和43.20%,比对照组分别下降44.50%和41.60%(图5)。
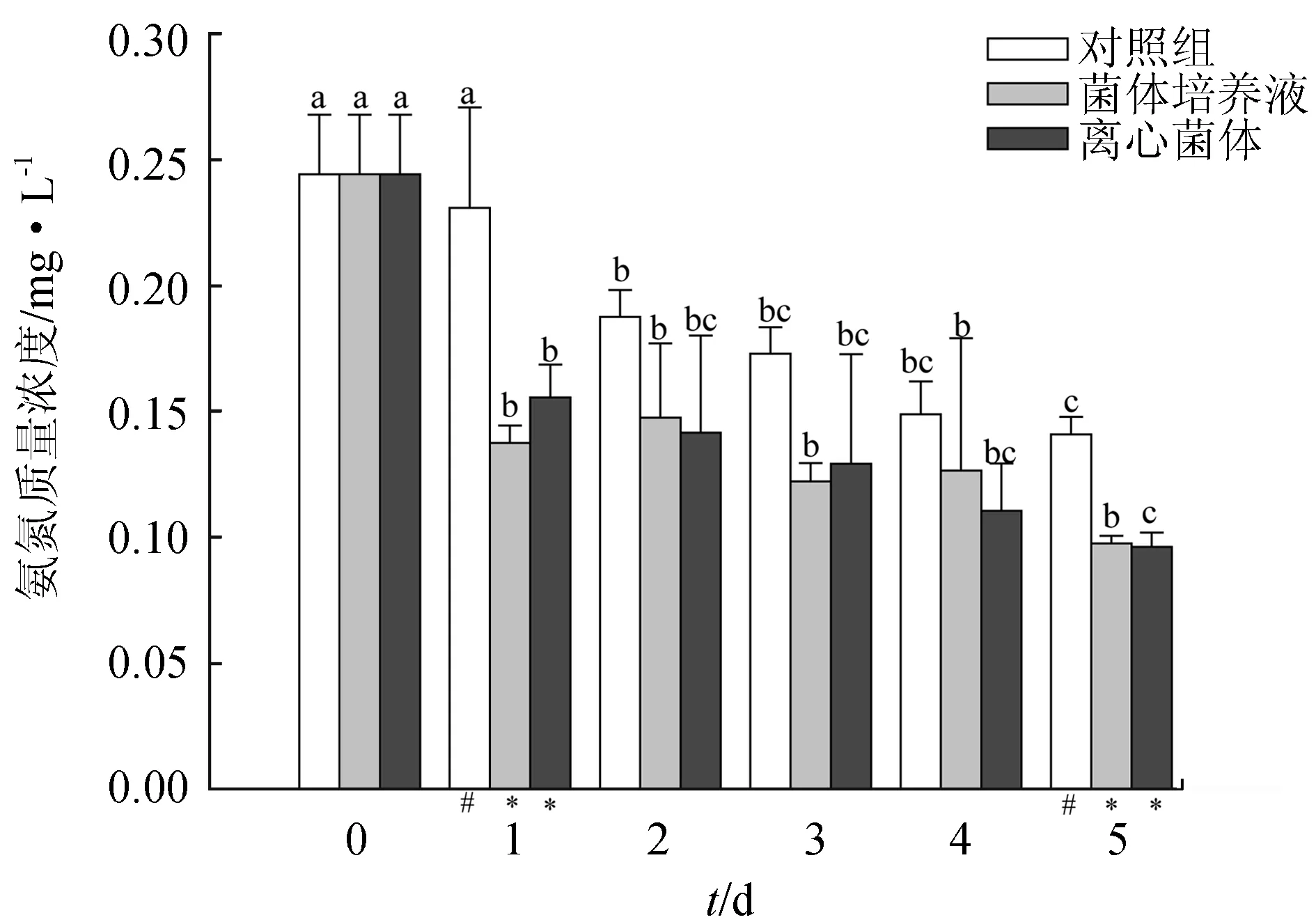
图2 魏斯氏乳酸菌对养殖水体氨氮的降解效果不同小写字母表示相同处理组不同时间差异显著;不同符号表示相同时间不同处理间差异显著(P<0.05).图3~图6同.
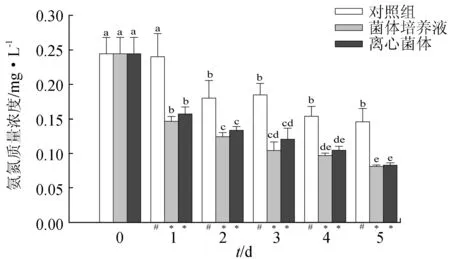
图3 植物乳杆菌对养殖水体氨氮的降解效果
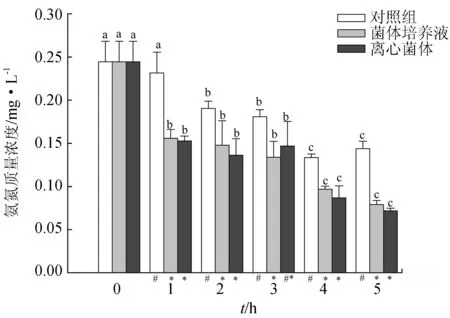
图4 粪肠球菌对养殖水体氨氮的降解效果
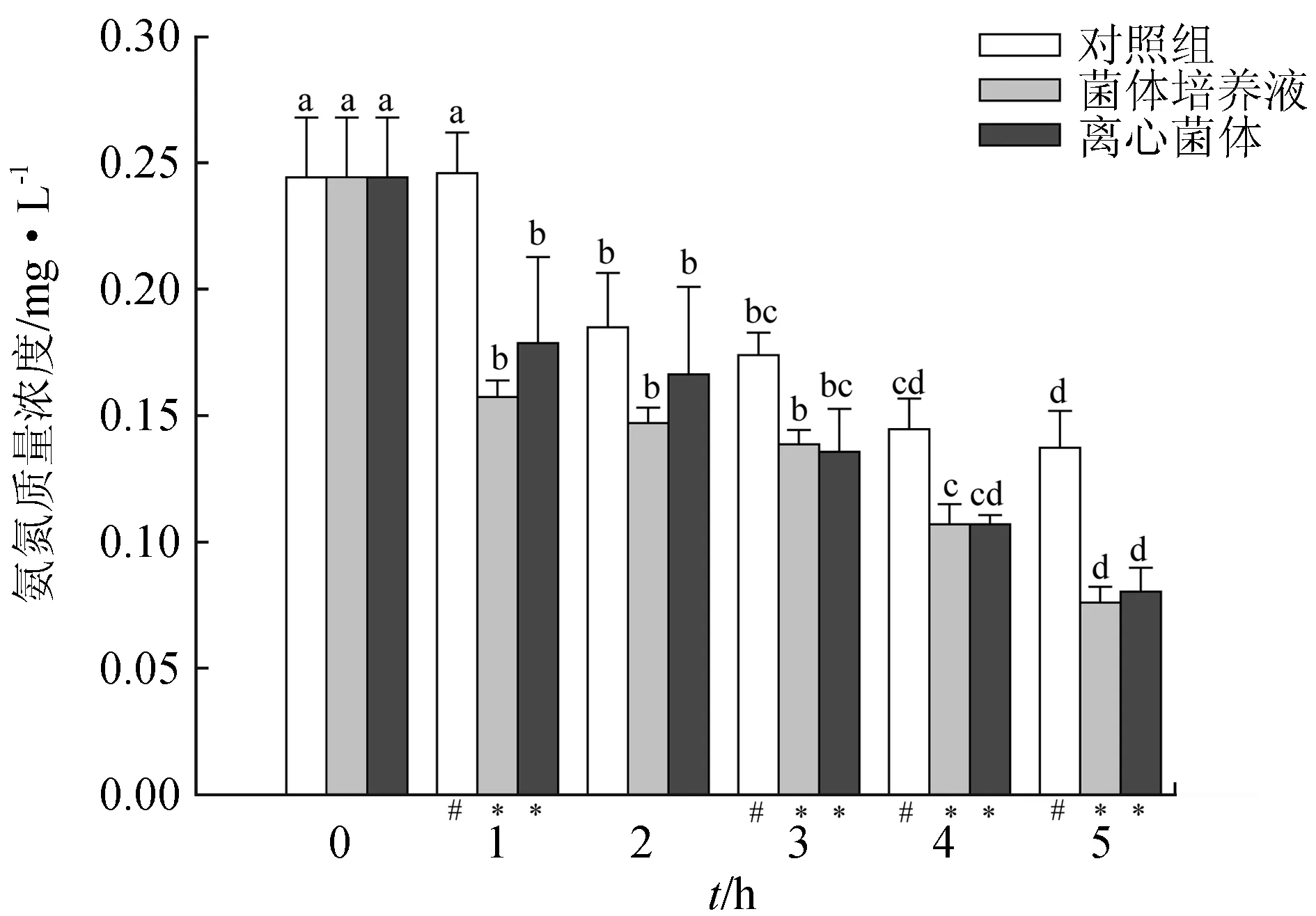
图5 乳酸乳球菌对水体中氨氮的降解效果
2.3 混合乳酸菌菌株降解养殖水体氨氮的作用
4株乳酸菌菌株等量混合后处理水体第1 d,菌体培养液组水体中氨氮质量浓度与对照组差异不显著(P>0.05),分别于第2 d和第4 d显著下降(P<0.05);而离心菌体组第1 d较空白对照组显著下降(P<0.05),之后维持稳定,至第4~5 d,再次显著下降(P<0.05)。截至第5 d菌体培养液组氨氮水平比空白组下降了37.70%,离心菌体组氨氮水平比空白组下降了40.20%,菌体培养液组和离心菌体组水体氨氮质量浓度变化差异不显著(P>0.05)(图6)。第5 d对照组水体的氨氮水平较第1 d下降22.60%。与单一菌珠相比,在试验的前2 d混合菌株处理组对氨氮的降解能力弱于单一乳酸菌。
3 讨 论
3.1 乳酸菌单菌株对水体氨氮的降解作用
乳酸菌不仅表现在鱼类肠道中维持有益菌群平衡,提高鱼类免疫机能[11],同时,在养殖水环境中维持足够的密度也能起到有效的水质净化效果。水环境中的氨氮是无机氮的主要形态,是导致水体富营养化和水质恶化的重要水质指标之一。水体中氨氮含量过高,会导致水产品品质下降甚至大量死亡。以往消除水产养殖水体过量氨氮的方法通常是利用沸石粉、硅胶、活性炭等吸附剂的吸附作用,利用微生物技术的生物脱氮是当前去除氨氮最经济有效的方法。相对于传统的物理和化学方法,生物脱氮主要利用生物自身代谢活动,通过硝化和反硝化过程实现快速脱氮[12]。基于硝化细菌的硝化作用的生物脱氮技术是当前污水处理的主攻方向,但是,由于硝化细菌培养难度大,能源消耗和运行成本高,开发高效节能的氨氮降解方法势在必行。当前,除了利用硝化细菌外,生产中还利用芽孢杆菌降解养殖水体中氨氮、亚硝酸盐含量,提高水体中残饵分解效率[13-15]。
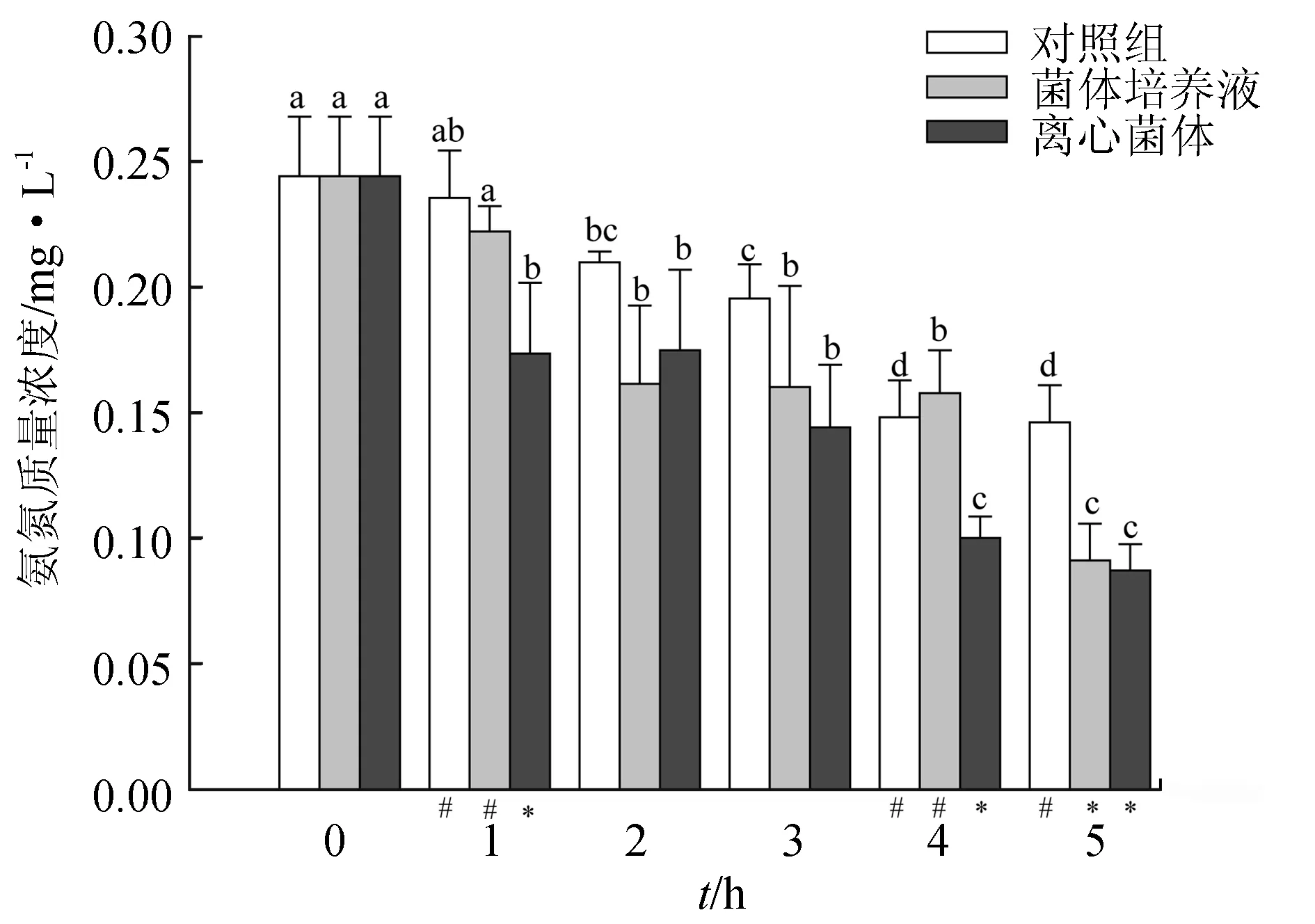
图6 混合乳酸菌菌株对水体中氨氮的作用效果
本试验中的魏斯氏乳酸菌、植物乳杆菌、粪肠球菌和乳酸乳球菌均属乳酸菌,是定殖在胃肠道的优势菌群,能促进动物生长、抑制病原菌、提高免疫力和成活率等[16-19]。这些菌株的应用主要体现在免疫调节、肠道健康、拮抗病原菌和产生天然抗生素等方面,尤其关注通过饲料添加在肠道中发挥作用。水产养殖中的施用方式主要有饲料添加和水池泼洒,而对于乳酸菌在水环境中的作用机理研究还不足。研究发现,自水产环境中分离的植物乳杆菌对亚硝酸盐具有净化去除作用[20];乳酸菌对亚硝酸盐的去除作用机理包括直接化学反应作用和间接推动微生物的反硝化作用[21]。本研究中的4种乳酸菌在分别添加离心菌体和菌体营养液后均表现出显著降解养殖废水氨氮的作用, 1 d内养殖水体氨氮降解率分别达41.48%和37.20%,35.10%和32.50%,23.90%和29.27%,29.70%和23.90%。本试验中乳酸菌消除氨氮的作用可能体现在对亚硝酸盐的利用间接推动了硝化作用,也可能由于菌株产生的酶系对氮源的利用。乳酸菌对水体氨氮去除作用的机理还有待深入研究,以便针对性开展菌株驯化与应用。张博[22]研究发现,枯草芽孢杆菌、地衣芽孢杆菌(B.licheniformis)、短小芽孢杆菌(B.pumilus)等在24 h之内对氨氮的降解率高达75%。本研究中的4株渔源乳酸菌在24 h内对养殖水中氨氮的降解率变化范围为23.90%~41.50%,低于上述芽孢杆菌。这可能与不同细菌代谢活性、使用环境及使用量有关。芽孢杆菌在环境中的抗逆性强,而乳酸菌活菌数量易受环境变化的影响[23]。本试验中的单株乳酸菌对氨氮的降解速率第1 d较高,在第2~5 d时降解速率较平缓。这可能是由于第1 d时菌量较多,活力较强,但乳酸菌的生命周期较短,加上对水中营养物质的消耗,1 d后对水体中氨氮利用能力下降。在水质调控应用中,需要根据水体中菌量及水体营养状况控制益生菌的用量。本试验对照组自身氨氮水平出现下降,属于水系统在物理、化学和生物作用下的自我净化[24],但其自净能力明显低于微生物处理组。本研究中的乳酸菌能明显而快速地降低养殖用水的氨氮,但不同水体环境下的具体施用量、施用方法、施用时间等还需根据水体及养殖生物的实际情况综合考量。目前尚缺少对魏斯氏乳酸菌的系统性研究,有研究发现,魏斯氏乳酸菌可能参与了宿主体内纤维素的降解过程,并且其对蜡样芽孢杆菌(B.cereus)和大肠杆菌(Escherichiacoli)等的抑制特性,使得其在食品加工保存领域有潜在的应用价值[25]。有研究表明,粪肠球菌属于条件致病菌,但其致病性是多功能多因子协同作用的结果,不同来源菌株携带的毒力因子不尽相同。另外,粪肠球菌也是经国家农业部许可的饲用微生物添加剂之一,可作为一种益生菌在食品工程和畜禽养殖等领域得到应用[26],但在水产养殖中应用报道极少。本试验关于魏斯氏乳酸菌和粪肠球菌在水体中的作用效果研究尚属首次报道,有必要深入开展以上菌株针对不同宿主动物的益生作用研究与论证,明确体外环境和体内免疫的协同调节机制,实现在水产环境中的应用。
3.2 乳酸菌复配菌株对水体氨氮的降解作用
传统经验认为,多种菌株的复配可实现效果叠加[27],硝化细菌与枯草芽孢杆菌复合制剂对草鱼(Ctenopharyngodonidellus)养殖水体的净化效率明显提高,并优化了水体的菌群结构[28]。有些复合益生菌能够增加水体中微生物种类组成和丰度,提升代谢作用,改良水环境[29]。然而,本试验4株菌株的混合液对氨氮降解效果和单一菌株相比无显著差异,甚至稍弱于单一菌株。本试验中的菌株均为抑菌型乳酸菌,不同菌株分泌的抑菌物质不同,可能由于菌群在系统内的竞争,削弱了总体效果。乳酸菌为异养型细菌,利用水体中的有机含氮物质,在厌氧或兼性厌氧条件下生长。因此,可考虑与反硝化细菌、光合细菌及芽孢杆菌复配调控水体。施大林等[30]研究发现,由光合细菌、芽孢杆菌、乳酸菌、硝化细菌组成的四联活菌对氨氮和亚硝酸盐的降解效率明显高于单一菌株。由此可见,益生菌组合制剂并非菌种复配越多越好,需要根据菌株本身特性(如革兰氏阳性和革兰氏阴性,好氧和厌氧或兼性厌氧)及营养源(自养型和异养型)互补需求开展复配研究。本研究为渔源乳酸菌在养殖水环境的调控作用及应用提供依据,然而,乳酸菌对养殖水环境调节与对养殖动物免疫的协同作用的机理,还需进一步探讨。
