铜绿假单胞菌YY24的异养硝化—好氧反硝化功能基因的研究
2018-07-24李连星薄香兰陈继楚周胜杰王立红陈成勋
刘 兴,李连星,薄香兰,陈继楚,周胜杰,王 军,王立红,陈成勋
( 1.天津农学院,天津市水产生态及养殖重点实验室,天津 300384; 2.天津立达海水资源开发有限公司, 天津 300280; 3.鼎正动物药业(天津)有限公司,天津市饲用微生物制剂企业重点实验室,天津 300383 )
近年来,诸多关于异养硝化—好氧反硝化菌研究已见报道,但其研究重点仍然聚焦在可行性分析运用上的宏观脱氮效果,针对异养硝化—好氧反硝化分子机制,即微观方面的研究却依然鲜见。异养硝化菌在脱氮过程中是通过硝化过程和反硝化过程两个步骤完成的,每个过程都有不同的酶参与。硝化过程主要由氨单加氧酶和羟胺氧化酶参与[1];反硝化过程中主要由硝酸盐还原酶、亚硝酸还原酶、一氧化氮还原酶、一氧化二氮还原酶发挥效应[2]。
铜绿假单胞菌(Pseudomonasaeruginosa) YY24是在天津立达海水资源开发有限公司海水养殖池筛选获得的脱氮高效细菌,研究结果表明,该菌在最佳生长条件下的氨氮去除率可达99.06%,脱氮率达到97.27%[3]。笔者以铜绿假单胞菌YY24为研究对象,就铜绿假单胞菌YY24的9种硝化反硝化基因进行PCR扩增、鉴定及测序,从分子水平对铜绿假单胞菌YY24的异养硝化—好氧反硝化分子机制进行研究。
1 材料与方法
1.1 菌种及培养基
铜绿假单胞菌YY24保存于本实验室,已测出的16S rDNA部分基因序列长度为1428 bp(NR_037000.1)[3]。YY24用30%甘油保存于-80 ℃冰箱中,使用时提前1 d活化培养。
异养硝化培养基:NH4Cl 0.5 g/L;柠檬酸钠5.66 g/L;维氏盐溶液50 mL;调节pH到7.0。
维氏盐溶液:K2HPO45.0 g/L;MgSO4·7H2O 2.5 g/L;FeSO4·7H2O 0.05 g/L;MnSO4·4H2O 0.05 g/L;盐度为15的海水(NaCl 15)。
所有培养基于121 ℃灭菌15 min,待培养基冷却至室温再使用。
1.2 主要仪器与试剂
1.2.1 主要仪器
Eppendorf梯度PCR仪(Mastercycle公司),SN-NJ0601电泳凝胶成像分析系统(北京信诺莱伯仪器有限公司),DYCP-44N快速凝胶电泳仪(北京市六一仪器厂),SW-CJ-2FD超净工作台(苏州安泰空气技术有限公司),FA2104 1/1000电子天平(天津亿诺科学仪器有限公司),THX-83B恒温摇床(常州市国立实验设备有限公司),BS-lE震荡培养箱(金坛市环宇科学仪器厂),UVmini-1240紫外可见分光光度计(东莞市塘厦众和电子仪器设备商行),LEGEND MACH 1.6R台式高速冷冻离心机(Thermo公司),METTLER TOLEDO台式pH计(上海升隆电子科技有限公司),TOMY SX500高压蒸汽灭菌锅(上海麦森医疗科技有限公司),Leica DM500光学显微镜(德国徕卡微系统有限公司)。
1.2.2 主要试剂
EB染色剂(TaKaRa)、TAE核酸电泳缓冲液(TaKaRa)、琼脂糖(TaKaRa)、TE缓冲液(TaKaRa)、rTaq DNA Polymerass(TaKaRa)、10×PCR Buffer(Mg2+plus,TaKaRa)、dNTP Mixture(2.5 mol/L,TaKaRa)、DL 2000 DNA Marker(TaKaRa)、6×Loading Buffer(TaKaRa)。其他试剂均为分析纯级。
1.3 试验方法
1.3.1 DNA提取
DNA提取方法按照天根生化科技(北京)有限公司的细菌基因组DNA提取试剂盒说明书进行操作。
1.3.2 凝胶DNA回收
使用无菌的解剖刀对目的片段进行切割,然后利用天根生化科技(北京)有限公司出产的普通琼脂糖凝胶DNA回收试剂盒,进行目的片段的纯化,按其说明书进行操作。
1.3.3 试剂配制
DL 23000 Marker:5 μL DL 2000 Marker+12.5 μL 6×Loading Buffer+57.5 μL TE缓冲液+0.8%的琼脂糖凝胶,在60 ℃下预热5 min,即可制成。
引物的稀释:将引物放在4 ℃、12 000 r/min的离心机中离心5 min;将离心管轻慢打开,按标签上的要求加入去离子水,并稀释至20 nmol;而后轻摇混匀,3000 r/min离心,使液体降至管底;引物置于-20 ℃下保存。
制胶过程:称取0.2 g琼脂糖,放入20 mL 1×TAE;放置在微波炉中加热1 min,取出,加入2 μL EB染料,混匀,倒入模具中冷却25 min,即可制成。
1.3.4 反应体系
反应体系见表1。

表1 PCR反应体系
1.3.5 试验步骤
第一步,进行细菌的培养(LB培养基);第二步,使用细菌基因组DNA提取试剂盒提取细菌DNA,并凝胶电泳检验DNA提取含量;第三步,使用已合成的特异性引物进行PCR扩增,并在凝胶成像系统中观察记录;第四步,使用普通琼脂糖凝胶DNA回收试剂盒进行切胶回收,再次进行PCR扩增;第五步,送金唯智生物科技有限公司检测序列。
1.4 铜绿假单胞菌YY24硝化反硝化酶基因PCR反应条件的确定
1.4.1 引物
YY24硝化反硝化酶基因鉴定所用引物:根据美国国立生物技术信息中心公布的9种假单胞菌属的硝化反硝化基因序列,利用Primer Premier 5.0设计合成9对简并性扩增引物(表2)。引物由上海生工生物工程股份有限公司合成。

表2 鉴定YY24硝化反硝化酶基因的引物
续表2

目的基因引物名称引物序列(5'→3')目的产物大小/bpnirS[15]nirS 1F5'-CCTA(C/T)TGGCCGCC(A/G)CA(A/G)T-3'nirS 2R5'-CGTTGAACTT(A/G)CCGGT-3'890cnorB[15]cnorB 1F5'-CGNGARTTYCTSGARCARCC-3'cnorB 2R5'-CRTADGCVCCRWAGAAVGC-3'669qnorB[15]qnorB 1F5'-GGNCAYCARGGNTAYGA-3'qnorB 2R5'-GGNGGRTTDATCADGAANCC-3'637nosZ[15]nosZ 1F5'-CGYTGTTCMTCGACAGCCAG-3'nosZ 2R5'-CATGTGCAGNGCRTGGCAGAA-3'700nifHnifH 1F5'-GAACTCGGCAAGAAGGTCAT -3'nifH 2R5'-CGTAGAAGACGAAGTCCAGGT-3'292
1.4.2 PCR扩增
PCR扩增反应体系见表3。

表3 PCR反应体系
amoA的PCR程序:预变性95 ℃ 5 min,变性95 ℃ 60 s,退火50 ℃ 45 s,延伸72 ℃ 45 s,共30个循环,74 ℃ 10 min。
nifH的PCR程序:预变性94 ℃ 5 min,变性94 ℃ 60 s,退火53 ℃ 45 s,延伸72 ℃ 45 s,共30个循环,74 ℃ 10 min。
napA的PCR程序:预变性94 ℃ 5 min,变性94 ℃ 60 s,退火41 ℃ 45 s,延伸72 ℃ 45 s,共30个循环,74 ℃ 10 min。
narG的PCR程序:预变性95 ℃ 5 min,变性95 ℃ 60 s,退火40 ℃ 45 s,延伸72 ℃ 45 s,共30个循环,74 ℃ 10 min。
nirK的PCR程序:预变性94 ℃ 5 min,变性94 ℃ 60 s,退火56 ℃ 45 s,延伸72 ℃ 45 s,共30个循环,74 ℃ 10 min。
nirS的PCR程序:预变性95 ℃ 5 min,变性95 ℃ 60 s,退火50 ℃ 45 s,延伸72 ℃ 45 s,共30个循环,74 ℃ 10 min。
nosZ的PCR程序:预变性温度94 ℃ 5 min,变性温度94 ℃ 30 s,退火温度50 ℃ 45 s,延伸温度72 ℃ 60 s,共30个循环,72 ℃ 10 min。
qnorB的PCR程序:预变性95 ℃ 5 min,40个循环包括变性94 ℃ 60 s,退火50 ℃ 45 s,延伸72 ℃ 45 s,最后72 ℃ 10 min。
cnorB的PCR程序:预变性94 ℃ 4 min,变性94 ℃ 60 s,退火55 ℃ 45 s,延伸72 ℃ 60 s,共30个循环,72 ℃ 10 min。
PCR扩增的产物,通过琼脂糖凝胶电泳初步检测后,拍照保存,切胶回收,送至天津金唯智生物科技有限公司测序,并将结果在美国国立生物技术信息中心数据库进行在线比对。
1.4.3 统计方法
测序由金唯智生物科技有限公司完成,将测序结果提交GenBank数据库检索,根据Blast同源性比对的结果,用Mega 4.0进行分析多序列比对,从核酸数据库中下载具有代表性且同源性高的各基因氨基酸序列。
2 结果与分析
2.1 铜绿假单胞菌YY24硝化酶氨单加氧酶基因类型的确定
为确定铜绿假单胞菌YY24氨单加氧酶的基因类型及其是否具有硝化功能,对amoA的部分基因序列进行PCR扩增,结果见图1。

图1 铜绿假单胞菌YY24氨单加氧酶amoA基因电泳图
由产物大小判断,引物amoAF-amoAR得到了目的片段,片段长度为491 bp。通过克隆、测序后得到的amoA部分序列如下:

经在线比对,序列长491 bp的amoA序列提交GenBank,序列号为CP019005.1。通过Blast在GenBank中进行核酸比对,结果显示,铜绿假单胞菌YY24的amoA基因与大肠杆菌(Escherichiacoli)的同源性最高,达到86%。amoA与其他氨单加氧酶基因具有较高的相似性,因而可以确定铜绿假单胞菌YY24具有硝化作用的功能基因amoA。
2.2 铜绿假单胞菌YY24反硝化酶基因类型的确定
2.2.1 硝酸还原酶Nar基因类型的确定
为确定铜绿假单胞菌YY24的硝酸还原酶基因类型,分别用引物napAF-napAR和narGF-narGR进行PCR扩增,结果见图2。
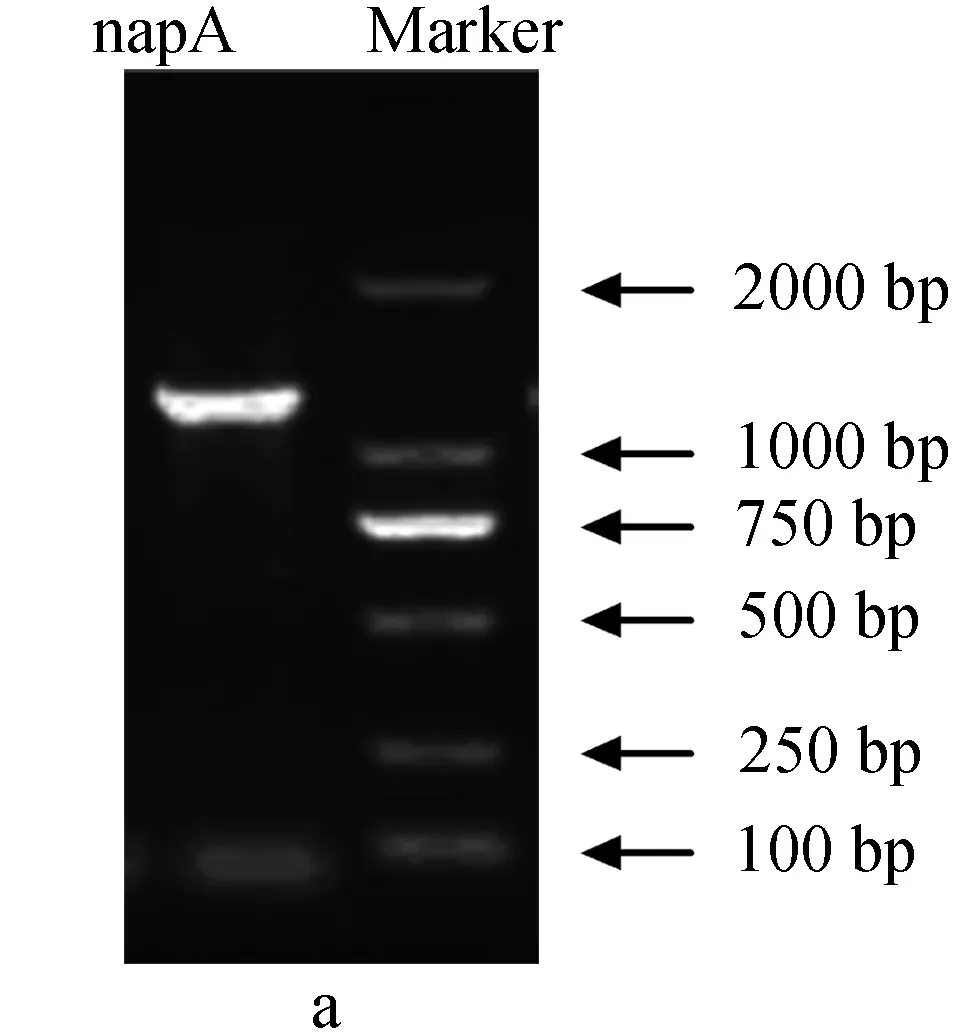
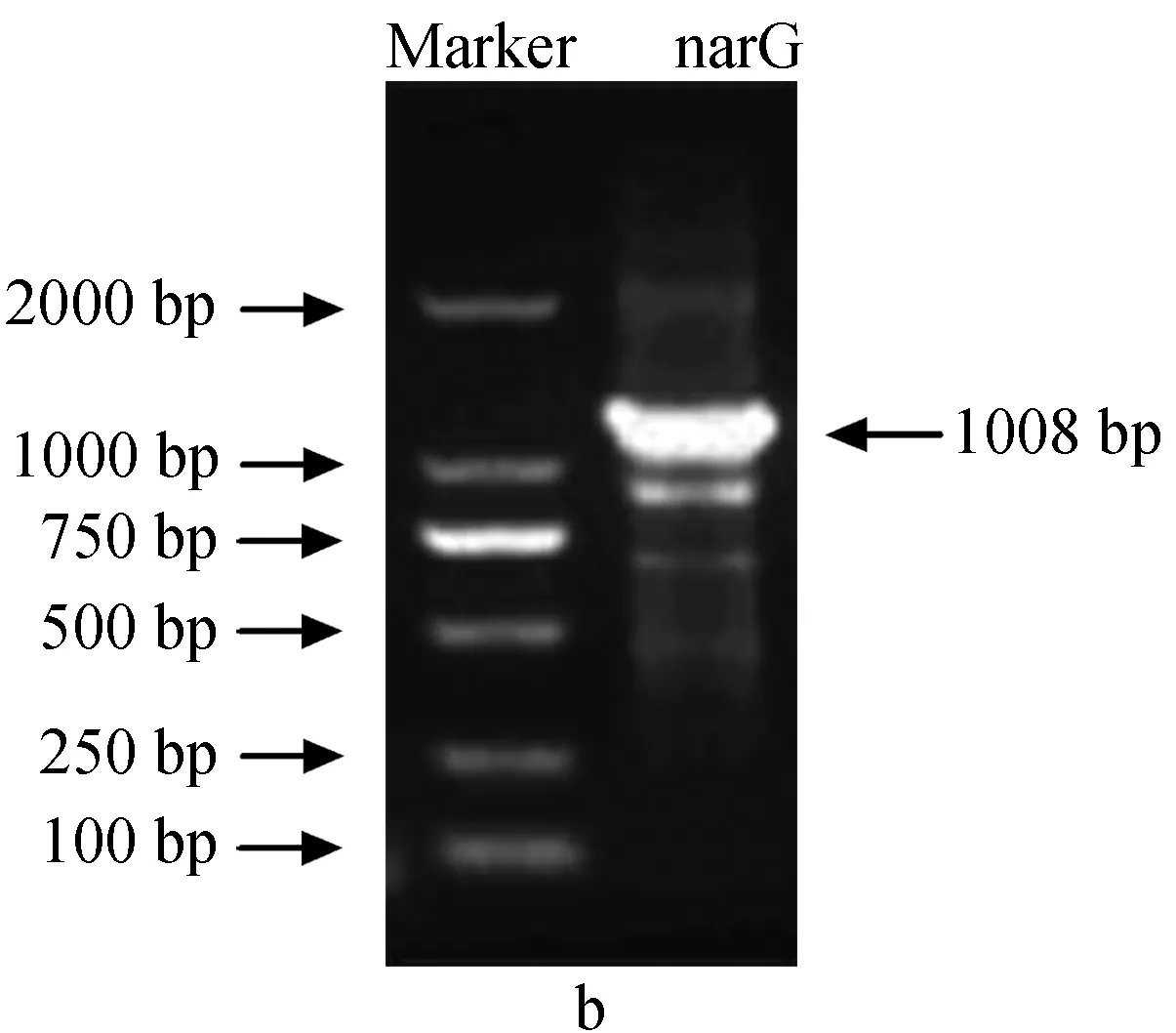
图2 铜绿假单胞菌YY24硝酸还原酶基因电泳a:周质硝酸盐还原酶基因; b:膜结合硝酸盐还原酶基因.
由产物大小判断,引物narGF-narGR得到了目的片段,而引物napAF-napAR未得到目的片段(目的产物应为890 bp,而实际超过了1200 bp)。在第一次PCR后发现,得到的narG条带含有非特异性条带,因此又以第一次PCR扩增产物为模板进行了第二次PCR后,切胶回收目的DNA条带,通过克隆、测序后得到的narG部分序列如下:

经在线比对,序列长1008 bp的narG序列提交GenBank,序列号为CP003071.1。通过Blast在GenBank中进行核酸比对,结果显示,铜绿假单胞菌YY24的narG基因与斯氏假单胞菌(P.stutzeri) RCH2的同源性最高,达到95%。narG与其他膜结合硝酸还原酶基因具有较高的相似性,因而可以确定铜绿假单胞菌YY24的硝酸还原酶基因是narG,而不是napA。
2.2.2 亚硝酸还原酶Nir基因类型的确定
为确定铜绿假单胞菌YY24的亚硝酸还原酶基因类型,分别用引物nirSF-nirSR和nirKF-nirKR进行PCR扩增,结果见图3。
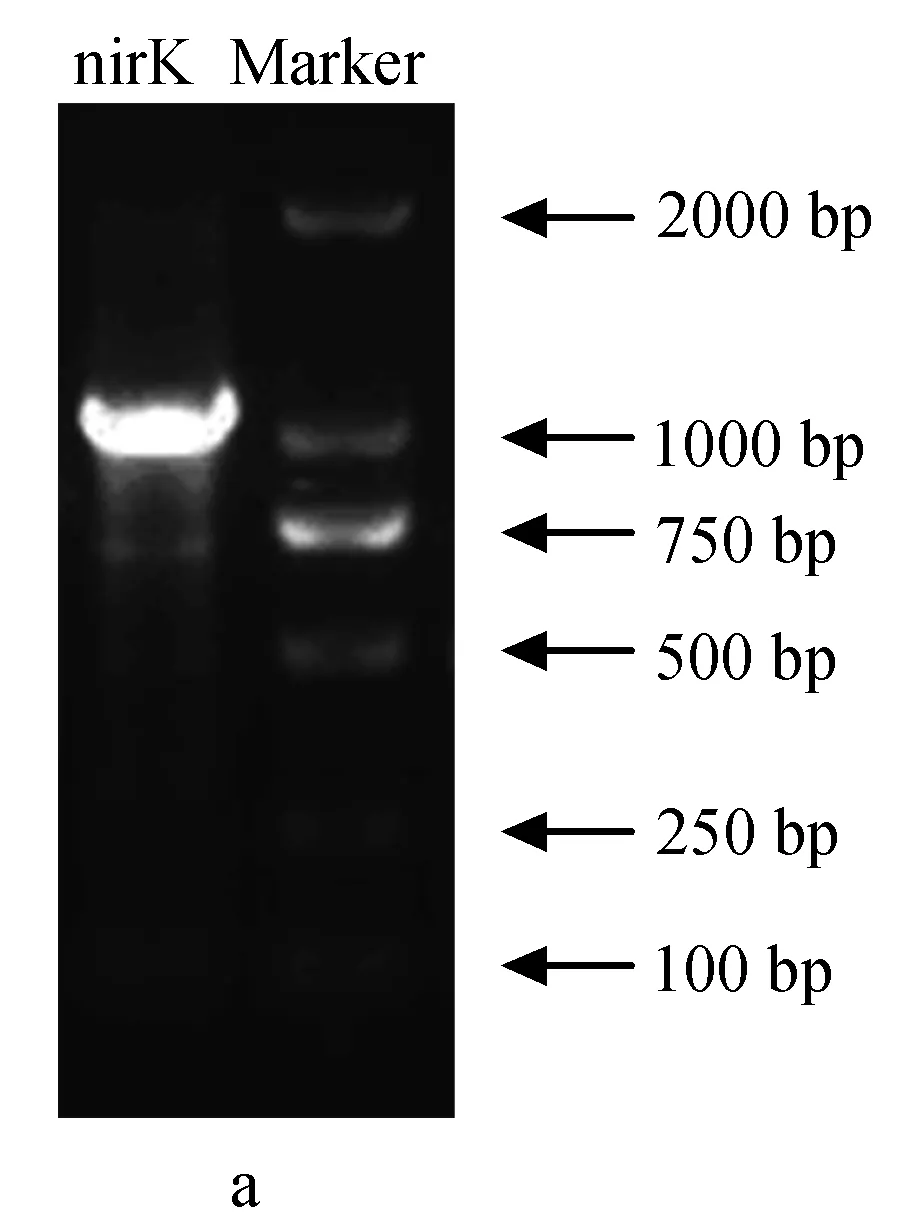

图3 铜绿假单胞菌YY24亚硝酸还原酶基因电泳a:含铜型亚硝酸还原酶基因; b:细胞色素cd1型亚硝酸盐还原酶基因.
由产物大小判断,引物nirSF-nirSR得到了目的片段,引物nirKF-nirKR未得到目的片段(目的产物应为514 bp,而实际约为1000 bp)。通过克隆、测序后得到的nirS部分序列如下:


序列长度通过Blast在GenBank中进行核酸比对,结果显示,铜绿假单胞菌YY24的nirS基因与现已报道的nirS基因序列有极大差别,导致利用引物对nirSF-nirSR不能扩增出目的片段。将引物序列及两端序列去掉,在Blast中megablast中尚未找到相似序列,但在Blastn中能够找出相似度不高的序列,仅与微小链霉菌(Streptomycesparvulus) strain 2297有94%的相似度(序列号CP015866.1)。nirS与其他亚硝酸盐还原酶基因不具有较高的相似性,但是其确实存在,因而初步断定铜绿假单胞菌YY24的亚硝酸盐还原酶基因是nirS,而不是nirK。
2.2.3 一氧化氮还原酶基因类型的确定
为确定铜绿假单胞菌YY24亚硝酸还原酶的基因类型,分别用引物qnorBF-qnorBR和cnorBF-cnorBR进行PCR扩增,结果见图4。
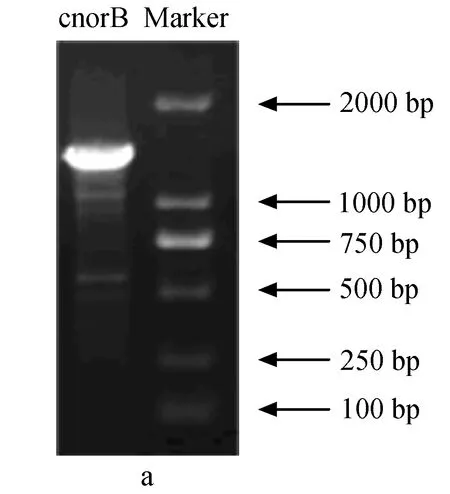
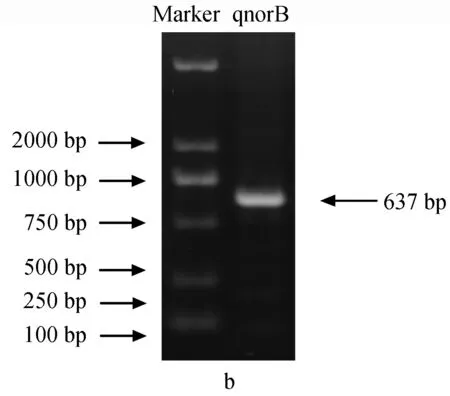
图4 铜绿假单胞菌YY24一氧化氮还原酶基因电泳a:cnorB基因; b:qnorB基因.
由产物大小判断,引物qnorBF-qnorBR得到了目的片段,引物cnorBF-cnorBR未得到目的片段(目的产物应为669 bp,而实际超过1000 bp)。在第一次PCR后发现,得到的qnorB条带含有非特异性条带,因此又以第一次PCR扩增产物为模板进行了第二次PCR后,切胶回收目的DNA条带,通过克隆、测序后得到的qnorB部分序列如下:

经在线比对,序列长637 bp的qnorB序列提交GenBank,序列号为CP000446.1。通过Blast在GenBank中进行核酸比对得知,铜绿假单胞菌YY24的qnorB基因与希瓦氏菌(Shewanellasp.) MR-4的同源性最高,达到90%。对比发现,qnorB与其他一氧化氮还原酶基因具有相似度较高,因此可以确定铜绿假单胞菌YY24的一氧化氮还原酶基因是qnorB,而不是cnorB。
2.2.4 一氧化二氮还原酶基因的确定
为确定铜绿假单胞菌YY24一氧化二氮还原酶的基因类型,用引物nosZF-nosZR对一氧化二氮还原酶的部分基因序列进行PCR扩增,结果见图5。

图5 铜绿假单胞菌YY24一氧化二氮还原酶基因电泳
由产物大小可以判断出,引物nosZF-nosZR经PCR后,得到了目的片段,片段长度为700 bp。通过克隆、测序后得到的nosZ部分序列如下:

经在线比对,序列长700 bp的nosZ序列提交GenBank,序列号为AY957390.1。通过Blast在GenBank中进行核酸比对,结果显示,铜绿假单胞菌YY24的nosZ基因与斯氏假单胞菌的同源性最高,达到99%。nosZ与其他一氧化二氮还原酶基因具有较高的相似性,因而可以确定铜绿假单胞菌YY24的一氧化二氮还原酶基因是nosZ,主要产物是N2。
3 讨 论
3.1 铜绿假单胞菌YY24硝化关键酶基因研究
氨单加氧酶是氨氮氧化成亚硝酸盐的硝化作用中限制性步骤的关键酶[4]。氨单加氧酶是细菌体内的一种三聚体膜结合蛋白,由amoA、amoB和amoC编码的3个亚基组成[5],其中amoA被公认为该酶的活性位点,可将氨氧化为羟胺[6]。有研究发现,amoA基因在所有自养硝化菌中均有发现,并且由于菌株的不同,导致其amo基因也存在较大差异。异养硝化菌中是否含有氨单加氧酶基因可以通过PCR手段来判断[7]。本试验利用兼并引物amoAF-amoAR[8]对铜绿假单胞菌YY24 DNA样品进行PCR扩增的结果显示,与铜绿假单胞菌YY24的amoA相似度最高的为大肠杆菌的氨氧化基因,且只有86%,与其他氨单加氧酶相似性也不高。因此,可以确定铜绿假单胞菌YY24的amoA序列具有较强特异性,氨单加氧酶于其他脱氮细菌也有较大差异。研究发现,氨单加氧酶不仅在不同属的脱氮细菌中,而且在相同属不同细菌中差异性也较显著。Cao等[9]通过研究不同水体中6200条脱氮细菌氨单加氧酶amoA序列发现,不同环境中细菌的amoA序列有显著差异。Van Kessel等[10]研究发现,amoA基因序列能够执行完整的硝化作用,打破了传统的分步硝化理论。本试验通过对铜绿假单胞菌YY24中amoA基因片段的PCR扩增的试验研究,确定了铜绿假单胞菌YY24中存在amoA基因,为后续研究铜绿假单胞菌YY24除氮功能提供参考依据。
3.2 铜绿假单胞菌YY24反硝化酶基因研究
硝酸盐还原酶催化反硝化反应的第一步,硝酸盐还原酶主要有周质硝酸还原酶和膜结合硝酸还原酶两种存在形式。周质硝酸盐还原酶是一种二聚体类物质,由NAPA和NAPB两个亚单位结构组成。napA基因负责编码大亚基NAPA,而napB基因负责编码小亚基NAPB[11];周质硝酸还原酶基因操纵子除了napA和napB基因之外,还存在1个napC基因。在有氧或者无氧条件下,由基因napA编码的Nap催化中心部位均可实现其功能,且优先表达于有氧条件下。膜结合硝酸盐还原酶是由3个亚基组成的多体蛋白,结合在细胞膜的胞质侧[12],分别由基因narG、narH和narI编码,其中硝酸盐还原作用位点及活性中心是narG编码的α亚基。研究证明,周质硝酸还原酶基因与膜结合硝酸还原酶基因没有关联,即相互独立,互不影响[13]。铜绿假单胞菌YY24可能存在一种在好氧条件下仍具有活性的硝酸盐还原系统,所以自身菌体可以利用NO3-在好氧条件下合成NO2-,因此推测这个酶可能是周质硝酸盐还原酶。笔者希望通过铜绿假单胞菌YY24大亚基基因napA的存在来证明该菌中存在硝酸盐还原系统,所以利用引物napAF-napAR,通过PCR扩增和测序,试验发现在铜绿假单胞菌YY24中未获得了napA的特异片断,这与报道的硝化反硝化菌(Acinetobactersp.)YY-5[14]不同,该菌株检测出了napA的特异片断。分析其可能原因是引物未选对或者退火温度没有达到要求。其后,利用另一种硝酸盐还原酶nar基因narG的引物narGF-narGR进行扩增和测序,发现铜绿假单胞菌YY24含有narG的特异片断,测序结果表明它与斯氏假单胞菌RCH2的同源性最高,达到95%。综上所述,铜绿假单胞菌YY24存在膜结合硝酸盐还原酶nar,不存在周质硝酸盐还原酶nap,推测铜绿假单胞菌YY24在缺氧环境中仍具有还原硝酸盐的功能。
亚硝酸盐转化为一氧化氮的反应是由亚硝酸盐还原酶催化的,该反应是反硝化作用的标志性反应,同时反硝化过程中最重要的限速步骤也是由亚硝酸盐还原酶催化的这一反应。亚硝酸盐还原酶的存在方式主要有2种:细胞色素cd1型亚硝酸盐还原酶和含铜型亚硝酸还原酶,分别由nirS基因和nirK基因编码[15]。Braker等[16]认为,nirS和nirK基因不会在同一菌株中同时出现,但是在同属不同种的菌株中可以存在。本试验利用设计两对引物nirSF-nirSR和nirKF-nirKR对铜绿假单胞菌YY24的DNA样品进行PCR扩增结果显示,未检测出nirK的特异片断,检测出nirS的特异片段,通过Blast在GenBank中进行核酸比对,与铜绿假单胞菌YY24的nirS相似度最高的是微小链霉菌strain2297的脱氮基因,但只有94%,与其他亚硝酸盐还原酶相似性也不是较高。研究表明,自然界中有30%的反硝化菌含有nirK基因,而假单胞菌中绝大多数含有nirS基因,并且在不同菌株中其形态结构和分子大小相似,其中分布较多的是含nirS基因的细菌[17]。这一结论就是本试验的最好佐证,本试验所用菌株为铜绿假单胞菌,检测出其亚硝酸还原酶的类型为细胞色素cd1型亚硝酸盐还原酶nirS。
一氧化氮还原酶催化NO转化为N2O的反应,目前发现主要有2种:(1) cNor是一种由norB和norC基因编码的2个亚基组成的异源二聚体寡聚酶,可用c型细胞色素作为电子供体;(2) qNor属于单体酶,由qnorB基因编码。研究表明,cnorB基因与qnorB基因相比并未表现出更高的多样性[18],同源性分析显示,qNor与cNor有很高的同源性。常在有氧或者无氧条件下表达,在高含氧量和低pH值的环境中为反硝化的主要产物N2O。本试验利用设计两对引物qnorBF-qnorBR和cnorBF-cnorBR对铜绿假单胞菌YY24的DNA样品进行PCR扩增结果显示,未检测出cnorB的特异片断,检测出qnorB的特异片段,通过Blast在GenBank中进行核酸比对,与铜绿假单胞菌YY24的qnorB相似度最高的是希瓦氏菌MR-4的固氮基因,但只有90%,与其他一氧化氮还原酶相似性不高。铜绿假单胞菌B136-33的norB基因能够在表达菌BL21中得到正确有效的表达[19],这一报道从侧面反映了铜绿假单胞菌具有norB基因,只是还未进行更深层次的探索。综上所述,本试验不仅证实了铜绿假单胞菌YY24存在一氧化氮还原酶norB,能够将NO催化转化为N2O,而且还确定了其基因类型是qnorB,并不是cnorB。
只有nosZ这一种基因可以编码能够将N2O还原成N2的一氧化二氮还原酶,其是反硝化作用最后一步反应的关键酶,郑燕等[20]研究环境样品中反硝化细菌的功能标志基因是nosZ。一氧化二氮还原酶是一种可溶性含铜离子蛋白酶,位于膜外周质中,编码nos的基因由3个转录单元组成:nosZ、nosR和nosDFYL,其中,结构基因最大的是nosZ基因,常用来编码催化亚基[21],在低氧或缺氧条件下易表达,易受低pH值的抑制,对氧的敏感性也高于其他脱氮菌。本试验利用设计的引物nosZF-nosZR对YY24的DNA样品进行PCR扩增结果显示,检测出nosZ的特异片段(700 bp),通过Blast在GenBank中进行核酸比对,与铜绿假单胞菌YY24的nosZ相似度最高的是斯氏假单胞菌的nosZ基因,达99%。目前关于一氧化二氮还原酶的研究主要集中在酶学性质及结构方面,在细菌方面的报道还较少,目前仅在假单胞菌、芽孢杆菌(Bacillus)以及海杆菌(Mycobacterium)等少数几种细菌中证实了nosZ的存在[22]。本试验也证实了杨立志等[22]的报道,通过对铜绿假单胞菌YY24中nosZ基因片段的PCR扩增的试验研究,确定了铜绿假单胞菌YY24中存在nosZ基因,对后续研究铜绿假单胞菌YY24反硝化功能提供参考依据。
4 结 论
(1)确定amoA基因为铜绿假单胞菌YY24硝化关键酶氨单加氧酶的编码基因。
(2)确定铜绿假单胞细菌YY24存在膜结合硝酸盐还原酶;亚硝酸还原酶的类型为细胞色素cd1型亚硝酸盐还原酶nirS;铜绿假单胞菌YY24存在一氧化氮还原酶norB,能够将NO催化转化为N2O,而且还确定了其基因类型是qnorB;铜绿假单胞菌YY24中存在nosZ基因。
