miR-222调控PARP-1在高糖致人肾脏系膜细胞tPA/PAI-1紊乱中的作用
2018-07-23朱恒梅祝胜郎陈结慧杨芸李金艳
朱恒梅 祝胜郎 陈结慧 杨芸 李金艳
糖尿病肾病(DN)是一种以肾小球系膜增宽及小球硬化为特征的疾病,是导致终末期肾病的主要原因之一[1]。组织型纤溶酶原激活物/纤溶酶原激活物抑制物-1(tPA/PAI-1)是主要的纤溶酶原/纤溶酶系统,不仅能直接降解细胞外基质,还能激活金属蛋白酶间接降解细胞外基质,在糖尿病肾小球硬化中发挥重要作用[2]。多聚二磷酸腺苷核糖聚合酶(PARP)是一类能选择性识别并结合DNA缺口的DNA结合蛋白酶[3-5]。笔者前期研究显示,高糖可通过过度激活PARP诱导tPA/PAI-1功能紊乱,促进细胞外基质增生,提示其在糖尿病病程中可能发挥重要作用[6-8]。微小核糖核酸(miR)是一类高度保守的非编码单链RNA分子,约由22个核苷酸组成,能与靶基因3’-非编码区特异性结合,在转录后水平调控基因的表达,从而导致靶mRNA降解和翻译阻遏。既往研究显示,多种miR在糖尿病中异常表达[9-12]。目前研究发现,miR-222是重要的肿瘤相关基因,调控肿瘤细胞周期、增殖及侵袭[13]。近期有研究表明,miR-222可能参与糖尿病的发生[14-15]。Neijenhuis等[16]报道,hsa-miR-222能增强PARP-1抑制剂对癌细胞PARP-1的敏感性。因此,本研究以人肾脏系膜细胞(HMC)作为研究对象,探讨miR-222在高糖致tPA/PAI-1紊乱中对PARP-1的调控作用。
材料与方法
一、 材 料
人HMC由吴斯佳硕士惠赠。D-Glucose购自Sigma公司,miR-222模拟物(miR-222 mimics)hsa-miR-222成熟体序列(5’-AGCUACAUCUGGCUAC-UGGGU-3’)、阴性对照(5’-AAAAGAGACCGGUUCACUGUGA-3’)均购于上海吉玛生物公司;miR VanaTMPARlSTM试剂盒购自ABI公司、iScripTM模板DNA合成试剂盒购自BIO-RAD公司、QPCR荧光定量试剂盒购自Takaka公司。细胞培养用RPMI 1640培养基、胎牛血清购自Gibco公司;胰岛素购自甘李药业,Trizol试剂盒购自Invitrogen公司;细胞裂解液、辣根过氧化物酶(HRP)标记的兔抗大鼠二抗购自Cell Signaling公司,兔抗大鼠PARP-1一抗购自Chemicon公司;tPA、PAI-1 ELI-SA试剂盒购自上海太阳生物技术有限公司;逆转录试剂盒购自Fermentas公司,Taq DNA聚合酶购自Takaka公司。其余化学试剂为国产分析纯。
二、方 法
1.靶基因预测
Targetscan生物学信息网站预测PARP-1是人miR-222的靶基因,并找出其可能结合的位点,见图1。

图1 hsa-miR-222与PARP-13’-非翻译区结合的位点
2.细胞培养及分组
HMC培养于含有15%胎牛血清及0.6 U/ml胰岛素的RPMI 1640培养基中。细胞培养至85%融合后,换用无血清培养基培养24 h,后换用新鲜无血清的DMEM培养基,并分成4组:正常糖(5 mmol/L)组、高糖(25 mmol/L)组、高糖+miR-222 mimics阴性对照组、高糖+miR-222 mimics组。
3.miR-222表达水平的检测
采用实时定量PCR检测高糖(25 mmol/L葡萄糖)刺激24 h下HMC的miR-222表达,采用正常培养基(含5 mmol/L葡萄糖)培养HMC的作对照,每组设3个样品,每份样品重复检测3次。先利用miR VanaTMPARlSTMKit提取包括miR在内的总RNA。采用iScripTM模板DNA合成试剂盒逆转录为模板DNA,然后使用QPCR荧光定量试剂盒进行定量PCR,每份样本设3个复孔,具体按说明书操作,最后使用ABI750实时定量PCR仪检测miR-222的相对表达量。
4.目的miR的转染
转染前1日,2 ml无抗生素培养基中接种(2.5~10)×105个HMC,待细胞融合度达到70%后,准备转染。使用250 μl Opti-MEM低血清培养基稀释4 μg目的miR(所有对照组加入等量的无菌水)并轻轻混匀;250 μl Opti-MEM低血清培养基稀释10 μl Lipofectamine 2000转染试剂,轻轻混匀后室温静置5 min,将稀释好的目的miR及转染试剂溶液混合(总体积500 μl),轻轻混匀并室温下静置20 min,每孔中加入500 μl混合液,十字交叉法摇动细胞培养板使溶液与培养基充分混匀,置入37 ℃、5%CO2培养箱培养24 h后,更换新鲜培养基,再转移入培养箱继续培养24 h。
5.PARP-1含量的检测
按实验分组将HMC转染miR-222 mimics阴性对照组及miR-222 mimics,使用蛋白免疫印迹法检测24 h后PARP-1蛋白表达。收集各组细胞用磷酸盐缓冲液(PBS)清洗后加入细胞裂解液, 冰上放置5 min。用细胞刮刮取细胞,收集至1.5 ml Eppendorf管中,放置于冰上。用超声粉碎仪在冰上进行超声粉碎,500 W、1 s共15次,剪切DNA,降低黏稠度。4 ℃、12 000转/分离心10 min,留取上清液。取10 μl上清液测定浓度,余储存于-80℃备用[1-2]。上述上清液加蛋白载样缓冲液,煮沸10 min,瞬时高速离心,分别取不同样品的总蛋白50 μg经10%聚丙烯酰胺凝胶电泳(SDS-PAGE)后,电转移至聚丙氟乙烯(PVDF)膜上,用5%脱脂奶粉溶液室温封闭1 h, 加入PARP-1的抗体,4 ℃过夜。洗膜后,再加HRP标记的二抗,室温孵育1 h,洗膜后进行显色,曝光于X线胶片上,图像分析系统进行灰度扫描,用Fluor Chem 8900软件将图片上每个特异条带灰度值数字化。以 β-actin为内参,用目的蛋白条带灰度值与内参灰度值的比值代表目的蛋白的相对表达含量[12]。
6.tPA、PAI-1含量的检测
细胞培养液上清液中tPA、PAI-1的含量按照ELISA试剂盒(上海太阳生物技术有限公司)说明书步骤检测[1-2]。
三、统计学处理
结 果
一、高糖刺激下HMC细胞miR-222的表达
实时定量PCR显示,高糖组HMC在24 h时miR-222 mRNA表达水平是正常糖组的(2.537±0.216)倍,组间比较差异有统计学意义(t=12.325,P<0.001)。
二、miR-222对HMC细胞PARP-1表达的影响
多组间比较差异有统计学意义(F=15.934,P<0.001),其中高糖组HMC中PARP-1蛋白表达高于正常糖组(P<0.05),高糖+miR-222 mimics组HMC中PARP-1蛋白表达低于高糖组(P<0.05),而高糖+miR-222 mimics阴性对照组与高糖组比较差异无统计学意义(P>0.05),见图2。
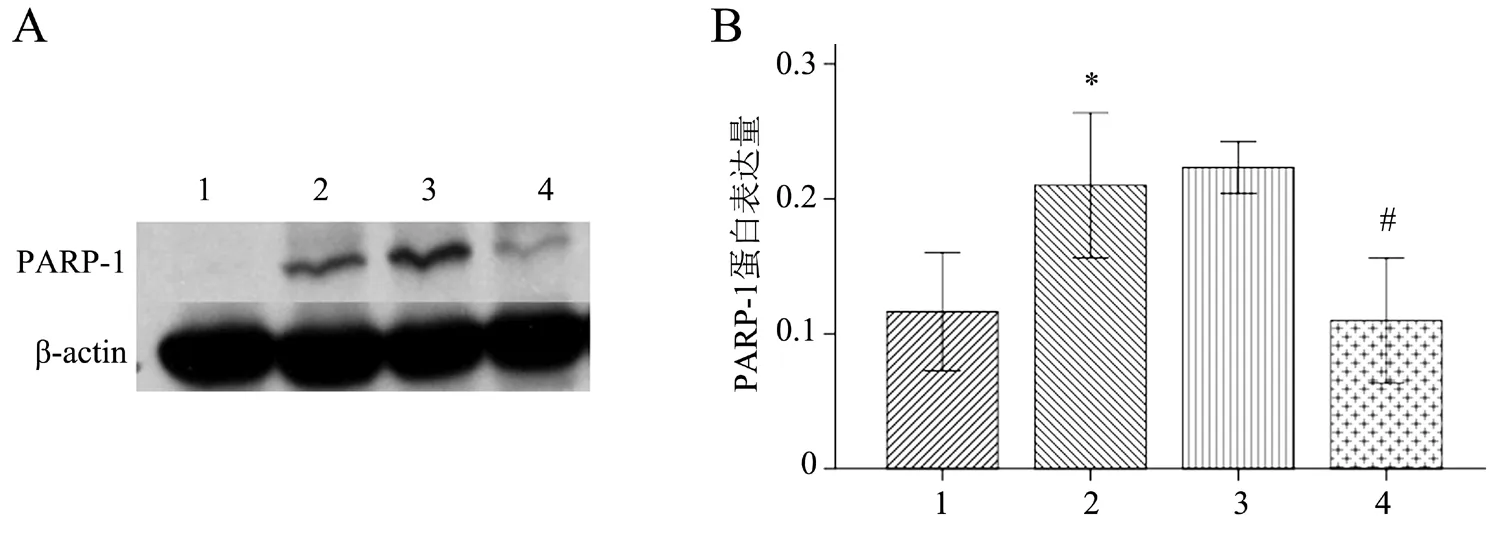
图2 miR-222对HMCk PARP-1蛋白表达的影响
三、miR-222对HMC细胞上清液tPA及PAI-1蛋白表达的影响
多组间比较差异有统计学意义(FtPA=56.846、FPAI-1=127.385、FtPA/PAI-1=94.947,P均<0.001),其中与正常糖组比较,高糖组的tPA和tPA/PAI-1降低、PAI-1升高(P均<0.05);与高糖组比较,高糖+mimics组的tPA和tPA/PAI-1升高、PAI-1降低(P均<0.05)。高糖+miR-222 mimics阴性对照组与高糖组tPA、PAI-1及tPA/PAI-1比较差异均无统计学意义(P均>0.05),见图3。
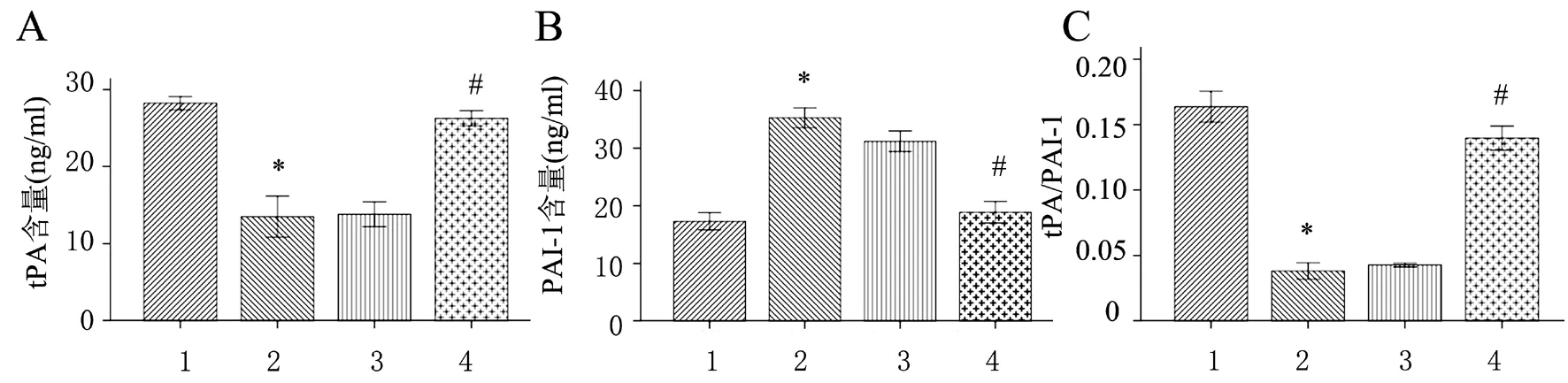
图3 miR-222对HMC细胞上清液tPA/PAI-1的影响
讨 论
DN是糖尿病主要的并发症之一,是发达国家终末期肾病的首要病因,也是我国终末期肾病的第二大病因,社会危害性极大。DN以肾小球系膜基质增宽及毛细血管基底膜增厚为主要特征。DN的发病过程中,细胞外基质(ECM)堆积是其病理损害的关键。tPA/PAI-1是一对主要的纤溶酶原/纤溶酶系统,PAI-1是tPA的天然的抑制剂。糖尿病时,tPA/PAI-1功能紊乱,可下调tPA表达,上调PAI-1表达,遏制纤溶系统的功能,减少纤溶酶酶原活化,从而减少纤维蛋白/纤维蛋白原降解,抑制ECM降解,在糖尿病ECM沉积中发挥重要作用[17]。笔者前期研究表明,高糖刺激大鼠肾小球系膜细胞分泌的tPA蛋白有所下降,PAI-1蛋白明显增加,tPA/PAI-1比值降低,证实糖尿病时tPA/PAI-1功能紊乱[6]。
早期研究报道参与调节多种肿瘤发生的miR-222,近年也有较多报道证实其参与糖尿病的调节。有研究表明,2型糖尿病及妊娠期糖尿病患者外周血miR-222-3p明显下调[18-19]。另一研究显示,2型糖尿病患者外周血miR-222明显上调[20]。Li等[21]报道,选择性下调miR-10a、miR-139b、miR-206和miR-222的表达,糖尿病和高脂血症诱导的炎症反应可以上调联接蛋白connexin和Rho激酶的表达。Lightell等[15]报道,增加细胞外信号调节激酶1/2活性可反应性上调miR-221和miR-222,并促进糖尿病中的新内膜增生。Tsukita等[22]研究显示,miR-106b和miR-222有助于骨髓移植胰腺B细胞增殖,并改善胰岛素缺乏型糖尿病小鼠模型中的高血糖症。Neijenhuis等[16]研究亦显示,hsa- miR-222过表达可抑制RAD51表达,损害细胞同源重组功能,进而增加对PARP抑制剂olaparib的敏感性。
PARP是一类能选择性识别并结合DNA缺口的DNA结合蛋白酶。主要分布于细胞核内,少量分布于细胞浆内。PARP-1是由1 014个氨基酸组成的多肽链,分子量为113 kDa。它是PARP家族中含量最丰富,也是最重要的成员[23]。笔者前期研究表明,PARP-1存在于肾小球系膜细胞中,高糖诱导肾小球系膜细胞PARP-1生成增加,同时下调tPA/PAI-1比值,并上调ECM4型胶原、纤连蛋白的表达;PARP-1特异性抑制剂(PJ34)能下调PARP-1表达,同时部分逆转上述因子的改变[6-7]。PARP-1还参与了血管紧张素Ⅱ诱导的肾小球系膜细胞PAI-1与纤连蛋白表达[8]。上述研究表明,PARP-1是DN发病机制中的一个重要因子。
本研究显示,高糖可上调HMC的miR-222,提示miR-222可能参与调节糖尿病的发生、发展。研究通过对HMC细胞转染miR-222 mimics,有效下调其靶蛋白PARP-1的表达,进一步表明miR-222可靶向调节PARP-1。研究还显示,HMC细胞转染miR-222 mimics,可明显改善tPA/PAI-1表达的紊乱。因此,miR-222可能过靶向调控PARP-1基因促进系膜细胞纤溶酶原/纤溶酶系统的紊乱,这为DN发展的可能分子机制提供了新的科学依据。
