IL-17在局部及全身的致关节炎作用:从发现到靶向治疗
2018-07-23莫颖倩毕瑜斐戴冽PierreMiossec
莫颖倩 毕瑜斐 戴冽 Pierre Miossec
促炎症细胞因子IL-17近年才被全面认识,即已成为众多慢性炎症性疾病的重要治疗靶点[1-2]。IL-17在宿主防御细胞外细菌感染及真菌感染中起关键作用[3]。IL-17还参与多种炎症性疾病的致病过程,包括银屑病、银屑病关节炎、类风湿关节炎(RA)、强直性脊柱炎(AS)等。首个靶向IL-17的抗体在2015年获批用于治疗银屑病。目前其他IL-17通路抑制剂正就不断增加的临床适应证而进行临床试验[4]。该文综述了IL-17从发现到明确局部及全身的致关节炎作用、再到临床靶向IL-17治疗炎症性关节病的全过程,不仅给临床医生阐明了一种新的治疗选择,而且呈现了一个很好的、从基础到临床的“转化医学”案例。
一、IL-17的发现
1. IL-17的发现过程及生物学活性
IL-17基因及IL-17蛋白作为啮齿类动物T细胞的产物于1993年被首次发现,当时被命名为细胞毒性T细胞相关抗原(CTLA)-8。最早报道的人IL-17生物学活性是其对RA滑膜细胞和来自健康人正常皮肤成纤维细胞的作用,揭示IL-17可诱导IL-6和IL-8的产生。这些最初的研究结果很快将IL-17的活性与炎症及中性粒细胞生物学特性联系起来,前者是指产生IL-6(炎症及宿主防御中的主要细胞因子),后者是指产生IL-8——CXC趋化因子受体(CXCR)-2的趋化配体,介导中性粒细胞招募到组织[4]。
随后研究表明,成年RA患者滑膜组织体外培养产生具有活性的IL-17。当把RA滑膜培养的上清液加入到正常滑膜细胞培养基中,IL-6产生增多;再加入IL-17特异性抗体,IL-6产生降低2/3。该关键研究首次使用现有的拮抗人IL-17的单克隆抗体,显示IL-17可作为慢性炎症的治疗靶点。此外,该研究还揭示了单用IL-17对滑膜细胞产生IL-6的作用有限,但协同IL-1和TNF可增加IL-6的产生。这些早期发现提示,RA滑膜产生的IL-17协同其他已知的刺激因子导致IL-6的产生,即细胞因子之间常见的协同作用[5]。
后续研究逐渐阐明活性IL-17的主要生物学作用,包括:①促进内皮细胞、上皮细胞、成纤维细胞、巨噬细胞及树突状细胞分泌炎症因子,如前述的IL-6和IL-8,从而介导炎症;②促进内皮细胞分泌组织因子等,从而介导血栓形成;③促进巨噬细胞或树突状细胞分泌基质金属蛋白酶(MMP),促进软骨细胞释放一氧化氮,从而介导软骨破坏;④促进成骨细胞分泌核转录因子-κB配体受体激动剂(RANKL),从而促进破骨细胞形成及骨侵蚀,见图1[4]。
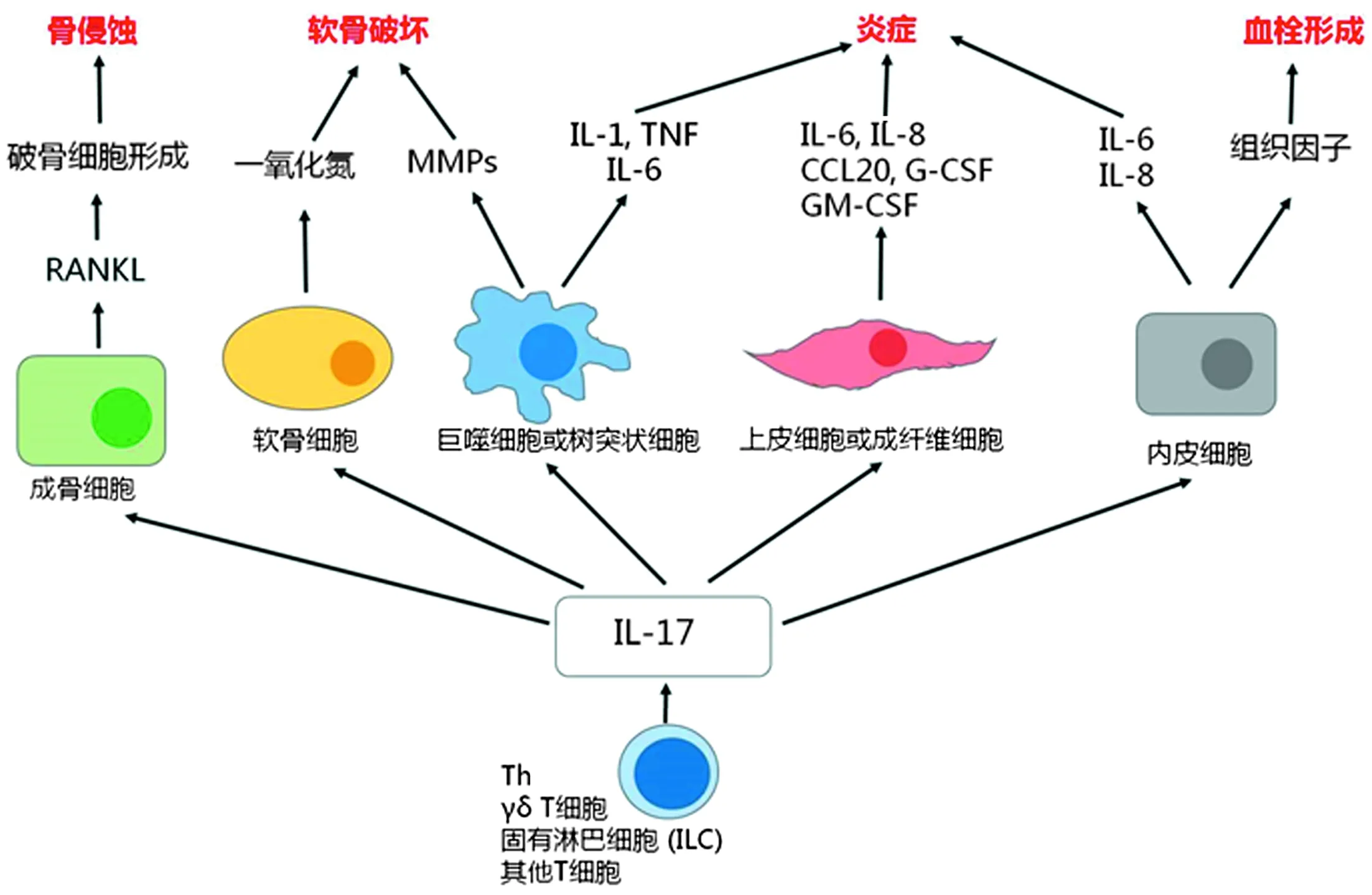
图1 活性IL-17的主要生物学作用
2. IL-17的结构和功能
IL-17分子是一个二聚体,由2个单体通过分子内二硫键连接半胱氨酸残基而成。现有文献中提到的IL-17是IL-17A,但通常被称为IL-17,是IL-17家族的首个成员。IL-17家族由IL-17A到IL-17F等6个成员组成,所有成员都包含羟基端半胱氨酸残基。IL-17A和IL-17F是IL-17家族的主要成员,主要由辅助性T细胞17(Th17)产生。IL-17F是IL-17家族中首个可形成结晶的成员,其分子的二聚体含胱氨酸结,类似于神经生长因子受体家族中的胱氨酸结。IL-17F与IL-17A有50%的序列一致性,IL-17F二聚体多与IL-17A共表达,IL-17F也可与IL-17A呈现为IL-17A-IL-17F的异二聚体结构。虽然单用IL-17F诱导炎症的活性通常低于IL-17A,但当协同TNF时IL-17F的诱导活性增强[5]。
然而,炎症小鼠模型的结果提示IL-17F与IL-17A的某些促炎症功能并不一致[6]。例如,在一个由Th2细胞驱动的哮喘模型中,基因敲除IL-17F小鼠的肺部中性粒细胞炎症较敲除IL-17A小鼠大幅减轻[6]。此外,基因敲除IL-17F减轻实验性结肠炎,而基因敲除IL-17A加重疾病[6]。但在滑膜细胞中,尚无基因被确认是仅由IL-17F特异性诱导而无IL-17A参与[5]。这些结果使IL-17F作为单独靶点或与IL-17A联合作为靶点的应用被质疑。显然,在人体以及炎症实验模型中IL-17A和IL-17F存在不同效应,仍有待进一步研究。
二、Th17的发现
T细胞产生的细胞因子如IL-17不能根据Th1-Th2体系进行分类[7]。优先表达IL-17且不表达IFN-γ或IL-4的T细胞,被命名为Th17细胞。这些T细胞构成独特的体系,因此目前Th分为3种:Th1、Th2和Th17[8]。正如Th1和Th2,Th17细胞也产生一组独特的细胞因子:IL-17A、IL-17F、IL-22和IL-21,这些细胞因子均参与调控特定类型的炎症反应。在关节炎滑膜及活化的外周血单个核细胞中,IL-17+细胞表现出类似浆细胞的形态。
体外试验中,即使调控Th1和Th2细胞形成的关键转录因子存在基因缺陷,IL-23仍可促进Th17细胞增多,这个现象表明Th17有别于Th1和Th2。然而,IL-23诱导出Th17的发现引出了一个难题。因为初始T细胞不表达IL-23受体,因此即使加入IL-23,高度纯化的初始T细胞仍不能分化为Th17细胞。那么Th17细胞是如何分化产生的呢?
3个独立团队同时发现转化生长因子-β(TGF-β)协同IL-6诱导初始T细胞分化为Th17,使这一难题有了新的转机。这项发现令人震惊,因为TGF-β既往被归类为免疫抑制因子,并非T细胞分化诱导因子。此外,初始T细胞单独暴露于TGF-β后表达叉头状转录因子(Foxp)3——一种诱导调节性T细胞(抑制炎症和自身免疫的T细胞)的主要转录因子。一项相关研究表明,IL-6是TGF-β介导产生Foxp3+调节性T细胞的强抑制因子。IL-6不仅抑制这些细胞的生成,并且协同TGF-β促进初始T细胞表达IL-17及分化为Th17。因此,Th17和Foxp3+调节性T细胞相互制约。TGF-β诱导初始T细胞分化成抑制炎症的调节性T细胞,而IL-6逆转TGF-β始动的这一过程,诱导产生Th17,见图2[2]。
IFN-γ和IL-4分别由Th1和Th2细胞产生,通过自分泌环放大细胞分化效应。相比之下,IL-17既不是Th17细胞的生长因子又不是其分化因子,故不能放大Th17细胞的分化效应。然而,IL-21——IL-2细胞因子家族中的成员之一,由成熟Th17细胞大量分泌,协同TGF-β放大Th17的分化效应。IL-21缺乏时Th17细胞的扩增也存在缺陷。总之,Th17也存在自分泌环,其中主要因子是TGF-β和IL-21。
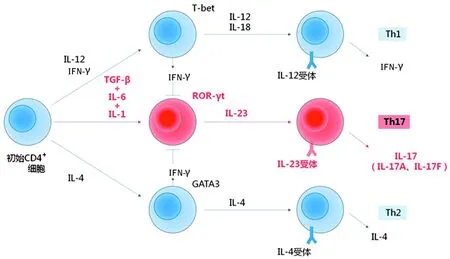
图2 小鼠Th17细胞的分化
间充质细胞和免疫细胞的相互作用是局部产生促炎症细胞因子的关键,并影响细胞生存[9]。在银屑病中,Th17细胞浸润炎症部位,并作用于局部间充质细胞,包括皮肤成纤维细胞。但与IL-8、IL-6 和IL-1β不同,仅有细胞接触不足以诱导大量IL-17分泌到上清液,提示产生IL-17需要2种信号,即细胞接触和T细胞受体活化。此外,Transwell侵袭小室试验证实IL-17的产生需要成纤维细胞和T细胞的直接接触[10]。
三、IL-17对骨的作用
RA过度骨破坏及骨修复缺陷导致大量关节破坏;而在AS中,过度异位骨形成导致韧带骨赘形成,伴全身骨量丢失[11]。上述2种疾病中,IL-17水平升高提示其对骨丢失有作用。IL-17A被认为是治疗RA和AS的新靶点[12]。既往研究显示,加入IL-17A抑制剂或TNF-α抑制剂,或更好是两者联用,可降低RA体外模型的骨丢失。
IL-17A促进骨丢失的机制主要是刺激破骨细胞形成,直接作用或通过促进基质细胞表达RANKL和巨噬细胞集落刺激因子(M-CSF)。IL-17A还可诱导靶细胞(如RA-FLS)产生促炎症细胞因子,如IL-6、IL-1、CXCL8、TNF和MMP[13]。另一方面,TNF-α通过增加wnt通路抑制因子Dickkopf1(DKK-1)表达而抑制骨形成、通过Smad泛素调节因子(Smurf)1和NF-κB降解骨形成蛋白(BMP)-2而诱导骨丢失[14]。破骨细胞可见于关节局部(如RA、银屑病关节炎)、椎骨及肌腱嵌入骨局部(如AS)。IL-17A因此参与RA、银屑病关节炎的关节局部大量骨丢失,并参与RA、银屑病关节炎、AS及常见骨质疏松症的全身骨丢失。在雌激素缺乏诱导骨质疏松的小鼠模型中,抑制IL-17表现出显著的骨保护作用[15]。一项重要的新发现是IL-17A可作用于Schunnri3(Shn3)[16]。Shn3缺乏的小鼠出现骨量增加。鼠间充质干细胞中Shn3通过诱导Runx2泛素化而直接抑制成骨细胞性骨形成,间接促进破骨细胞性骨吸收[17]。单用TNF-α或协同IL-17A早期增加RA-FLS的Shn3 mRNA表达,从而抑制成骨[18]。
某些研究结果与传统的骨丢失作用相反,提示IL-17A和TNF-α也可能增加骨形成[19-23]。TNF-α和IL-17A协同促进间充质干细胞分化为成骨细胞,表现为细胞外基质钙沉积和碱性磷酸酶活性增加[16]。肌腱和韧带不存在破骨细胞,但存在间充质干细胞的成骨分化,从而导致肌腱和韧带的新骨形成。初步研究提示,AS大鼠模型中抑制IL-17可减少新发异位骨形成[1]。
四、IL-17靶向治疗
体外细胞、患者组织及动物模型研究为IL-17靶向治疗人类疾病提供了强有力的理论依据,致力于控制慢性炎症相关的损伤和(或)疼痛。IL-17抑制剂近年被注册用于治疗银屑病、AS和银屑病关节炎[24]。目前靶向IL-17通路主要有2种选择,一是直接靶向IL-17或其受体,二是靶向Th17细胞分化调控的上游,见图3[1]。

图3 IL-17通路的治疗靶点
1. 直接靶向IL-17或其受体
使用单克隆抗体靶向细胞因子或其受体是最直接及特异的策略。最早用于临床试验的2个抗IL-17A抗体是苏金单抗(Secukinumab,AIN457,ConsentyxTM)——一种全人源IgG1k抗IL-17A单克隆抗体,以及艾克司单抗(Ixekizumab,LY2439821)——一种人源IgG4抗体。其他一些同类型抗体,如CNTO6785、CJM112和BCD085,仍处于临床试验中。
基于IL-17F在炎症中也发挥作用,靶向IL-17A和IL-17F相同基序的生物制剂正处于临床开发中,包括纳米抗体ALX-0761和单克隆抗体Bimekizumab[25]。
全人源IgG2 Brodalumab(AMG827)靶向IL-17受体,选择性阻断IL-17受体A链信号,拮抗IL-17A、IL-17F、IL-17C及IL-25的作用。
基于前述TNF和IL-17的协同作用,双特异性的生物制剂正处于临床开发中。ABT-122是一种双结构域免疫球蛋白(DVD-IgTM),一个位点结合TNF-α,另一个位点结合IL-17A[1]。COVA322是一种融合分子,由全人源抗TNF-α抗体阿达木单抗和抗IL-17A的Fynomer组成[26]。
2.间接靶向IL-17通路
IL-23是一个异二聚体配体,由特有的P19亚基及与IL-12共有的P40亚基组成,作用于IL-17上游。IL-23特异性抑制剂是IL-23P19靶向抗体,包括Tildrakizumab(MK-3222,SCH-900222)、Guselkumab(CNTO-1959)、AMG-139、LY3074828和BI655066[25]。这些抑制剂可抑制IL-17A、IL-17F、IL-21和IL-22的产生。
RORγt控制Th17细胞的分化,靶向RORγt将抑制IL-17A、IL-17F、IL-21和IL-22的产生。在体外及小鼠模型如实验性自身免疫性脑脊髓炎中,数种小分子如合成配体SR1001可结合RORγt及抑制其转录活性[27-29]。这些小分子正处于早期研发中。
五、小 结
总之,通过与关键促炎症细胞因子TNF的协同作用,IL-17放大了局部和全身的固有炎症反应,这揭示早期靶向IL-17的意义。越来越多的证据支持IL-17和Th17细胞在关节炎、骨丢失及骨形成中起关键作用。动物模型及初步临床试验为IL-17靶向治疗银屑病关节炎、RA、AS等的有效性提供了强有力的证据。目前针对一系列疾病的靶向IL-17治疗药物正处于研发及试验中。相信在不久的将来IL-17靶向药物可以走进临床造福更多患者。
