抑癌基因GKN2在胃癌中的表达及其临床意义
2018-07-23毛苇陶力赵心恺孔灿灿邝继孙邱敏霞
毛苇 陶力 赵心恺 孔灿灿 邝继孙 邱敏霞
胃癌是全球高发的恶性肿瘤,居我国肿瘤发病率的第二位和肿瘤病死率的第三位[1]。胃癌的发病机制目前尚不完全清楚,但原癌基因的激活及抑癌基因的失活是其病变过程中的重要因素。现在已经发现多个特异性基因可能会在胃癌的发病过程中起到重要作用, 其中抑癌基因Gastrokine 2(GKN2)最近受到较多关注。GKN2属于Gastrokine家族,其特点是家族成员编码的分泌蛋白中均含有一个保守的BRICHOS结构域[2-3]。BRICHOS结构域是一个保守蛋白结构域,它由约100个氨基酸组成,其保守序列主要位于一对可形成二硫键并发挥蛋白折叠作用的半胱氨酸周围。目前发现含有BRICHOS结构域的蛋白与一系列重大的疾病相关,如BRI2与家族性痴呆有关;ChM-1与软骨肉瘤相关;SP-C与呼吸窘迫综合征相关;GKN1与胃癌相关[4-5]。本研究旨在通过比较GKN2在人胃癌组织和正常胃组织中的表达情况,探讨GKN2在胃癌发生过程中的表达调节,为进一步研究GKN2在胃癌中的抑癌机制提供基础。
材料与方法
一、材 料
1.组织标本
1.1 实时定量PCR(RT-PCR)标本
选取2013年1月至2014年12月由中山大学附属第三医院外科提供的70例胃癌组织及其相应的癌旁正常组织,所有标本均取自胃癌手术患者并通过组织病理学检查确认。其中男62例、女8例,年龄(59.4±7.6)岁。
1.2 组织芯片标本
另外选取70例来源于中山大学附属第三医院的胃癌病灶手术标本用于组织芯片,其中男59例、女11例,年龄(61.6±6.6)岁,所有胃癌患者术前均未接受化学治疗和放射治疗。同时选取70例来源于内镜中心的正常胃黏膜标本,男59例、女11例,年龄(61.0±6.0)岁。2组性别构成、年龄比较差异均无统计学意义(P均>0.05)。
本研究获得医院医学伦理委员会批准,患者均签署知情同意书。
2.主要试剂
GKN2 兔抗人单克隆抗体购自Abnova公司;β-actin鼠抗人单克隆抗体(BA2305)购自博士德公司;二步法抗兔/鼠通用型免疫组化检测试剂盒购自DAKO公司;RNeasy Mini Kit购自Quiagen公司;ReverTra Ace-α-TM-RT-PCR Kit购自TOYOBO公司。
二、实验方法
1.PCR法
1.1 总RNA 提取
使用RNeasy Mini Kit,根据说明书操作。液氮冷冻条件下将组织研磨成粉末状,将其移入预先准备好的含350 μl RLT液的离心管中,用组织分散机分散组织粉末,5 ml一次性注射器反复抽打10次,4 ℃条件下12 000转/分离心5 min,将上清液移入1.5 ml离心管。加入同等体积(约350 μl)70%乙醇液,充分混匀后,全部移入吸附柱中,12 000转/分离心15 s,倒掉收集管内的液体。加入700 μl的RW1液,12 000转/分离心15 s,倒掉收集管内的液体。先后两次加RPE液入吸附柱内, 12 000转/分分别离心15 s和2 min,均弃去收集管内的液体。将吸附柱移入一新的2 ml收集管内,12 000转/分离心2 min。将吸附柱移入一新的1.5 ml收集管内,加入50 μl RNase-free水,12 000转/分离心1 min。经紫外分光光度计测定判断后将所得RNA存储于-80℃备用。
1.2 逆转录合成cDNA
使用ReverTra Ace-α-TM-RT-PCR Kit,根据说明书操作。在0.5 ml Eppendorf管中加入中RNA 1 μg,5×RT Buffer 4 μl、Random Primer(25 pmol/μl)1 μl、10 μmol/L dNTP 2 μl、Rever Tra Ace逆转录酶1 μl,再用RNase-Free H2O调整至总反应体系20 μl,充分混匀。将离心管置于PCR仪,设置程序如下:30 ℃ 10 min,42 ℃ 20 min,99 ℃ 5 min,4 ℃ 5 min。反应结束后将离心管瞬间离心,所得cDNA储存于-20℃冰箱备用。
1.3 PCR扩增
使用Primer 5.0 软件设计引物:正向引物5′-GTGGCATTTTGGTGGTG-3′ ;反向引物 5′-CATTGTTGCTTGGGCTGA-3′,交由Invitrogen公司合成[6]。PCR扩增根据说明书操作。反应条件:预变性95 ℃ 5 min,变性94 ℃ 30 s,退火53 ℃ 30 s,延伸72 ℃ 1 min,28个循环后72 ℃延伸8 min。PCR扩增完毕后,取扩增产物10 μl混合上样缓冲液2 μl充分混匀,用1%琼脂糖凝胶在100 V稳压下电泳40 min,电泳完毕后使用紫外线凝胶成像仪观察。
2.免疫组织化学检查(免疫组化)
2.1 组织芯片制备
从病理科调取原始标本石蜡块,复习病理诊断及选取芯片打孔位置。比对带有打孔标记的切片,在供体蜡块上的相应部位打孔采集组织芯片,将组织芯片转移到受体蜡块的孔中,将组织芯片快速连续切片20张,每张约厚4 μm。
2.2 免疫组化染色
将所得组织芯片切片60 ℃烤片,二甲苯脱蜡10 min×3次,梯度浓度乙醇(100%,95%,85%,75%,70%)脱水各5 min,蒸馏水洗5 min×3次。切片置于10 mmol/L柠檬酸缓冲液(pH 6.0)中,微波加热(95 ℃,10 min)修复抗原,室温下自然冷却后磷酸盐缓冲液(PBS)洗3 min×3次。切片置于0.3%过氧化氢室温孵育15 min以阻断内源性过氧化物酶,后PBS洗5 min×3次。正常山羊血清封闭液室温孵育10 min。滴加一抗室温孵育1 h(GKN2一抗浓度1∶300)。滴加二抗(HRP标记的即用型二抗工作液)室温孵育30 min。DAB显色,苏木素复染,中性树胶封片。
三、统计学处理

结 果
一、 胃癌组织和癌旁正常组织的GKN2 mRNA对比
RT-PCR结果显示,GKN2 mRNA在癌旁正常组织中全部高表达,阳性率为100%;GKN2 mRNA在胃癌组织中仅有 7例表达但表达明显下调,其余表达缺失,阳性率为10%。胃癌组织和癌旁正常组织GKN2 mRNA阳性表达率差异有统计学意义(χ2=63.00,P<0.001),见图1。

图1 胃癌组织和癌旁正常组织中GKN2 mRNA的表达
二、 胃癌组织和正常胃组织的GKN2蛋白表达对比
免疫组化结果显示,70例正常胃组织的GKN2呈强染色,分布在正常胃黏膜上皮细胞的胞浆内,阳性率为100%。而70例胃癌组织标本中,仅有5例呈弱阳性表达,其余65例均表达缺失,阳性率为7%。胃癌组织和正常胃组织的GKN2蛋白阳性表达率差异有统计学意义(χ2=121.33,P<0.001),见图2。
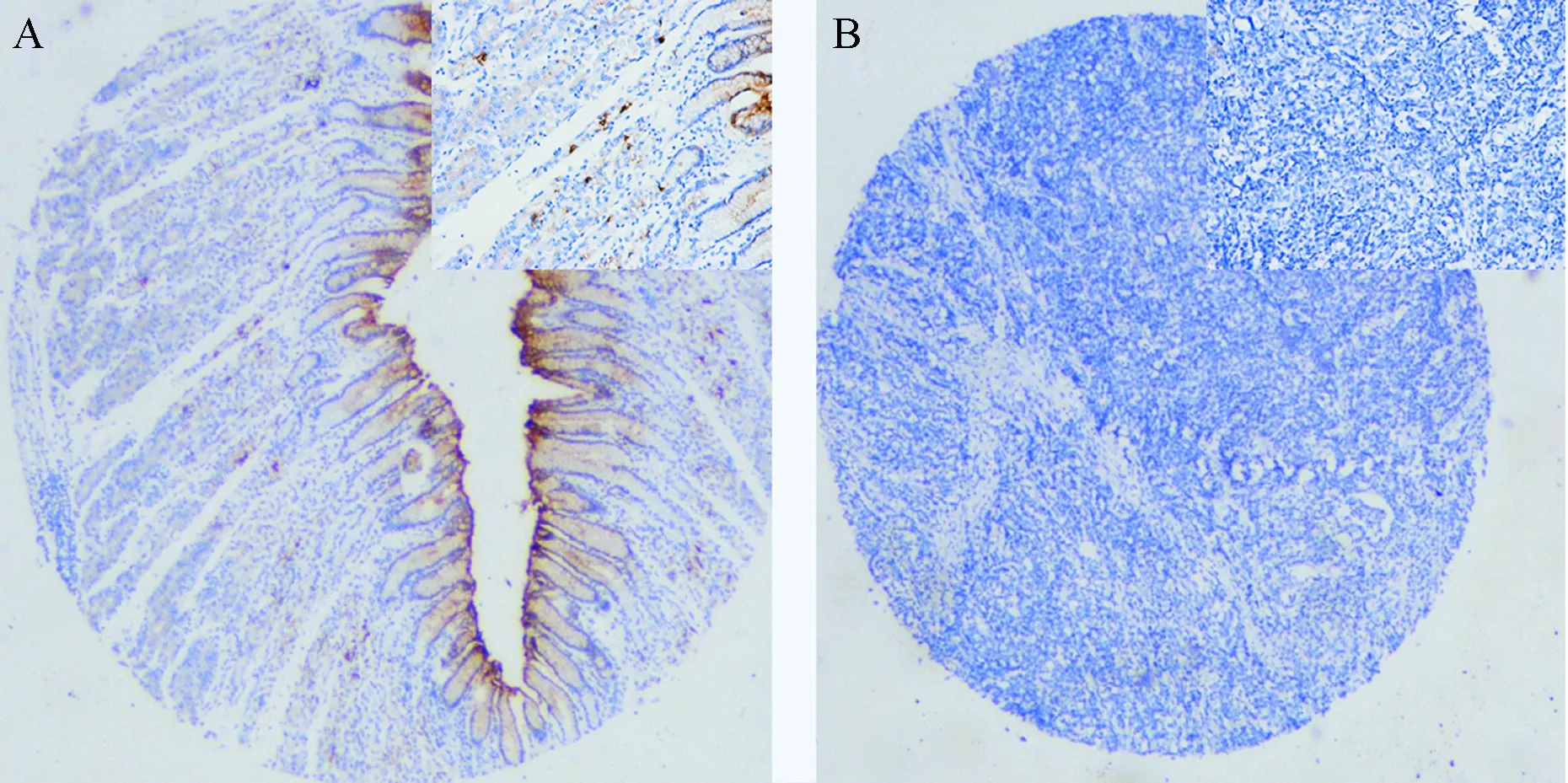
图2 正常胃组织和胃癌组织的GKN2蛋白表达
讨 论
GKN2只特异性地表达于正常胃黏膜上皮细胞,非胃上皮组织组织均无表达[7]。本研究显示,GKN2主要表达于腺体的中上部分,以胃黏膜表面的上皮细胞最为明显,越往深部其在腺体中的表达越弱。这与GKN1的表达分布十分相似,我们推测GKN2也可能通过胞吐的方式分泌出去,构成胃上皮黏液层的一部分抵御损害,并促进受损胃黏膜的修复。有研究显示,在胃黏膜炎性反应过程中,GKN2起着胃黏膜保护作用,能够抑制幽门螺杆菌对胃黏膜的炎性损害,避免胃黏膜进入癌变过程[8]。这提示GKN2能够维护胃黏膜上皮的完整性并促进受损的胃黏膜进行修复。GKN2还可与TFF1形成二聚体在正常胃黏膜中表达。而TFF1在胃中起着胃黏膜保护因子的作用,能够增强胃黏膜上皮防御酸和食物诱发损伤的能力;诱发细胞移行的信号传导途径,促进细胞移行从而促进受损黏膜重建;促进胃上皮细胞分化,帮助细胞内蛋白的折叠[9-10]。因此推测GKN2在胃中也扮演类似的黏膜保护作用。
本研究结果显示,GKN2在正常胃粘膜细胞中高表达,但是在胃癌组织中表达明显下调甚至缺失。有研究报道GKN2在胃癌细胞株、胃肠上皮化生组织和胃组织中表达明显下降或缺失[11-12]。这与我们的结果相似,提示GKN2的表达缺失可能是胃癌发生的重要因素。Moss等[13]研究了155个远端胃腺癌中GKN2的表达趋势,发现GKN2在大多数胃癌组织中表达缺失或明显下降;而且GKN2的表达缺失在临床中可作为提示患者生存期缩短的一个独立预测指标。目前已经证实GKN2能够通过促进胃癌细胞的凋亡,抑制胃癌细胞的增殖和侵袭发挥,抑制上皮间质化等抑癌作用。其能够激活包括JAK/STAT、PI3K/AKT/GSK3β、NF-Kβ等在内的信号通路发挥作用[14]。GKN2与TFF1形成的二聚体也在胃癌中表达下降[15]。而TFF1已经被证实在胃黏膜中具有抑癌作用,TFF1通过调节经典的cyclinD1-CDKs-CKIs-pRb-E2F通路,延迟肿瘤细胞从G1到S期的转化,从而抑制肿瘤细胞增殖[16]。因而GKN2与TFF1二聚体表达的缺失也可能是参与了胃癌发生的进程。
综上所述,GKN2在正常胃黏膜中高表达,但是在胃癌中表达下调甚至缺失,这可能是导致胃癌发生的重要因素。
