氢分子键长、键能的精确计算
2018-07-20高晓明
何 帅,高晓明
(1.延安大学西安创新学院,陕西 西安 710000;2.延安大学 化学与化工学院陕西省化学反应工程重点实验室,陕西 延安 716000)
各种化学键的形成与断裂是化学反应的基础。氢分子是宇宙中最简单的分子,氢分子的形成原因是认识化学键本质最重要的问题,有助于弄清化学反应的动态过程。键长是分子结构的重要参数之一,它对于讨论化学键的性质,研究物质的微观结构以及阐明微观结构与宏观性能之间的关系等方面都具有重要作用。键能是从能量因素衡量化学键强弱的物理量。对于氢分子键长和键能的计算,目前比较认可的是薛定谔方程。然而要精确求解薛定谔方程,其计算量是令人生畏的[1]。1927年,海特勒(Heitler)和伦敦(London)首次用波函数ψ1和ψ2的线性组合计算氢分子键长和键能。虽然所得的氢分子键长与实验值误差较大,但对量子化学的创立做出了不可磨灭的贡献。到了20世纪60年代,柯罗斯(Kolos)和卢桑(Roothaan)给出了氢分子键长和键能的精确解。至今,已有很多学者对氢分子键长和键能做过计算。然而大部分是借助极其复杂的数学理论完成的,甚至需要计算机辅助计算,有的理论人为定义的参数较多,部分参数没有明确的物理意义[1]。也有一些学者用宏观方法较好的对氢分子的键长和键能进行计算,如云南大学陈景教授用经典力学计算氢分子的键长键能及力常数。
氢原子的半径仅有0.529×10-10m,电子更是半径小得无法测量的微观粒子。在氢原子内,高速运动的电子被束缚在极小的范围之内使其运动不遵循经典力学定律,因此在量子化学中描述时多用到Heisenberg 测不准原理 ,Pauli 原理,能级跃迁等理论,其运动状态只能用“几率密度分布”和“电子云”进行描述[2-3]。笔者受启发于分子扩散、溶解平衡、热传递等随时间变化最终达到动态平衡。例如气体在某一密闭容器内扩散随着时间变化密度保持不变;将蔗糖溶液加入水中稀释,随着时间的变化浓度保持不变;在孤立系统中,将等体积的一杯80℃的水和20℃的水均匀混合,最终水的温度为机理50℃,最终都达到一种动态平衡。提出了一种极为简单的氢分子成键模型,假定氢分子成键为氢原子转变为氢分子后,氢分子中重叠部分平均电势能密度与未重叠前氢原子平均电势能密度相等,归纳出氢分子键长、键能和结构之间的方程式,用一种新颖的宏观方法计算氢分子键长和键能[4]。同时得到了氢分子在成键过程中不同核间距下的能量变化值。
1 氢分子成键模型
假设1:假定两个氢原子形成氢分子之后,氢分子的电势能与体积的比值和氢原子的电势能与体积的比值相等。
假设2:氢分子的电势能与体积的比值和重叠部分电势能与体积的比值相等,也和未重叠部分电势能与体积的比值相等。
对于氢分子的动态平衡,从静电相互作用的角度讲,假设氢分子平衡状态间距为R,即两个氢原子的距离为R时,处于平衡状态,距离小于R时排斥,大于R时吸引[5-8]。而笔者认为,氢分子处于非平衡态时,如果重叠部分平均电势能密度大于氢原子平均电势能密度,两个氢原子缓慢远离,直到达到一种新的平衡状态;如果重叠部分平均电势能密度小于氢原子平均电势能密度,两个氢原子继续靠近,直到达到一种新的平衡状态;这种新的平衡状态为氢分子的动态平衡,在这种状态下氢分子核间距为Re,氢分子重叠部分(阴影部分为重叠部分)的电势能与体积的比值和氢原子的电势能与体积的比值相等。

图1 氢分子成键模型Fig.1 The ground state of hydrogen molecule
如图1所示,z代表氢原子核,阴影部分为重叠部分。当氢原子处于平衡态时,我们定义氢原子平均电势能密度与基态氢原子电势能成正比,与氢原子体积成反比。
用方程式可表示为:
(1)
式中,φ为平均电势能密度;Ep为氢原子电势能,eV;V为氢原子体积,m3。
根据两条假设,我们可以得到氢分子在平衡状态下的方程组:

(2)
式中,E1为氢分子的电势能,V1为氢分子体积;E2为氢分子重叠部分的电势能,V2为重叠部分的体积;E3为氢分子未重叠部分的电势能,V3为未重叠部分的体积。
同时:
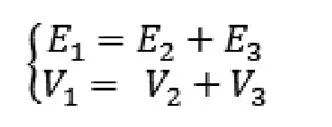
(3)
很明显,这个方程式通过量子引力场很可能存在流体特性这一假定,可以将氢分子键能与其结构联系到一起。
由于氢原子总的电势能为:
(4)
则氢原子平均电势能密度为:

(5)
氢分子重叠部分可以看作是由两个球缺组成的。我们可以用球缺的体积公式计算重叠部分的体积。即:
(6)
式中,R为该球体的半径,h为该球缺的高。
2 氢分子键长、键能的精确计算


(8)
式中:De为氢分子键能,Re为氢分子核间距。
根据假设,假定氢原子形成氢分子平衡的微观机理为平均电势能密度相等。同时氢分子重叠部分电势能与体积之比为 ,氢分子未重叠部分电势能与体积比值仍为p。根据这个假设得到方程组:
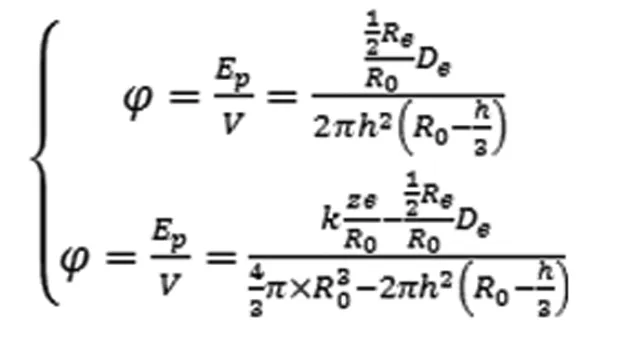
(9)



故:
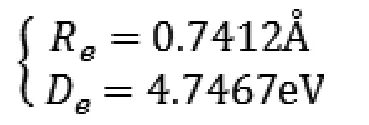
(10)
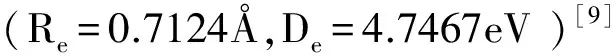
3 氢分子在不同核间距下的结合能
氢分子成键过程中,能量释放是经过随着核间距减小逐渐完成的,给出了氢分子不同核间距下的结合能的方程式和氢分子的结合能核间距关系表(预测值):
(11)

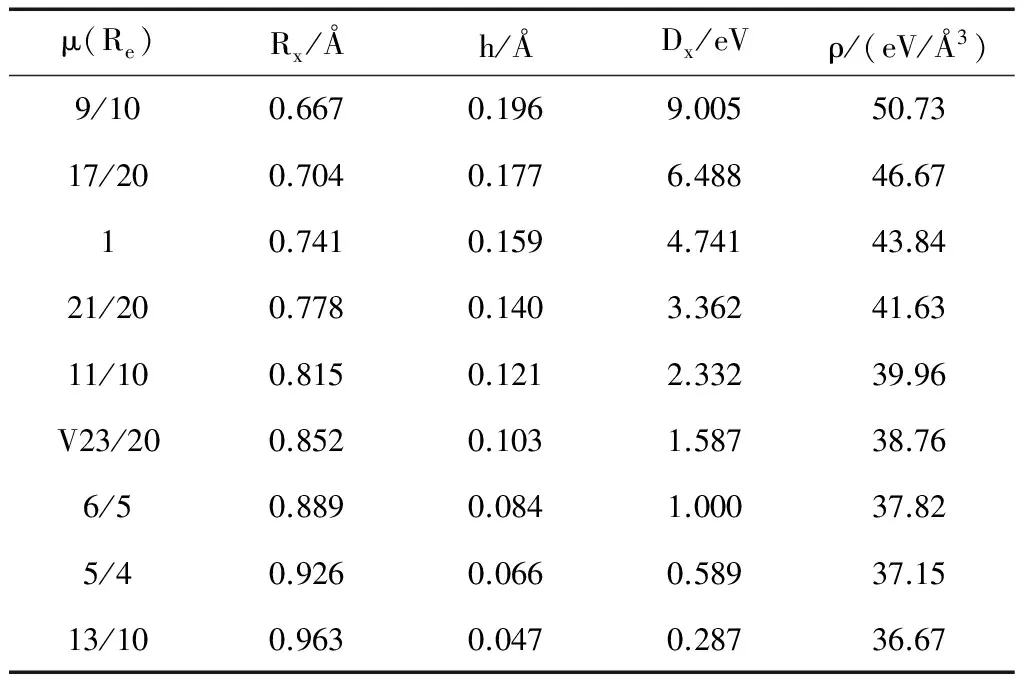
表1 氢分子结合能核间距关系Table 1 Relation of hydrogen molecular bond nucleus spacing
4 讨论
目前认为经典力学不能解决原子的激发态、光谱、各种轨道(s、p、d、f)的差异、轨道杂化、π键与共轭键等物质结构中的各种问题。然而,笔者发现了氢分子键长、键能与其结构之间的联系,假定量子场具有流体特性,认为氢分子共价键成键机理为氢原子结合为氢分子后平均电势能密度守恒,建立了一种全新的宏观的氢分子成键模型,并得出其方程组。通过求解该方程组,得到了氢分子键长和键能的精确值。它表明化学键形成可能并不存在什么电子交换力,暗示着原子的空间运动、分子的结构、能量传递仍然还存在一定新的规律性。
