胃癌组织中丝氨酸蛋白酶1的表达及意义
2018-07-20吴红学童仕伦柯东邹力
吴红学,童仕伦,柯东,邹力
(武汉大学人民医院,武汉 430060)
根据国际癌症研究机构的统计数据,胃癌发病率位于恶性肿瘤第5位、病死率居第3位[1]。中国是胃癌的高发地区之一,发病例数和死亡例数分别占全球胃癌发病和死亡的42.6%和45.0%[2]。随着中国人民生活水平的提高,生活方式和饮食结构的改变,胃癌的发病率仍呈上升趋势[3]。胃癌的治疗近年来虽取得一定进展,但以手术为主,放化疗为辅的治疗模式,效果仍不满意。胃癌发生发展的机理目前尚未完全明确,普遍认为其形成、发展是一个涉及多个基因、历经多个阶段的过程。目前大量研究已证明,丝氨酸蛋白酶1(HTRA1)基因在子宫内膜癌[4]、肝癌[5]、卵巢癌[6]、胶质细胞瘤[7]等多种癌症中表达下调甚至缺失,表明HTRA1具有肿瘤抑制功能,但其在胃癌中是否亦有肿瘤抑制功能尚无报道。本研究收集武汉大学人民医院2010年1月~2011年12月有完整临床病理资料及随访记录的胃癌切除术患者石蜡包埋标本108例份,行免疫组化检测。另收集2017年6~12月行胃癌切除的手术标本32例份,行RT-PCR检测,观察HTRA1在胃癌中的表达情况,并分析其与患者临床病理特征及预后的关系,从而探讨HTRA1在胃癌中的作用。
1 资料与方法
1.1 临床资料 收集武汉大学人民医院2010年1月~2011年12月有完整临床病理资料及随访记录的胃癌切除术患者石蜡包埋标本108例份,患者男63例、女45例,年龄28~84岁,平均63.6岁。肿瘤直径<5 cm 50例,≥5 cm 58例;低或未分化57例,中高分化51例;浸润深度T1~233例,T3~475例;胃周淋巴结有转移88例,无转移20例;TNM分期Ⅰ~Ⅱ期42例,Ⅲ~Ⅳ期66例。患者术前均未接受过放疗或化疗。无其他恶性肿瘤病史。此组标本用于免疫组化检测。另收集2017年6~12月行胃癌手术切除的新鲜组织标本32例份,每个病例均取胃癌组织及远癌组织,远癌组织指距肿瘤5 cm以外的正常胃组织。标本切下后迅速置于-196 ℃液氮中冷冻,然后置于-80 ℃冰箱保存。此组标本用于RT-PCR检测。本研究得到武汉大学人民医院医学伦理委员会批准。
1.2 胃癌及远癌组织中HTRA1蛋白表达检测 采用免疫组化法。分别对胃癌组织及远癌组织进行免疫组化S-P法染色,石蜡切片二甲苯脱蜡,梯度乙醇水化,H2O2室温孵育20 min灭活内原性过氧化物酶,切片抗原修复后,滴加鼠抗人HTRA1一抗(1∶200稀释)50 μL,4 ℃过夜;过夜后将切片室温平衡1 h,加入抗鼠IgG二抗,37 ℃ 1 h;DAB显色,苏木精复染,脱水、透明、封片、镜检。所有免疫组化结果由两位病理科医生独立读片判断,显微镜下观察结果。结果采用半定量计分方法,在200倍高倍镜下,随机选择5个肿瘤区域,无阳性细胞计0分,阳性细胞占1%~10%计1分,11%~50%计2分,51%~80%计3分,81%~l00%计4分;同时评估阳性细胞染色强弱:0分为无色;1分为浅黄色;2分为棕黄色;3分为棕褐色。两项的乘积即为该例病变的免疫组化评分:0分为阴性(-);1~4分为弱阳性(+);5~8分为中度阳性(++);9~12分为强阳性(+++)。以大于5分判断为阳性,5分以下为阴性。
1.3 胃癌组织中HTRA1 mRNA表达检测 采用实时荧光定量PCR法。TRIzol法提取组织中的总RNA,作为反转录模板生存cDNA。HTRA1引物:正向引物5′-TTGTTTCGCAAGCTTCCGTT-3′,反向引物5′-ACGTGGGCATTTGTCACGAT-3′。β-actin作为内参,正向引物5′-CACGGCACTGATTTTCAGTTCT-3′,反向引物5′-TTCTTGCTGCCAGTCTGGACT-3′。反应条件:变性阶段(94 ℃ 5 min)和35个循环的扩增定量阶段(94 ℃ 15 s;58 ℃ 45 s)。2ΔΔCT法计算每个肿瘤样本对于正常对照样本目的基因的相对Ct值差异。Ct表示目的基因的荧光值设定的阈值时反应循环数。ΔΔCt=ΔCt(肿瘤样本)-ΔCt(对照样本)。
1.4 统计学方法 采用SPSS18.0统计软件。应用配对t检验评估胃癌组织与远癌组织中HTRA1蛋白及mRNA表达差异,应用χ2检验评估HTRA1相对表达与临床病理特征的关系, Kaplan-Meier法绘制生存曲线,并应用Log-Rank检验评估HTRA1 mRNA表达与生存时间的关系。P<0.05为差异有统计学意义。
2 结果
2.1 HTRA1蛋白表达比较 THRA1蛋白阳性呈棕褐色颗粒,主要表达于细胞核中,HTRA1蛋白在胃癌组织中阳性表达率为17.6%(19/108),而在远癌组织中阳性表达率为82.4%(89/108),与远癌组织相比,胃癌组织中的HTRA1蛋白表达下调(P<0.01)。
2.2 胃癌及远癌组织中HTRA1 mRNA表达比较 胃癌标本中HTRA1 mRNA表达较远癌组织下调24例(75%),胃癌及远癌组织中HTRA1 mRNA相对表达量分别为6.06±1.57、4.85±1.39,胃癌与远癌组织相比有统计学差异(P=0.002)。
2.3 THRA1蛋白表达与胃癌患者临床病理特征的关系 HTRA1蛋白表达与肿瘤大小、浸润深度有关(P均<0.05),HTRA1蛋白表达与肿瘤相关淋巴结转移、组织分化程度、患者年龄及性别等无关(P均>0.05),见表1。
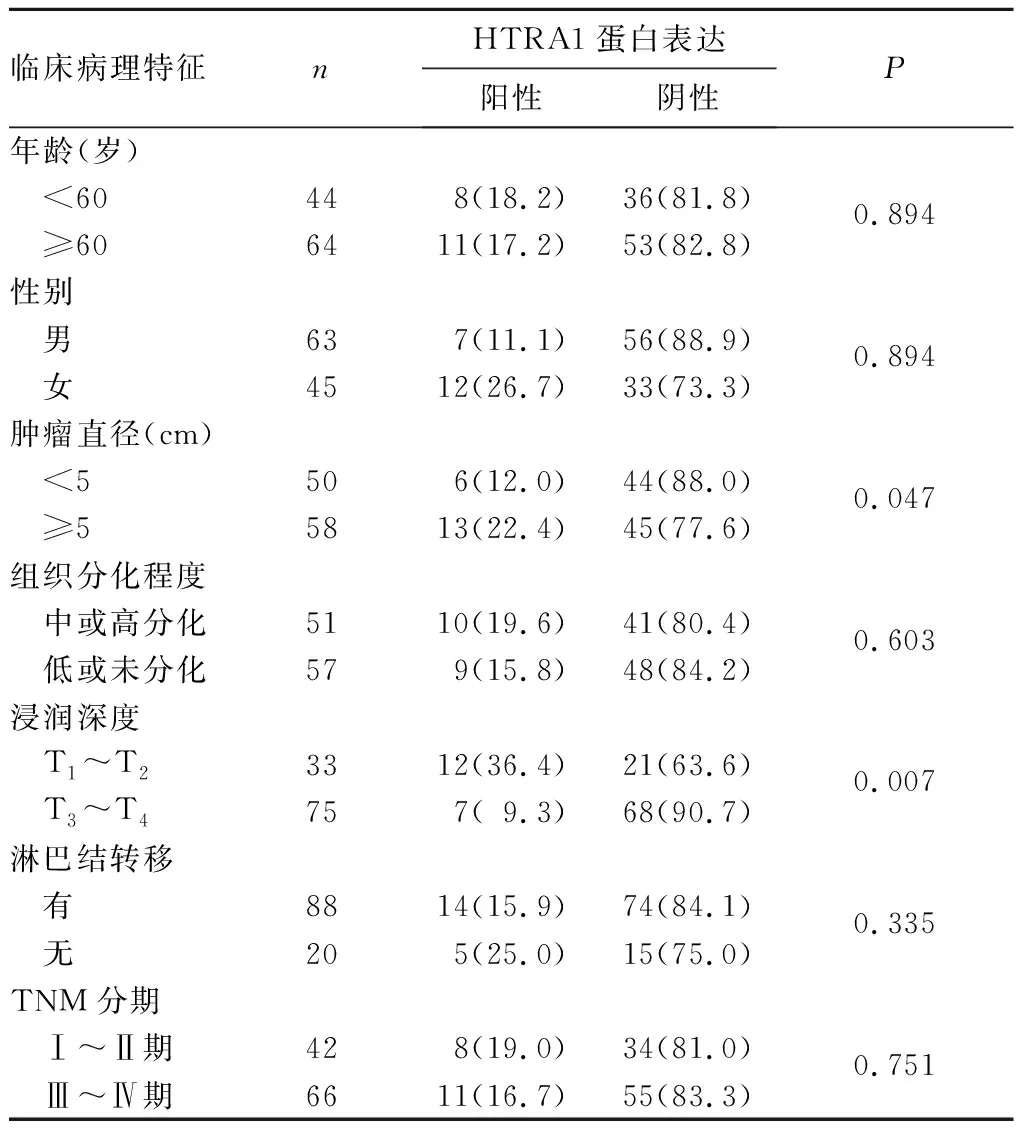
表1 HTRA1蛋白表达与108例胃癌患者临床病理特征的关系[例(%)]
2.4 HTRA1蛋白表达与胃癌患者预后的关系 本组患者随访过程中有67例死亡,中位生存时间为46.8个月。其中HTRA1蛋白表达阳性与阴性患者的3年生存率分别为68.4%和50.6%,差异有统计学意义(P<0.01)。Kaplan-Meier绘制生存曲线结果显示,HTRA1蛋白低表达者较高表达者生存时间缩短(P=0.012),见图1。

图1 HTRA1蛋白阳性与阴性表达者生存曲线
3 讨论
丝氨酸蛋白酶家族(HTRA)是一种具有热休克蛋白性质的膜蛋白酶,广泛存在于人体的组织器官中。截止到目前,人类共发现四种HTRA家族同源物,即HTRA1 (Prss11, L56)、HTRA2 (Omi)、HTRA3 (PRSP)和HTRA4[8]。这些同源物均包含1个高度保守的胰酶样蛋白酶结构域和1个1~2碳末端盘状同源区域[9]。盘状同源区域是蛋白质-蛋白质反应模块,作为多聚体信号复合物的组织者发挥重要作用[10]。被认为是激活细菌和人类HtrA家族成员蛋白酶活性的开关[11]。
HTRA1是第一个被发现的人丝氨酸蛋白酶家族成员,最初是在肉毒病毒40(SV40)成纤维细胞中检测到[11],之后在软骨关节炎病例中亦检测到[12]。在哺乳动物的多种生物机制中发挥重要作用,在骨关节炎、阿尔茨海默病、黄斑变性、细胞迁移、肿瘤侵袭和转移及化疗引起的细胞毒性中起重要作用[13]。HTRA1基因包含9个外显子,编码458个氨基酸,定位于染色体10q26.2。从氨基酸的氮末端到碳末端包含有信号肽(SS)、胰岛素生长因子结合域(IGFBP)、Kazal型蛋白酶抑制剂结构域、胰酶样蛋白酶结构域及盘状同源区域等[10]。研究表明HTRA1在宫颈癌、黑色素瘤、子宫内膜癌及肝癌等多种癌症中表达下调甚至缺失,这表明HTRA1具有肿瘤抑制功能。Chien等[14]研究发现,HTRA1表达敲除后能使宫颈癌细胞SKOV3获得悬浮生长特性,而过表达HTRA1则能诱导另一种宫颈癌细胞OV2O2死亡。HE等进一步研究发现,SKOV3和TOV21G宫颈癌细胞株中HTRA1表达敲除后,肿瘤转移的关键性屏障失巢凋亡被抑制。推测失巢凋亡被抑制可能与EGFR/AKT信号通路激活有关,由此其研究小组采用免疫沉淀和免疫荧光法检测了细胞膜和细胞核内HTRA1和EGFR相互作用情况,发现在悬浮培养基SKOV3 细胞中,HTRA1表达自动上调,而HTRA1表达上升能抑制EGFR/AKT信号通路,导致细胞死亡增加。而采用蛋白酶水解能力丧失突变型HTRA1转染SKOV3 细胞后,则不能检测到EGFR/AKT信号通路被抑制或细胞死亡率升高。因此推测HTRA1主要通过抑制EGFR/AKT信号通路使其具有抑制肿瘤转移能力[15]。
本研究通过免疫组化和RT-PCR实验方法,分别在蛋白和基因层面证实胃癌组织中HTRA1表达低于远癌组织,差异有统计学意义,与其在宫颈癌、肝癌等中的研究基本一致。结合临床病理特征分析发现,HTRA1表达与肿瘤大小、浸润深度有关,HTRA1低表达的患者,肿瘤生长更大,浸润更深。并在生存分析中发现,HTRA1基因低表达患者预后差。提示HTRA1是一种抑制胃癌生长的基因。但其在胃癌中如何发挥抑制肿瘤的发生、生长、转移尚需进一步研究。
