原发性肝细胞癌患者肿瘤间质比变化的临床意义
2018-07-20蔡浩杨通印刘延刘江伟黄建钊
蔡浩,杨通印,刘延,刘江伟,黄建钊
(1遂宁市中医院,四川遂宁629000;2贵州省人民医院)
肿瘤间质比(TSR)指肿瘤组织中肿瘤细胞部分和间质成分之比。随着对肿瘤微环境研究的深入,越来越多的证据表明肿瘤间质成分在肿瘤发生、侵袭及转移等过程中扮演重要角色[1];TSR是结直肠癌、食管癌、鼻咽癌、宫颈癌、卵巢癌、乳腺癌、非小细胞肺癌等多种实体肿瘤患者不良预后的独立危险因素[2,3]。本研究分析原发性肝细胞癌(以下简称肝癌)患者TSR及其临床意义。
1 临床资料
研究对象为2009年1月~2015年10月贵州省人民医院收治的91例肝癌患者,男75例,女16例;年龄18~75岁、中位年龄50岁,≥50岁52例、<50岁39例;术前AFP≥400 ng/mL 38例,<400 ng/mL 53例;HBsAg阳性82例;肝硬化46例。91例患者均行根治性肝癌切除术,肿瘤最大直径≥5 cm 64例,<5 cm 27例;单个病灶70例,多个病灶21例;有卫星结节13例;包膜侵犯29例;低分化10例,中高分化81例;脉管癌栓阳性34例;TNM分期Ⅰ期43例,Ⅱ期31例,ⅢA期17例。围术期输血43例;术后经导管动脉化学栓塞(TACE)63例。纳入标准:术前未行放化疗、介入及生物靶向治疗;术前肝功能为Child-Pugh A级或B级;术后病理诊断为肝细胞性肝癌;实验室检查、病理及影像资料齐全;术后规律随访,且随访时间大于1年。排除标准:合并肝外转移、临近脏器侵犯或门静脉、肝静脉肉眼可见癌栓;术后病理诊断胆管细胞癌或混合型肝癌;术后因复发再次手术。
2 方法与结果
2.1 统计学方法 采用SPSS17.0统计软件。评估结果的一致性采用Kappa指数分析。计数资料比较采用χ2检验,等级资料比较采用秩和检验。单因素分析采用χ2检验、连续校正或秩和检验;多因素分析采用Logistic回归模型。P<0.05为差异有统计学意义。
2.2 肝癌组织TSR检测及TSR与患者临床病理参数的关系 TSR检测方法参照文献[3]:肝癌组织病理切片行HE染色,采用40×放大倍数显微镜观察肿瘤浸润最明显的区域(该区域主要由肿瘤细胞和间质两部分组成)。在该区域内用100倍放大镜评估单个视野范围内所有肿瘤细胞面积百分比,间质百分比即为该视野剩余面积百分比,由此计算肿瘤组织内部的TSR。选取多个视野进行评估(评估视野>2个),以间质百分比最高视野的评估结果作为最终取值。为排除癌旁组织的干扰,视野区域的间质四周必须有肿瘤组织包绕。根据既往的研究结果,本研究以TSR=50%作为截断值, TSR<50%定义为间质丰富,≥50%定义为间质稀少。为了保证评估结果不因评估者的主观性导致偏差,由两位有经验的病理医师均在不了解患者资料的情况下独立进行评估。完成所有患者病理切片评估后,如果两位评估者评定结果间的误差>10%,则由第三位经验丰富的病理医师再次评估并决定最终取值。对于难以肉眼评估的切片或评估值在40%~60%者,采用Image Pro-Plus(IPP)图像分析软件进行TSR的最终取值。结果显示,两位专家同时评定TSR<50% 17例,TSR≥50% 68例,其中6例存在差异,经统计软件分析两者评估的Kappa指数值为0.81,提示评估结果的一致性良好。
最终评定结果为间质丰富20例、间质稀少71例。间质丰富及间质稀少患者术前AFP≥400 ng/mL分别为14例(70%)、24例(33.8%),组间比较P<0.01;脉管癌栓阳性分别为18例(90%)、16例(22.5%),组间比较P<0.01。两者年龄、性别、HBsAg、肝硬化、肿瘤最大直径、肿瘤TNM分期、肿瘤病灶个数等临床病理参数比较差异均无统计学意义(P均>0.05)。见表1。
2.3 TSR与患者早期复发的关系 患者术后均进行1年随访,将肝内出现新发癌灶判定为早期复发。间质丰富及间质稀少者早期复发率分别为90.0%(18/20)、45.1%(32/71),两组比较P<0.01。
3 讨论
肿瘤间质主要由基底膜、成纤维细胞、细胞外基质(ECM)、免疫细胞、血管及各种细胞或生长因子等组成。在正常组织中,间质成分可通过抑制肿瘤细胞增殖而抑制肿瘤发生。虽然间质中的宿主细胞具有抑制肿瘤生长的能力,但间质在恶性肿瘤中会发生变化,最终促进肿瘤的发生、侵袭和转移。间质是肿瘤生长的“土壤”,可以引起基因组不稳定、为肿瘤组织的生长提供支架和屏障、产生免疫豁免区域、诱导双向分化和形成微环境,促进肿瘤的形成。间质构成的肿瘤微环境是一个动态的过程。肿瘤起始细胞或肿瘤细胞在适宜的微环境生长可刺激局部微环境形成适合肿瘤生长、侵袭及转移的微环境。肿瘤微环境具有组织缺氧、pH值降低和肿瘤血管生成等特点。缺氧相关信号的激活可以重塑细胞外基质。pH值降低可导致在DNA复制过程中起重要作用的DNA解螺旋酶和多聚酶等多种蛋白质结构异常;酸性微环境可促进肿瘤侵袭[4]。间质影响肿瘤侵袭及转移的机制包括细胞黏附、蛋白水解、基质重塑和细胞骨架重排等[1]。肿瘤的侵袭发生在肿瘤与间质的微生态环境中,间质与肿瘤细胞间进行酶和细胞因子的交换。侵袭所需要的主要酶包括基质金属蛋白酶(MMPs)等由宿主间质细胞产生,并不是由侵袭的肿瘤细胞产生[5]。间质中非细胞成分也可通过影响肿瘤细胞的信号通路来调节肿瘤的生物学行为。TSR能反映肿瘤组织内部间质部分的含量,因此能预测多种实体肿瘤患者的预后。既往的研究结果表明,TSR增加可能会促进肿瘤侵袭,并可能导致患者不良的临床预后[6]。
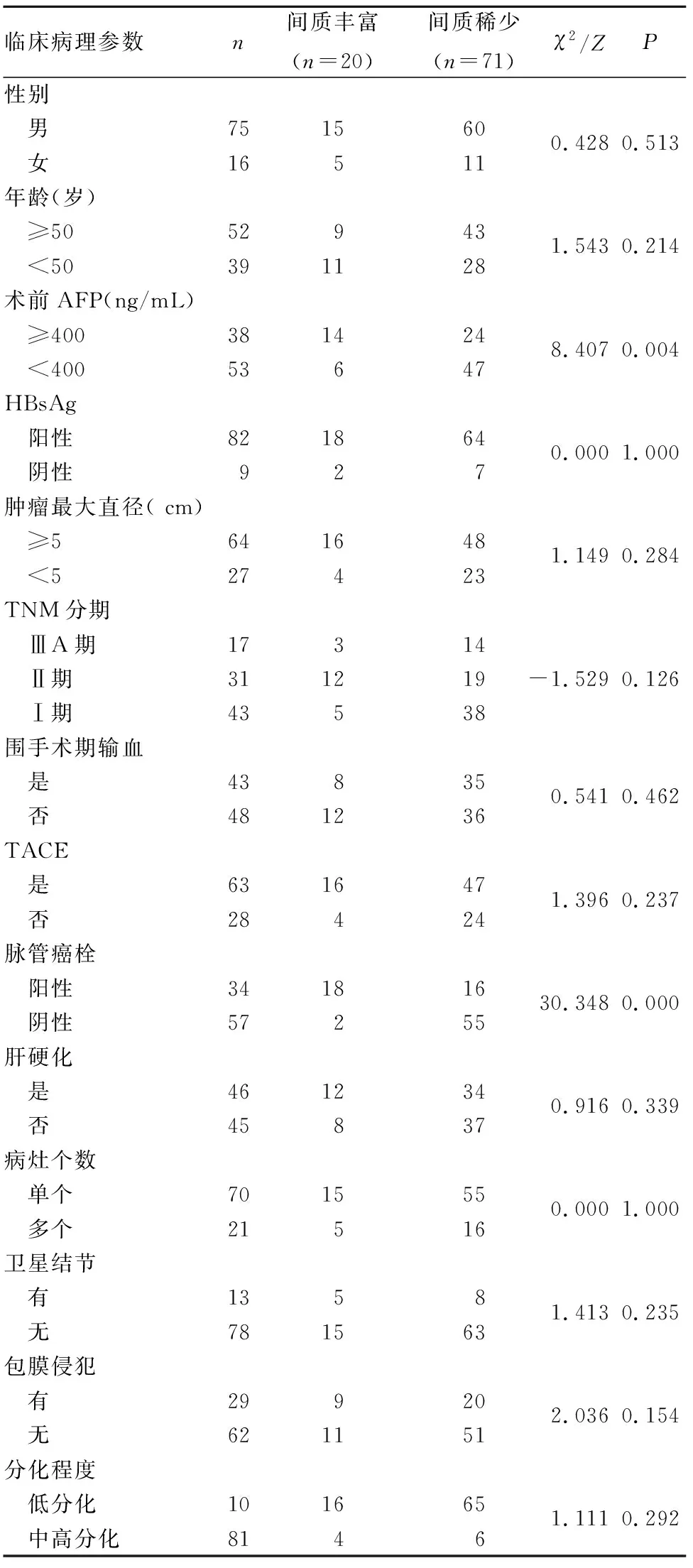
表1 间质丰富与间质稀少者临床病理参数比较(例)
有研究报道,TSR与肝癌患者TNM分期关系密切,TNM Ⅲ、Ⅳ期患者较Ⅰ、Ⅱ期患者具有更高的TSR[7]。本研究中肝癌Ⅰ、Ⅱ期患者74例、ⅢA期患者17例,均为早期肝癌患者,故间质丰富者所占比例低于间质稀少者。脉管癌栓被公认为是评估肝癌患者术后复发转移和预后的最重要的病理指标之一[8~11]。即使在小肝癌患者中,脉管癌栓也与患者复发风险及远期生存率低密切相关[12]。脉管癌栓的形成是癌细胞逐步侵犯周围组织的一个过程,其中包含了癌细胞克隆性增生,侵犯周围基质,破坏内皮细胞,侵入微血管,形成微癌栓,癌栓增大、脱落、转移等过程。微血管受侵犯常预示肿瘤有转移的趋势。微血管是肝癌转移的主要通道,是转移的首站[13]。研究发现,免疫标志物CD44+/CD133+与微血管侵犯有关,天冬氨酸/天冬酰胺羟化酶(ASPH)过表达可提高癌细胞的侵袭能力[14]。 microRNA、血清淀粉样蛋白、脱-γ-羟基凝血酶原水平变化在一定程度上可提示脉管癌栓的存在,且部分指标与肝癌术后复发相关。FOXC1是微血管侵犯的预测因子之一,抑制FOXC1表达可部分逆转上皮—间质转化(EMT)程序,为降低肝癌患者的肿瘤转移提供潜在的分子干预靶点[15]。AFP是在肝癌发生过程中的衍生产物,能在一定程度上反映肿瘤增殖和肿瘤负荷。既往研究结果显示,术前AFP阳性是肝癌微血管侵犯的危险因素,术前AFP水平越高,发生微血管侵犯的风险越高[16]。本研究间质丰富者术前AFP≥400 ng/mL及脉管癌栓阳性者所占比例均大于间质稀少者,进一步证实了上述结果。
本研究结果提示,TSR与肝癌术后早期复发有关。肿瘤相关成纤维细胞(CAFs)被认为是肝癌间质中最重要的成分之一[17]。与正常成纤维细胞比较,CAFs不仅有更强的增殖能力,而且具有促进肿瘤细胞生存、增殖、代谢再编程、血管移位、细胞外基质重塑等特点[18]。CAFs能产生影响上皮细胞功能的转化生长因子β(TGF-β),TGF-β 能促进肿瘤微环境的肿瘤相关巨噬细胞向活化的M2型细胞转化;其中TGF-β1调节致癌性的miRNA,促进肝癌进展。肿瘤相关的巨噬细胞(TAMs)可迁移至肿瘤的间质,释放内容物促进肿瘤的转移,或进入缺血、缺氧的坏死区域刺激血管生成。M2型巨噬细胞抑制适应性免疫系统,促进肿瘤增殖、血管生成和EM重构。最终肿瘤细胞逃过免疫屏障发生侵袭。
综上所述,原发性肝细胞癌患者TSR与血清AFP水平及脉管癌栓形成有关,且是患者术后早期复发的影响因子之一。
