叶子花花瓣状苞片和叶片的比较转录组学研究
2018-07-19邓亦麒何兴金
邓亦麒,何兴金,余 岩
(四川大学 生命科学学院,生物资源与生态环境教育部重点实验室,成都 610064)
叶是植物的重要营养器官,对植物的生命活动起到重要的作用[1]。在植物生态学中,叶片的形态和结构特征能更好地阐释物种的进化与适应相应环境[2-3],并且在古生物学中也常用“叶缘分析法” (Leaf margin analysis)[4]和“叶面积分析法” (leaf area analysis)[5]等方法来推测古环境状态。植物在进化的过程中,叶片内在生理及外在形态结构方面的特征会减少环境带来的不利影响[6-7]。例如,苜蓿、天竺葵等植物为更好地适应弱光环境,其叶片结构会呈现出大且薄,质地柔软,具有较长的叶柄等增强光合作用效率的特征[8]。处在不同极端环境中的植物,其叶片也存在特殊的适应性特征。如仙人掌属植物为适应干旱缺水的环境,其叶片变成了针刺状减少蒸腾作用,茎变成肉质掌状,替代叶片光合作用[9]。盐碱植物为适应盐碱地环境,通常叶片不发达,减少蒸腾作用并将植物多余的盐分通过叶片排出[10-11]。
苞片(bract)是花序结构中的变态叶,广义上,任何和花序有关的叶片均可称为苞片[12]。在植物分类学中,苞片是重要的分类依据,部分古植物化石的鉴定也要依赖于苞片的存在[13]。在不同的类群中,苞片或大或小,形态和颜色各异,其形态与普通叶片、花萼和花被片通常有所不同 。有些苞片具有鲜艳的色彩和突出的形态,能够与花瓣协同(甚至代替花瓣)实现吸引传粉者,防御天敌等功能[14-16],这类苞片统称为花瓣状苞片 (petaloid bracts)。
早期对于花瓣状苞片的研究主要集中在部分品种的园艺栽培和变种培育[17-18]。近年来,随着各种生物学手段尤其是分子生物学和生物信息学的发展,对于苞片结构和功能的研究愈发深入和广泛,延伸到包括发育遗传学 (developmental genetics)[19-20]、传粉生态学 (pollination ecology)[21]、系统发育和演化生物学 (phylogeny and evolutionary biology)[22]等各个方面。
花瓣状苞片广泛存在于被子植物的不同世系中,例如天南星科 (Araceae)、蓼科 (Polygonaceae)、茜草科 (Rubiaceae)、山茱萸科 (Cornaceae)、芭蕉科 (Musaceae)、紫茉莉科 (Nyctaginaceae)、三白草科 (Saururaceae)、苋科 (Amaranthaceae)和唇形科 (Lamiaceae) 等。其中紫茉莉科叶子花属(BougainvilleaL. )植物因拥有大而美丽的花瓣状苞片而广泛栽培。其苞片色彩鲜艳,容易被误认为花瓣(图1),“叶子花”正是由此而来,因此是研究花瓣状苞片发育的理想类群。中国引入栽培的叶子花属植物主要有2种:光叶叶子花(B.glabraChoisy)和叶子花(B.spectabilisWilld.),其中叶子花的栽培极为普遍,常作为绿篱与花棚的观赏花木。前人对于叶子花属的研究主要集中在其繁殖技术、花期调控、花色调控、化学成分和遗传多样性等方面。然而,尚未有研究对其花瓣状苞片的成因及苞片和叶片在基因层面的区别进行深入探讨。
转录组是某个物种或者特定细胞类型产生的所有转录本的集合,随着测序手段的进步和费用的降低,转录组测序已经越来越广泛地应用于生物学研究的各个领域。目前,基于Illumina高通量测序平台的转录组测序技术 (RNA-Seq) 能够在单核苷酸水平对任意物种的整体转录活动进行检测,在分析转录本的结构和表达水平的同时,还能发现新的转录本,并精确识别可变剪切位点以及cSNP、UTR区域,提供全面的转录组信息。本研究选取了叶子花(B.spectabilisWilld.)盛花期的叶片和苞片为研究材料,对其进行转录组测序。通过比较转录组学的手段对其叶片和苞片的转录本进行GO分析、差异化表达分析、同源基因分析等。本研究首次分析了叶子花(B.spectabilisWilld.)成熟叶片和苞片的转录组特征,为未来精细研究花瓣状苞片的基因调控机制奠定了基础,同时也为具有类似性状的类群的形态学演化提供了参考。
1 材料和方法
1.1 试验材料和预处理
选取叶子花(B.spectabilisWilld.)苞片与叶片作为试验材料(图1)。取花期植株的苞片和叶片各1份(未设置生物学重复),每份2~3 g,提取样品总RNA并使用DNase I消化DNA后,用带有Oligo(Dt) 的磁珠富集真核生物mRNA 。适温条件下,加入打断试剂,在Thermomixer中将mRNA打断成短片段,以打断后的 mRNA为模板合成一链cDNA,然后配制二链合成反应体系合成二链cDNA,并使用试剂盒纯化回收、粘性末端修复、cDNA的3′末端加上碱基A并连接接头,然后进行片段大小选择,最后进行PCR扩增;构建好的文库用Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System质检合格后,使用测序仪进行测序。
测序得到的raw reads里面可能含有接头、N大于5%的序列、测序质量很低的序列等。这些reads会影响组装和后续分析,对测序reads进行过滤,得到clean reads,数据处理的步骤如下:1)去除接头污染的reads(reads中接头污染的碱基数大于5 bp。对于双端测序,若一端受到接头污染,则去掉两端的reads);2)去除低质量的reads(reads中质量值Q <20的碱基占reads长度的20%以上,对于双端测序,若一端为低质量reads,则会去掉两端reads);3)去除含N比例大于5%的reads(对于双端测序,若一端含N比例大于5%,则会去掉两端reads)。

图1 叶子花形态及苞片和叶片解剖图Fig.1 The morphologies of leaf and bract in B. spectabilis
测序数据经去除接头、引物以及低质量的reads共得到54.48 M(54 384 608)条长度为150 bp的成对的clean reads,其中苞片的clean reads有26.81 M(26807892)对,叶片的clean reads有27.58 M(27576716)对。
1.2 方 法
1.2.1转录组的功能注释由于叶子花没有参考基因组,因此利用Trinity[23]软件对clean reads进行从头拼接,设置转录本中每个gene类中最长的isoform作为Unigene。通过Blast[24]同源比对,将叶子花转录组的Unigenes比对到nr (ron-redundant)、COG (Cluster of orthologous group of protein)[25]以及Swiss-Port蛋白质数据库[26],比对参数evalue为1e-5,最大匹配序列为1条,最大的局域比对数为1。利用Hmmscan(http:// hmmer. org/)将叶子花的Unigenes与Pfam进行比对。通过Transdecoder (https://github.com/TransDecoder/TransDecoder )获得转录本的编码区以及对应的的蛋白质序列,将获得的蛋白质序列与Swiss-Prot进行同源比。Trinotate (http://trinotate.github.io/)利用编码蛋白比对的结果结合之前转录本与nr蛋白库比对上的结果进行转录本基因本体(GO)[27]注释。通过与COG数据库进行比对,得到的结果按照COG数据库的类别对Unigenes进行分类。
1.2.2转录组差异表达分析利用bowtie2[28]将叶子花苞片和叶片的clean reads比对到叶子花转录组的Unigenes,利用RSEM[29]计算苞片和叶片2个组织的表达量(比对上Unigenes的有效count数,FPKM),edgeR[30]利用得到的苞片与叶片比对到相对应Unigenes的有效count数矩阵进行差异分析。由于假阳性的存在,设定表达量差异倍数为4以及多重检验(FDR)的P=0.001的Unigenes作为差异表达基因。最后利用goseq[31]对得到的RNA-seq数据的差异表达基因进行富集分析。将不同器官富集的GO基因分别用KOBAS软件[32]对比到拟南芥数据库进行KEGG富集分析。
1.2.3实时荧光定量qPCR验证使用MiniBEST Plant RNA Extraction Kit(TaKaRa)试剂盒分别对叶子花苞片和叶片提取总RNA,并对每个样品取等量RNA进行反转录。挑选了5个较为核心的在苞片中高表达的基因进行验证:DTX35、U85A3、BPE、DODA、AA5GT。使用Primer-BLAST设计特异性引物,选取TIP4基因作为内参。实时荧光定量qPCR使用UltraSYBR Mixture(Cwbio)试剂盒进行,其反应体系及操作步骤均参考该试剂盒进行。
2 结果与分析
2.1 转录组功能注释
根据获得54.48 M叶子花RNA-seq数据,利用Trinity软件拼接得到转录本isoform共167 467条,总共碱基数为177 962 558 bp,平均长度为1 062.67 bp,N50为1 407 bp。获得55 872条Unigenes,总共碱基数为56 083 839 bp,平均长度为1 003.79 bp,N50为1 402 bp。经过Blast同源比对,30 874条Unigenes(55.26%)能显著地与nr库比对上。对能比对的物种进行统计发现,叶子花的Unigenes有44.8%能与甜菜比对上,菠菜也有20.9%的序列能与叶子花比对上(图2)。24 168条Unigenes(43.26%)能显著地与Swiss-Port比对上。利用hmmerscan与已知的Pfam库对比,发现总共有20 107条Unigenes(35.99%)能在已知Pfam库中匹配到同源蛋白序列。
基因本体是一个在生物信息学领域广泛使用的本体,它是一个有向无环(DAG)型的本体。GO主要涉及到基因和基因产物特性的术语描绘,根据特点划分为三大类,即细胞组分(cellular component, CC)、分子功能(molecular function, MF)和生物进程(biological process, BP)。在这三大类型下又有不同的亚类,各类之间相互关联 ,因此通过GO注释可以对基因进行分类注释,并了解该基因的生物学意义。本研究利用Trinotate软件以及Swiss-Prot库同源比对的结果进行GO注释,发现总共有12 631条Unigenes(22.61%)能被注释。细胞组分共被注释到20 425次,其亚类最高的分别是细胞(19 184)、器官(15 120)、膜系统(8 841)和大分子复合物(4 116)。分子功能总共有21 187次被注释到,其亚类分布最高的分别是结合(15 976)和催化活性(15 976)。生物进程的总共有20 668次被注释上(图3),其亚类分布最高的分别是细胞进程(16 934)、代谢进程(15 231)和组织进程(12 089)。
COG数据库是基于细菌、藻类和真核生物的系统进化关系得到的。根据蛋白质序列的相似性,将Unigenes序列按照已整理的分类进行注释(图4)。对叶子花转录组的Unigene进行COG功能注释,可以分成4个大类、24个功能亚类。细胞过程和信号传导、信息存储和处理、代谢和缺乏注解分别有3 538条、3 893条、3 982条和3 002条。在细胞过程和信号传导类中,主要集中被注释到O(翻译后修饰、蛋白反转、分子伴侣)和T(信号转导机制)这两个亚类,分别占该类的38.08%(1 241条)和34.43%(1 112条)。在信息存储和处理类中,有1 416条注释到复制、重组和修复,有1 271条注释到转录,有949条注释到翻译、核糖体结构、生物合成亚类。在代谢类中,有826条注释到碳水化合物运输与代谢,有726条注释到氨基酸转运及代谢。其中能量生产和转换、无机盐转运及代谢、脂类转运及代谢、次生代谢产物的合成,转运和代谢分别有600条、475条、466条和422条。在缺乏注释类中,有2 551条注释到一般功能预测,剩下的Unigenes被注释到未知功能。
2.2 转录组差异基因分析
根据拼接得到的叶子花转录组数据,分别对叶子花同一时期的苞片和叶片进行定量分析。利用RSEM软件,通过将2个器官的clean reads比对到拼接好的转录组Unigenes,并计算出转录组数据分别在不同组织的表达量。通过edgeR软件,发现在同一时期苞片和叶片的差异表达基因(DEGs)总共有456个,在苞片中高表达的有166个基因,在叶片高表达的有290个基因。通过goseq软件,分别对差异表达基因作GO富集,根据GO术语对其进行聚类。叶片中高表达的差异表达基因共有240个GO术语,其中细胞组成(CC)41个,生物进程(BP)124个,分子功能(MF)75个。其中叶绿体类囊体膜(GO:0009535)在整个叶片高表达基因中最为显著(3.13e-43),并且有许多都参与光合作用。还发现叶片中有抗寒相关(GO:0009409)的基因本体;苞片中高表达的差异基因共有115个GO术语,细胞组成(CC)有5个,生物进程(BP)有54个,分子功能(MF)有56个。其中黄酮类化合物的生物合成过程(GO:0009813)在DEGs中高表达极为显著,并且发现GO注释中有许多与应激相关的基因,比如与紫外线相关(GO:0009411,GO:0010224),与生物刺激相关(GO:0009607),而且在这些高表达的基因中发现有参与花瓣发育过程相关的基因本体(GO:0048446,GO:0048441)。将不同组织的DEGs分开与拟南芥已知的KEGG数据库比对,发现在叶子花叶片存在很多与植物光合作用相关的同源基因,很多基因被注释到参与光合作用的天线蛋白LHCA/B基因家族(The light-harvesting chlorophyll a/b-binding proteins),参与光合作用的基因(PSAF、PSAK、PSAN、PSAO、PSBQ2和PETE),以及参与卡尔文-本森循环(Calvin-Benson cycle)碳固定的基因(GAPB)。而在苞叶中发现差异高表达基因有参与花青素合成的基因(CHI1)。

图2 叶子花转录组与非冗余蛋白库同源比对Fig.2 The homologous blast between B. spectabilis transciptome and non-redundant protein database
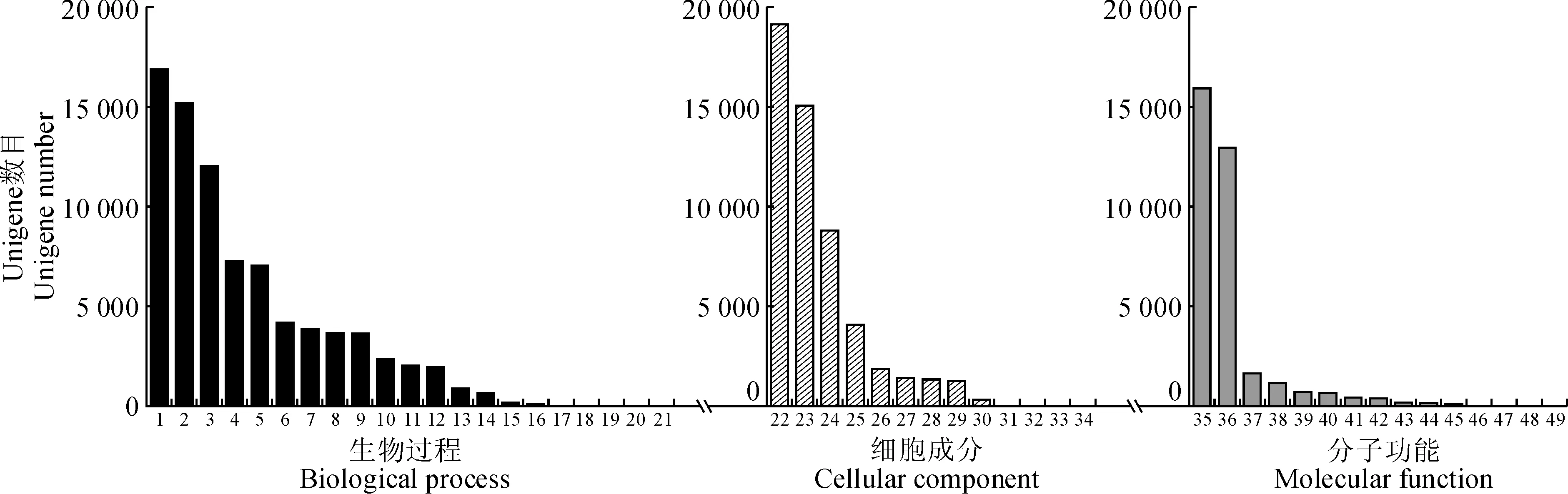
1. 细胞过程;2. 代谢过程;3. 单有机体过程;4. 刺激反应;5. 生物调节;6. 细胞成分组织或生物发生;7. 发育过程;8. 定位;9. 多细胞体过程;10. 信号;11. 生殖;12. 多有机体过程;13. 生长;14. 免疫系统的过程;15. 节律过程;16. 移动;17. 生物粘附;18. 行为;19. 细胞杀伤;20. 生物相;21. 细胞聚集;22. 细胞;23. 细胞器;24. 膜;25. 大分子复合物;26. 膜封闭的管腔;27. 细胞外区域;28. 细胞连接处;29. 共质体;30. 超分子复合物;31. 类核;32. 突触;33. 其他有机体;34. 病毒;35. 锚定;36. 催化活性;37. 转运蛋白活性;38. 核酸结合转录因子活性;39. 结构分子活性;40. 信号传感器活动;41. 分子转导活性;42. 分子功能调节剂;43. 抗氧化活性;44. 转录因子活性,蛋白质结合;45. 电子载体活性;46. 营养储藏活动;47. 金属伴侣活性;48. 翻译调节器活动;49. 蛋白质标签图3 叶子花转录组Unigene的GO注释1. Cellular process; 2. Metabolic process; 3. Single-organism process; 4. Response to stimulus; 5. Biological regulation;6. Cellular component organization or biogenesis; 7. Developmental process; 8. Localization; 9. Multicellular organismal process;10. Signaling; 11. Reproduction; 12. Multi-organism process; 13. Growth; 14. Immune system process; 15. Rhythmic process;16. Locomotion; 17. Biological adhesion; 18. Behavior; 19. Cell killing; 20. Biological phase; 21. Cell aggregation; 22. Cell;23. Organelle; 24. Membrane; 25. Macromolecular complex; 26. Membrane-enclosed lumen; 27. Extracellular region;28. Cell junction; 29. Symplast; 30. Supramolecular complex; 31. Nucleoid; 32. Synapse; 33. Other organism; 34. Virion;35. binding;36. Catalytic activity; 37. Transporter activity; 38. Nucleic acid binding transcription factor activity; 39. Structural molecule activity;40. Signal transducer activity; 41. Molecular transducer activity; 42. Molecular function regulator; 43. Antioxidant activity;44. Transcription factor activity, protein binding; 45. Electron carrier activity; 46. Nutrient reservoir activity;47. Metallochaperone activity; 48. Translation regulator activity; 49. Protein tagFig.3 GO annotation of Unigenes in B. spectabilis
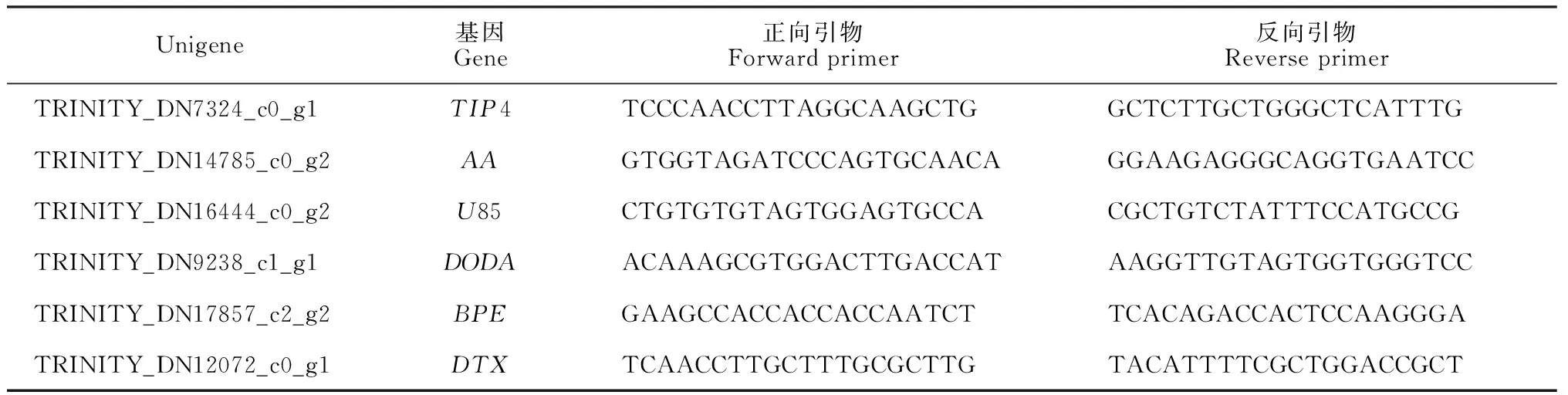
表1 qPCR特异性引物
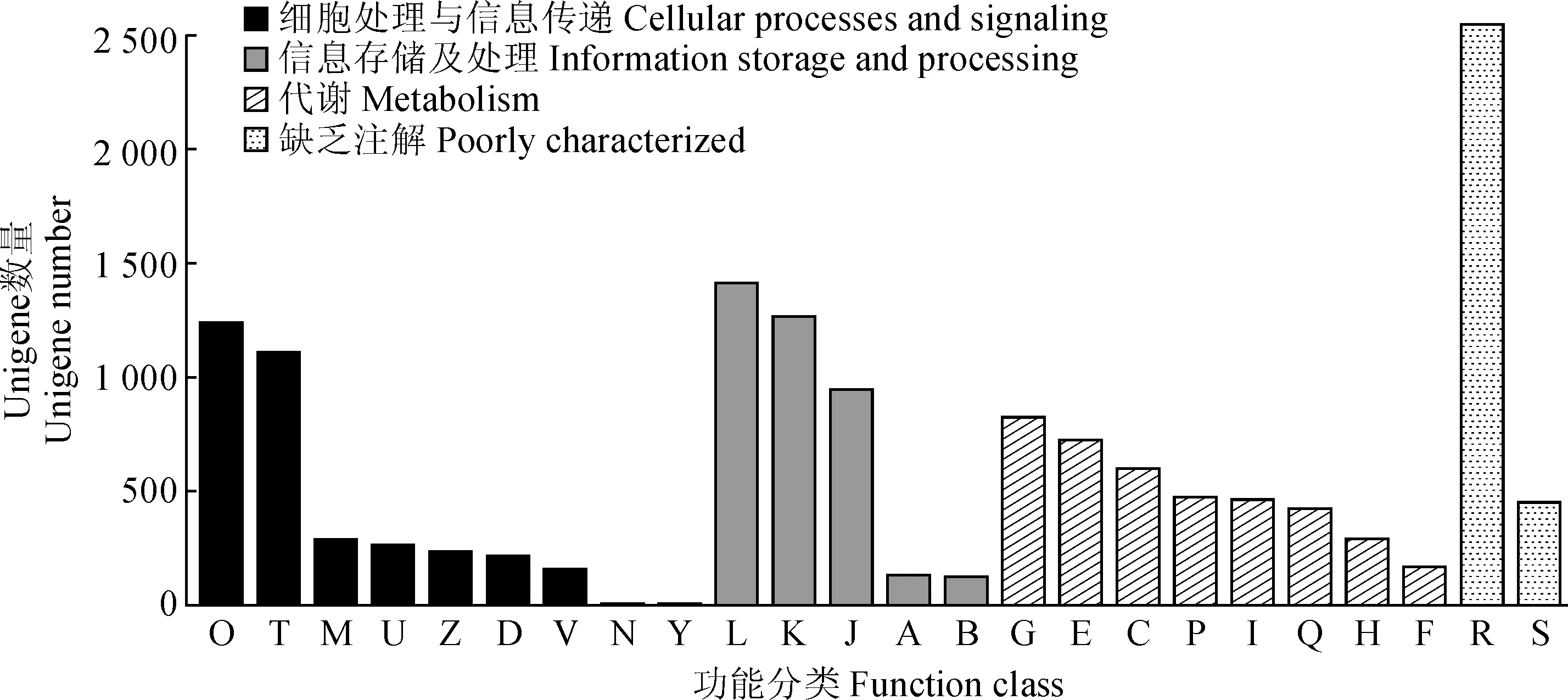
O. 翻译后修饰,蛋白反转,分子伴侣; T. 信号转导机制; M. 细胞壁/细胞膜/质膜合成; U. 细胞内运输、分泌和囊泡运输; Z. 细胞骨架; D. 细胞周期控制,细胞分裂,染色体分隔; V. 防御机制;N. 细胞运动; Y. 核酸结构; L. 复制、重组和修复;K. 转录; J. 翻译、核糖体结构和生物合成; A. 加工和修饰; B. 染色质结构和动力学; G. 碳水化合物转运和代谢; E. 氨基酸转运和代谢; C. 能源生产和转换; P. 无机盐转运和代谢; I. 脂转运和代谢; Q. 次生代谢产物的合成,转运和代谢; H. 辅酶转运和代谢; F. 核苷酸转运和代谢; R. 一般功能预测; S. 未知功能图4 叶子花转录组Unigene的COG功能注释O. Posttranslational modification, protein turnover, chaperones; T. Signal transduction mechanisms; M. Cell wall/membrane/envelope biogenesis; U. Intracellular trafficking, secretion, and vesicular transport; Z. Cytoskeleton; D. Cell cycle control, cell division, chromosome partitioning; V. Defense mechanisms; N. Cell motility; Y. Nuclear structure; L. Replication, recombination and repair; K. Transcription; J. Translation, ribosomal structure and biogenesis; A. RNA processing and modification RNA; B. Chromatin structure and dynamics; G. Carbohydrate transport and metabolism; E. Amino acid transport and metabolism; C. Cell cycle control, cell division, chromosome partitioning; P. Inorganic ion transport and metabolism; I. Lipid transport and metabolism; Q. Secondary metabolites biosynthesis, transport and catabolism; H. Coenzyme transport and metabolism; F. Nucleotide transport and metabolism; R. General function prediction only; S. Function unknownFig.4 Functional annotation of Unigenes in B. spectabilis

图5 叶子花转录组差异表达基因荧光定量PCR验证Fig.5 The experimental validation of differential expression genes in B. spectabilis by quantitative PCR
2.3 荧光定量PCR验证
在苞片表达量相对上调的基因中,选择了5个Unigene(表1)进行验证(TIP4作为内参基因)。实验结果表明每个基因在苞片中的表达量均远高于叶片,实验结果与预测结果相符,验证了差异表达的准确性(图5)。其中DODA基因在叶片中的表达量比内参基因TIP4低,而其他基因的表达量均高于内参基因。
3 讨 论
叶子花在景观园艺和环境美化有着广泛应用,叶子花苞片色彩鲜艳多样,而且花期长、耐污染,是绿化美化环境比较好的选择植物[33]。本研究通过研究同一时期叶子花的苞片与叶片在转录水平的差异,能更好地理解物种不同组织在同一时期基因的选择性表达以及阐释苞片在物种演化过程中发挥的生物学作用。本实验对叶子花的叶片和苞片分开收集,一起拼接。由于没有参考基因组,故采用Trinity进行重头拼接。得到的转录本是Unigenes的3倍,说明叶子花基因组在表达之后有很多RNA进行了RNA剪切,产生了大量的同源异构体(isoform)。将Unigenes分别与各大公共数据库(nr库、COG、Swiss-Prot蛋白数据库等)比对,与已知最大的非冗余蛋白序列库(nr库)比对率55.26%,仍有部分基因功能未知。这些功能未知的基因在物种营养器官和繁殖器官均有表达,可能在叶子花的演化过程中扮演相当关键的作用,这些基因的功能研究以及后续的调控机制都还有待于进一步研究。在进行差异表达分析时,使用了不需要生物学重复的edgeR方法,通过此方法可以极大地避免结果的假阳性,并通过后续的qRT-PCR抽样验证了各基因在叶子花的苞片和叶片差异表达情况与转录组测序的结果一致。
由于现阶段对非模式生物的苞片发育机制研究很少,本研究根据苞片和叶片的差异表达基因研究的结果借助已报道的分子学证据和叶子花的宏观特征来阐释苞片在该物种演化过程中发挥的作用。叶子花苞片叶状纸质,色彩艳丽,常呈红色或深紫色[33]。在差异表达分析中发现,苞片高表达的基因有与花青素(CHI1)和色素合成关键酶(DOD)相关的同源基因。之前研究发现叶子花花色发生变化主要作用是甜菜色素,而多巴双加氧酶(DODA)是叶子花中参与甜菜色素合成酶的关键酶[34-35]。 然而对苞片差异基因进行GO功能注释发现,其中有部分基因参与到黄酮类化合物的生物合成。在模式生物拟南芥的研究中,参与类黄酮代谢基因DTX35在花序组织中尤其是花卉的表皮保卫细胞中特异高表达[36]。Mol J等[37]通过突变分析也验证了花色受到花青素和黄酮醇类化合物的影响。因此推测,叶子花苞片具有鲜艳的颜色从而取代了花被片的相关功能,主要是受到甜菜色素合成通路中相关酶的高表达以及类黄酮素化合物合成导致的。对叶片高表达基因进行GO富集以及KEGG富集发现叶片在这一时期主要是参与碳固定、戊糖磷酸化和光合作用等生理活动,然而在苞片高表达富集的基因中没有参与光合作用的基因,这与形态得到的结果一致。说明叶子花的苞片作为特化的叶片,已经基本失去了光合作用的能力,其生理功能更贴近于繁殖器官,不再为植株提供能量。叶子花的花期为9月到次年3月,会经历温度较低的时期,本研究在叶片高表达和苞片高表达的基因中均发现了叶子花对寒冷刺激作出反应的相关基因(At1g32060、PER57等),当受到寒冷刺激时该类基因表达会增加[38-40],体现了叶子花对于低温环境的耐受性。同时,在苞片的高表达的基因中,发现了参与调控花瓣大小的转录因子BPE[41]以及只在花和根部特异组织表达的基因(U85A3)[42],可见叶子花的苞片在基因转录水平上已经有了类似花瓣的功能。本研究中还发现了叶子花苞片中一些应对外界环境的基因呈高表达趋势,其中包括应对紫外线(UVR8)[43-44]以及生物刺激(BFRUCT4)[45]的基因。推测由于叶子花苞叶颜色较深,容易受到紫外线的影响,而且容易吸引外界生物,因此相关基因的表达在演化中逐渐升高,其具体的生物学意义和基因调控通路还需进一步研究。此外,在苞片差异基因中我们还发现了与植物相关化合物合成(脂肪酸、木聚糖和类单萜等)、代谢(油脂和糖基类等)、酶活性相关(果胶乙酰酯酶、过氧物酶和蔗糖α-葡糖苷酶等)等基因,这些基因的高表达可能在叶子花苞发育相关时期物质能量供应方面扮演着重要角色。
综上所述,叶子花的苞片在演化过程中,其色素调控相关的基因发生了变化,一些花瓣发育相关的基因和对外界刺激的基因开始表达。这些都说明叶子花的苞片在发育过程中受到相关基因的影响,渐渐演化出了类似花瓣的结构,协同并逐渐替代花瓣的一部分功能。本研究对叶子花叶片和苞片的转录组特征的探讨,为未来精细研究花瓣状苞片的基因调控机制奠定了基础,同时也可以为研究具有类似性状的类群的形态学演化提供了参考。
