Vaspin对高脂喂养小鼠肝脏脂质聚集的影响
2018-07-18吴光秀周泽华孙建娟况小璐
吴光秀 周泽华 孙建娟 唐 亮 熊 那 唐 亮 况小璐 肖 蓉
(重庆涪陵中心医院内分泌科,重庆 408000)
脂肪组织不但是机体最主要的能量储存器官,而且是重要的内分泌组织,分泌多种细胞因子,在维持机体能量代谢平衡及内环境稳态中发挥着极其重要的作用〔1〕。Vaspin是内脏脂肪组织来源的丝氨酸蛋白酶抑制剂,是新近从一种2型糖尿病大鼠(OLETF rat)的内脏白色脂肪组织中发现并分离的脂肪细胞因子,广泛表达于脂肪、肝脏、胃、下丘脑等组织〔2~4〕。研究发现Vaspin与肥胖、胰岛素抵抗、动脉粥样硬化、2型糖尿病(T2DM)及其并发症等明显相关〔5~10〕。Vaspin能够提高小鼠基础代谢率,抑制肝糖生成,改善胰岛素抵抗,提高胰岛素敏感性〔1,11〕。然而,Vaspin对高脂饮食诱导肝脏脂肪聚集的影响尚不完全清楚。本研究拟利用小鼠源性Vaspin重组蛋白,研究外源性Vaspin对高脂饮食喂养诱导的小鼠肝脏脂肪聚集的调节,以研究Vaspin生物学功能及其调节机体代谢的分子机制。
1 材料与方法
1.1材料与试剂 小鼠源性Vaspin蛋白购自瑞士Enzo公司;小鼠普通饲料购于第三军医大学附属大坪医院野战外科研究所实验动物中心,高脂饲料购于江苏美迪森生物医药有限公司,其中普通饲料含脂肪19%,碳水化合物60%;高脂饲料含脂肪45%,碳水化合物35%。聚氰基丙烯酸正丁酯(BCA)测定试剂盒购自碧云天生物科技有限公司;胰岛素测定试剂盒购自武汉优而生生物科技有限公司;RNA提取试剂盒、逆转录试剂盒及荧光染料SyberGreen Ⅱ均购自Takara公司,各检测基因引物均由上海Invitrogen公司合成;兔抗小鼠Vaspin单克隆抗体购自英国Abcam公司,兔抗小鼠β-actin抗体及辣根过氧化物酶标记的羊抗兔IgG抗体均购自中杉金桥生物科技公司。
1.2模型构建及样本 健康雄性C57BL/6J小鼠48只,鼠龄7 w,适应性喂养1 w后,随机分为普食组(NC)及高脂组(HC),分别喂养16 w。于14 w末分别给予两组腹腔注射生理盐水(200 μl/只)或鼠源性Vaspin蛋白(剂量:2 mg/kg),1次/d,共2 w;即NC组(普食+生理盐水组),NV组(普食+Vaspin组),HC组(高脂+生理盐水组),HV组(高脂+Vaspin组);各12只。喂养期间小鼠在笼中可以自由活动,饮水和饲料均充足,每日昼夜周期为8 am~8 pm,室内温度保持(22±2)℃。
1.3肝组织提取与保存 小鼠断颈处死,75%医用酒精消毒手术区域3次,利用无菌剪刀剪开小鼠腹壁,暴露肝脏;更换无菌剪刀快速、轻柔离断肝脏,利用预冷的无菌生理盐水洗涤组织残留血液,利用滤纸吸干残留液体,用剪刀剥离附属胆囊等组织后部分立即保存于液氮罐,部分直接保存于4%多聚甲醛液体。
1.4肝组织HE染色 4%中性多聚甲醛固定的肝脏标本,常规石蜡包埋、切片、二甲苯和系列梯度酒精脱水;之后利用苏木精、伊红染色。干燥后于普通显微镜下进行观察。
1.5肝脏三酰甘油(TG)测定 测定试剂盒购自北京普利莱基因技术有限公司,操作过程按照说明书通过酶法检测组织总TG含量。
1.6基础生化代谢指标测定 小鼠禁食10 h后,摘除眼球取血至含有肝素抗凝剂的Eppendorf管中,离心后收集血浆样本,-80℃保存待测。空腹血糖采用葡萄糖氧化酶法测定;TG、总胆固醇(TC)、游离脂肪酸(FFA)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)均用酶法测定;血浆胰岛素采用酶联免疫吸附法检测。
1.7血浆Vaspin测定 空腹血浆Vaspin(武汉优而生生物科技公司,编号:SEA706Mu)采用双抗体夹心酶联免疫法检测;测定过程严格按照试剂盒说明书进行,其中小鼠血浆采用试剂盒所提供样品稀释液进行1∶4稀释。
1.8实时荧光定量聚合酶链反应(RT-PCR)检测基因mRNA表达 用Trizol法提取肝脏总RNA,取1 μg逆转录为cDNA。采用RT-PCR检测各目的基因表达,利用2-△△Ct值计算目的基因的相对表达量,实验重复3次。各目的基因引物序列如下:β-actin:上游引物-5′GTAAAGACCTCTATGCCAACA-3′,下游引物-5′-GGACTCATCGTACTCCTGCT-3′; 肝脏乙酰辅酶A羧化酶(ACC):上游引物-5′AGCAGTTACACCACATACAT-3′,下游引物-5′GTCATCACCATCTTCATTACC-3′;脂肪酸合成酶(FAS):上游引物-5′CTCATCCACTCAGGTTCAG-3′,下游引物- 5′AGGTATGCTCGCTTCTCT-3′; 肉毒碱棕榈酰转移酶(CPT)-1:上游引物-5′AGCCAGACGAAGAACATC-3′,下游引物- 5′CCTTGACCATAGCCATCC-3′; 激素敏感性脂肪酶(HSL):上游引物-5′AAGACCACATCGCCCACA-3′,下游引物-5′CTGAAGGCTCTGAGTTGCT-3′。
1.9肝脏组织Vaspin蛋白表达测定 利用蛋白裂解液放射免疫沉淀(RIPA)及蛋白酶抑制剂苯甲基磺酰氟(PMSF)等裂解肝脏,低温12 000 r/min离心30 min。之后,吸取上清通过BCA法检测总蛋白浓度。取100 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,经湿转转于聚偏氟乙烯(PVDF)膜,室温封闭1 h后,依次加入稀释的一抗、二抗反应并洗脱,通过电化学发光成像系统进行成像,以各目的蛋白与内参β-actin条带灰度值之比表示目的蛋白的相对表达量。
1.10统计学方法 采用SPSS20.0统计软件进行t检验、ANOVA分析。
2 结 果
2.1各组肝脏Vaspin表达水平变化 与NC组比较,HC组肝脏Vaspin mRNA及蛋白表达明显增高(P<0.01);NV组及 HV组肝脏Vaspin mRNA及蛋白表达显著高于NC组、HC组(P<0.01)。见图1和表1。
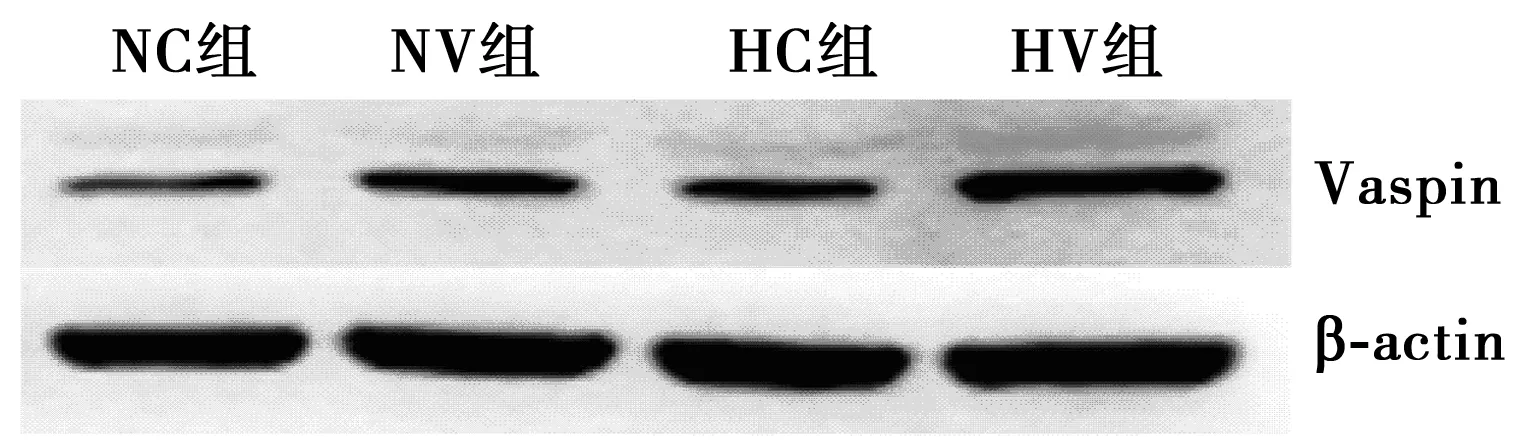
图1 各组肝脏组织Vaspin mRNA及蛋白相对表达量

组别Vaspin mRNAVaspin蛋白NC组1.00±0.101.00±0.11NV组14.82±1.371)6.27±0.651)HC组4.91±0.421)3.68±0.381)HV组15.36±1.732)6.69±0.592)
与NC组相比:1)P<0.01;与HC组相比:2)P<0.01;表3同
2.2各组基础代谢指标 与NC组比较,HC组体重、FBG、TG、TC、FFA、LDL-C、FIns及血浆Vaspin水平明显升高,而HDL-C水平显著降低(P<0.05或P<0.01)。HV组体质量、FBG、TG、TC、FIns、LDL-C和FFA明显低于HC组;而HDL-C及血浆Vaspin浓度高于HC组(P<0.01)。见表2。
2.3各组肝脏脂肪聚集程度 HC组肝细胞脂质空泡明显形成,并伴大量炎症细胞聚集;与HC组相比较,HV组肝脏脂质空泡数量及相对面积均明显减少。见图2。
2.4各组肝脏脂质代谢关键基因变化 与NC组比较,HC组ACC、FAS mRNA表达增高,而HSL、CPT-1明显降低(P<0.01),HV组ACC、FAS mRNA表达明显低于HC组(P<0.01), 而CPT-1、HSL表达水平明显高于HC组(P<0.01);NC组及NV组ACC、FAS、HSL及CPT-1表达差异无统计学意义(P>0.05)。见表3。
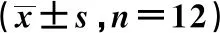
表2 各组基础生化指标比较
与NC组比较:1)P<0.05,2)P<0.01;与HC组比较:3)P<0.01
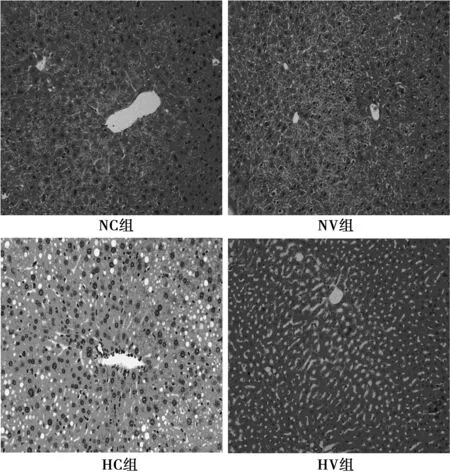
图2 各组小鼠肝脏脂质聚集程度(×100)

组别ACCFASCPT-1HSLNC组1.00±0.091.00±0.101.00±0.121.00±0.10NV组1.02±0.111.09±0.980.97±0.091.12±0.12HC组3.96±0.401)4.03±0.481)0.61±0.091)0.50±0.061)HV组1.96±0.172)2.36±0.212)1.13±0.122)1.26±0.132)
3 讨 论
Vaspin是2005年首次报道的一种主要由腹腔脂肪组织合成、分泌的丝氨酸蛋白酶抑制剂,属于丝氨酸蛋白酶抑制剂家族成员之一〔1〕。临床研究表明肥胖、T2DM及胰岛素抵抗人群血清中或内脏脂肪组织中Vaspin水平较健康人群均明显升高,而且升高幅度与糖脂代谢指标、胰岛素敏感性等相关指标密切相关〔5~10,12〕。另外,近期的一些研究表明,不论是外周还是中枢 Vaspin蛋白或过表达载体输注均可以降低鼠空腹血糖,抑制高脂饮食诱导的肥胖鼠的食欲及肝糖生成,从而提高系统胰岛素敏感性;然而,抑制或敲除Vaspin表达能够进一步加重高脂饮食喂养或基因诱导所致的糖代谢紊乱〔2,4,11,13〕。近来,国内外学者一致认为胰岛素抵抗是糖脂代谢等代谢紊乱性疾病的共同病理生理基础,胰岛素抵抗与肥胖紧密相关〔14〕。
过多的脂肪摄入是机体糖脂代谢紊乱的最主要环境危险因素。高脂喂养是目前诱导肥胖、高脂血症及肝脏非酒精性脂肪性肝病的通用手段〔15〕。
本研究显示,在高脂诱导肥胖及胰岛素抵抗大鼠其内在脂肪组织Vaspin 的 mRNA 及蛋白水平均明显增高;其他多项临床研究发现升高的血浆或组织Vaspin表达与肥胖、胰岛素抵抗及T2DM的发生发展密切相关,且随着胰岛素敏感或肥胖程度的改善,Vaspin表达明显降低甚至降至正常水平〔5~10〕。与此研究结果一致的是,本研究研究显示高脂喂养16 w能够明显诱导血浆Vaspin水平及肝脏组织Vaspin的mRNA、蛋白表达。推断Vaspin的表达升高可能是机体对高脂饮食所诱导的糖脂代谢负荷的代偿性调节,在一定程度上有益于肥胖及胰岛素抵抗的改善。
动物研究发现Vaspin 基因表达上调鼠能够显著提高肥胖小鼠的糖耐量水平,降低小鼠体重,调节胰岛素作用信号通路〔2,11〕。与此相一致的是,本研究结果显示Vaspin慢性持续输注能够明显抑制高脂饮食喂养所诱导的肝脏脂肪细胞变性程度及肝脏TG含量蓄积。这进一步有力说明了Vaspin对糖、脂代谢紊乱均有明显的改善作用。然而,Vaspin输注对普通饮食喂养的小鼠肝脏脂质聚集无明显影响,这可能是由于Vaspin发挥生理作用具有明显的内环境依赖性。
本研究结果表明Vaspin蛋白输注能够抑制高脂喂养诱导肝脏脂肪合成关键分子FAS、ACC的mRNA表达,而显著促进脂肪分解限制酶HSL、CPT-1的表达,然而,Vaspin蛋白输注对普通饮食喂养组脂肪代谢关键分子的表达无明显影响。因此,Vaspin可能通过抑制肝脏脂肪合成、促进脂肪分解代谢而抑制肝脏脂肪蓄积,从而降低高脂饮食所诱导的体重增加。Vaspin基因表达增多可能通过中枢特定神经核团活性而调节肝糖生成即胰岛素敏感性〔13〕,然而,对于Vaspin表达上调是间接通过中枢调节肝脏脂质聚集或直接调节肝脏脂肪代谢及Vaspin调节脂代谢的具体机制需要深入研究。
4 参考文献
1Flier JS.Obesity wars:molecular progress confronts an expanding epidemic〔J〕.Cell,2004;23;116(2):337-50.
2Hida K,Wada J,Eguchi J,etal.Visceral adipose tissue-derived serine protease inhibitor:a unique insulin-sensitizing adipocytokine in obesity〔J〕.Proc Natl Acad Sci U S A,2005;102(30):10610-5.
3Korner A,Neef M,Friebe D,etal.Vaspin is related to gender,puberty and deteriorating insulin sensitivity in children〔J〕.Int J Obes(London),2011;35(4):578-86.
4Kloting N,Kovacs P,Kern M,etal.Central vaspin administration acutely reduces food intake and has sustained blood glucose-lowering effects〔J〕.Diabetologia,2011;54(7):1819-23.
5Aust G,Richter O,Rohm S,etal.Vaspin serum concentrations in patients with carotid stenosis〔J〕.Atherosclerosis,2009;204(1):262-6.
6Belin EJ,Ali MI,Mintz J,etal.Obesity induced-insulin resistance causes endothelial dysfunction without reducing the vascular response to hindlimb ischemia〔J〕.Basic Res Cardiol,2009;104(6):707-17.
7Seeger J,Ziegelmeier M,Bachmann A,etal.Serum levels of the adipokine vaspin in relation to metabolic and renal parameters〔J〕.J Clin Endocrinol Metab,2008;93(1):247-51.
8Kloting N,Berndt J,Kralisch S,etal.Vaspin gene expression in human adipose tissue:association with obesity and type 2 diabetes〔J〕.Biochem Biophys Res Commun,2006;339(1):430-6.
9Teshigawara S,Wada J,Hida K,etal.Serum vaspin concentrations are closely related to insulin resistance,and rs77060950 at SERPINA12 genetically defines distinct group with higher serum levels in Japanese population〔J〕.J Clin Endocrinol Metab,2012;97(7):E1202-7.
10Youn BS,Kloting N,Kratzsch J,etal.Serum vaspin concentrations in human obesity and type 2 diabetes〔J〕.Diabetes,2008;57(2):372-7.
11Nakatsuka A,Wada J,Iseda I,etal.Visceral adipose tissue-derived serine proteinase inhibitor inhibits apoptosis of endothelial cells as a ligand for the cell-surface GRP78/voltage-dependent anion channel complex〔J〕.Circ Res,2013;112(5):771-80.
12Gkiomisi A,Makedou KG,Anastasilakis AD,etal.Serum vaspin levels in women with and without gestational diabetes mellitus during pregnancy and postpartum〔J〕.Cytokine,2013;61(1):127-32.
13Luo X,Li K,Zhang C,etal.Central administration of vaspin inhibits glucose production and augments hepatic insulin signaling in high-fat-diet-fed rat〔J〕.Int J Obes (Lond),2016;40(6):947-54.
14Bray GA.Medical consequences of obesity〔J〕.J Clin Endocrinol Metab,2004;89(6):2583-9.
15Marchesini G,Bugianesi E,Forlani G,etal.Nonalcoholic fatty liver,steatohepatitis,and the metabolic syndrome〔J〕.Hepatology,2003;37(4):917-23.
