根治性切除治疗原发性肝癌患者预后分析*
2018-07-17黄建文杨友超徐长青文天夫
黄建文,杨友超,徐长青,文天夫
中国和东南亚地区原发性肝癌(PLC)发病率较高。有研究统计显示肝癌发病率居全球肿瘤发病率的第5位,死亡率居第三位,而在我国肝癌的发病和死亡人数约为全球的一半[1,2]。目前,肝癌治疗尚无特效疗法。因此,临床上治疗肝癌的主要手段仍为手术切除治疗,但较多研究指出,术后患者预后较差[3,4]。临床上,一般将肿瘤大小作为根治性切除的依据[5]。在我国,多数肝癌患者伴有肝硬化等相关疾病,此类患者的病情更为特殊,单以肿瘤大小作为判定依据存在不足。本研究回顾性分析了我院采取手术切除治疗的PLC患者的临床资料,以探讨影响患者生存的相关因素。
1 资料与方法
1.1 一般资料 2008年1月~2012年1月我院收治的PLC患者325例,其中5例肝癌破裂出血、17例经病理学检查排除PLC,2例患者资料缺失。PLC诊断符合中国抗癌协会肝癌专业委员会制定的诊断标准[6]。本次研究最终入组301例PLC患者,其中男性195例,女性106例,年龄36~72岁,平均年龄为52.4±7.3岁。肿瘤直径>5 cm者194例,肿瘤直径≤5 cm者107例。纳入患者经术前影像学检查显示肿瘤无转移、肝功能Child-Pugh评分为A级或B级。排除标准:既往存在上消化道大出血、肝性脑病病史、肿瘤转移或伴有全身性疾病不能耐受手术者。本研究通过我院医学伦理委员会批准同意。患者及其家属术前签署手术知情同意书。
1.2 手术方法 经右胁缘下切口进腹,分离韧带,使肝脏充分游离,观察肿瘤大小、部位。行根治性手术切除。利用电刀在距肿瘤2.0 cm处标记预切除线,沿切除线离断并处理相应血管,完整切除肿瘤。缝扎断面出血点,应用止血材料处理肝断面。
1.3 检测与检查 使用AU5800全自动生化分析仪(美国,贝克曼库尔特)检测血生化指标;使用Philips 16排螺旋CT扫描仪(瑞士,飞利浦)行腹部扫描。
1.4 统计学方法 应用 SPSS 19.0统计学软件进行数据处理,对服从正态分布的计量资料以(±s)表示,采用独立样本t检验,对方差不齐资料采用t’检验;计数资料采用卡方检验;采用Kaplan-Meier行生存分析,并行Log-Rank法检验;采用COX多因素回归模型分析影响患者无瘤生存期和总生存期的危险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者术前肝功能和病理学特征比较 肿瘤直径>5 cm组有血管侵犯者比例显著高于肿瘤直径<5 cm组(P<0.05),而两组间在Child-Pugh评分、肿瘤位置、肿瘤病灶等指标方面差异无统计学意义(P>0.05,表 1)。
2.2 两组血清AFP和肝功能指标的比较 两组患者术前血清AFP和肝功能指标比较差异无统计学意义(P>0.05);手术治疗后 1 m,肿瘤直径 >5 cm组患者血清AFP水平显著高于直径≤5 cm组患者,差异有统计学意义(P<0.05,表2)。
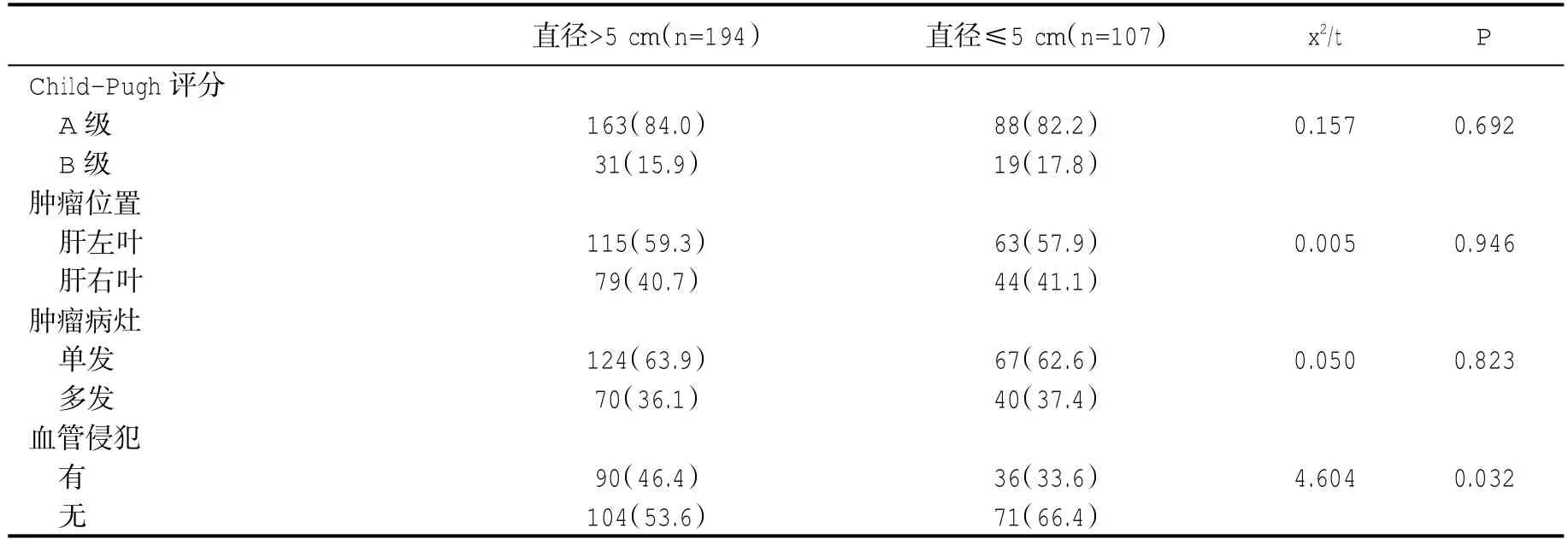
表1 两组术前肝功能和病理学特征[n(%)]比较
表2 两组血清AFP和肝功能指标(±s)比较

表2 两组血清AFP和肝功能指标(±s)比较
与直径≤5 cm组比,①P<0.05
例数 AFP(ng/mL) 胆红素(μmol/L) 白蛋白(g/L) INR直径>5 cm直径 ≤5 cm术前 194 603.9±45.7 18.5±3.3 35.8±4.1 1.4±0.3术后 194 138.2 ±25.6① 18.2±3.1 38.5±3.9 1.1±0.2术前 107 596.5±38.5 17.8±4.3 36.3±3.5 1.4±0.3术后 107 94.7±20.1 17.7±4.0 37.2±4.3 1.1±0.2
2.3 两组患者术后无瘤生存时间和总生存时间比较 随访301例患者术后72个月,患者无瘤生存时间为(20.5±4.1)个月,总生存时间为(26.3±6.2)个月。直径>5 cm组患者总生存期为(19.2±3.8)个月,显著短于直径≤5 cm组的(29.4±4.2)个月,而直径>5 cm组患者无瘤生存期为(12.3±2.7)个月,显著短于直径≤5 cm组的(20.9±5.1)个月(P<0.05,图 1)。2.4影响肝癌患者无瘤生存期和总生存期的多因素分析 对影响患者生存期的因素进行单因素分析发现,年龄>50岁、手术时间超过240 min、术中出血量>500 ml、伴有肝硬化、血清AFP水平高、Child-Pugh分级低、血清白蛋白水平低、存在血管侵犯和肿瘤直径大的患者总生存时间和无瘤生存时间明显缩短(P<005);进一步行多因素分析发现,肿瘤直径、血管侵犯、Child-Pugh分级、术中出血量和肝硬化为影响患者总生存期和无瘤生存期的独立危险因素(P均 <0.05,表3)。

图1 两组生存时间比较

表3 影响肝癌患者术后无瘤生存期和总生存期的多因素分析
3 讨论
目前,临床上常用的治疗PLC的方法主要为手术切除肿瘤[7,8],但评价是否可行肝脏肿瘤切除的标准为肝癌分期,肿瘤直径大小为判断肝癌分期及治疗的重要参考指标[9,10]。当下,临床上有多个分期标准将肿瘤最大直径5cm作为评价肝癌分期的临界值,凭借临界值指导肝癌治疗并对预后进行评估,并将直径大于5cm的肝癌作为诊断中、晚期肝癌的指标[11]。此前,临床上关于将肿瘤大小用于肝切除及预后评估的标准一直存在争议,如BALC分期指南认为,将肿瘤大小作为手术切除指针仅限于早期肝癌患者[12],但在临床应用中发现,该标准并不能完全适应临床实际情况。国外学者[13]研究指出,BCLC分期建议对B/C期肝癌患者采取根治性手术切除治疗可取得与早期肝癌治疗相当的效果。我国学者[14]研究同样指出BCLC分期对B期原发性肝癌患者行手术切除治疗相对于TACE术治疗,其生存期更长。肿瘤直径的大小能否作为根治性手术切除的判断标准及预后判断指证,仍有争议。近年来,香港地区发布的有关指南指出,对肝功能分级Child-Pugh A级的原发性肝癌患者可行根治性手术切除治疗,治疗后肝癌患者术后生存时间延长约1倍。香港指南的手术适应证较BCLC分期更加宽松。本研究纳入301例原发性肝癌患者作为研究对象,旨在探讨影响生存的因素,以为以后是否可让更多患者获益。
本组301例原发性肝癌患者中肿瘤最大直径超过5 cm者为194例(64.5%),提示若简单照搬国外的诊疗指南为患者制定治疗方案可能失去了手术的机会。原发性肝癌患者,尤其是大肝癌患者能否行手术切除还需要考虑患者的肝脏储备功能(切除后剩余肝脏功能)。近来,较多研究指出,若肝脏的储备功能尚好,肿瘤直径不应作为评判行手术切除的标准[15,16]。本研究数据显示,在肝功能Child-Pugh分级方面,大小肝癌组患者无显著性差异,原因可能为术前严格把握肝功能分级筛选标准。在我国,原发性肝癌患者常伴有肝炎或肝硬化基础[17,18],患者相应的肝脏储备功能更差,其能耐受手术切除的可能性减小。因此,对于此类患者,更应密切关注其肝功能储备情况。文献报道[19],对原发性肝癌患者行根治性手术切除后手术并发症的发生率与术前血清白蛋白水平存在关联,其结果与本研究类似。本研究两组患者肝功能分级相似,但肿瘤直径≤5 cm组患者血清白蛋白水平、AFP水平与肿瘤直径>5 cm患者相比,无明显性统计学差异,提示肿瘤大小对肝脏功能存在影响,但不是绝对的,只要认真进行术前肝功能评估,还是可以找到一些肝储备功能较好的患者,以接受手术治疗。
肿瘤直径>5 cm患者术后无瘤生存时间和总体生存时间均明显短于肿瘤直径≤5 cm患者(P<0.05),因肿瘤直径>5 cm患者存在肿瘤血管浸润和转移的发生率可能高于肿瘤直径≤5cm患者。因此,我们认为此结果与肿瘤的生物学行为相符。本组在肿瘤直径>5cm组,有较多的患者存在血管侵犯,对此类患者行手术治疗,理论上可能会导致术后无瘤生存期和总生存期缩短。然而,本研究随访301例患者术后72个月,发现患者无瘤生存时间为(20.5±4.1)个月,总生存时间为(26.3±6.2)个月。结果与既往研究报道相符[20]。此结果直接证明了行根治性手术切除治疗对肿瘤直径≥5 cm患者仍具有重要的临床应用价值。经多因素分析影响生存的危险因素发现,肿瘤血管侵犯、肿瘤最大径>5 cm、术中出血量>500 ml和伴有基础肝硬化或肝功能Child-Pugh B级为患者无瘤生存期和总生存期的独立危险因素。
综上所述,我们认为就原发性肝癌患者的手术治疗而言,肿瘤最大直径≤5 cm患者比肿瘤最大直径>5 cm患者有着更好的生存预后。但单纯的以肿瘤直径作为是否行根治性手术切除的判断依据,而不考虑肝脏功能和肿瘤浸润等因素可能会导致部分患者在根治性手术治疗后效果差,而术前保护和改善肝功能、提高手术熟练程度,缩短手术时间等可以明显改善患者预后。本研究病例数较多,纳入患者的标准难免有所偏差,且为单中心研究,其结果需要在更大范围内开展验证研究。