活性炭储存CH4性能的晶格理论模型及预测
2018-07-17岳高伟郑新军曾春林霍留鹏梁为民
岳高伟,郑新军,曾春林,霍留鹏,梁为民
(河南理工大学 土木工程学院,河南 焦作 454000)
天然气主要成分为CH4,作为洁净能源,其吸附存储(ANG)技术较压缩天然气更具优点,因而获得广泛关注。在超临界条件下,高比表面积的活性炭对CH4的吸附能力是活性炭储存CH4的关键、也是工程应用最关心的问题[1-5]。活性炭CH4的吸附主要是微孔吸附,超临界条件下低压吸附等温线形状均属第一种类型,但高压时等温线出现极值点(图1)。而目前常用的吸附等温线方程均为单调增函数,吸附理论不能成功地描述最大点以后的吸附行为[6]。多项式模型[7]和液相吸附移植模型[8]虽然在数学上成功地描述了具有最大点的吸附等温线,但却不能合理地解释吸附机理[9-10]。
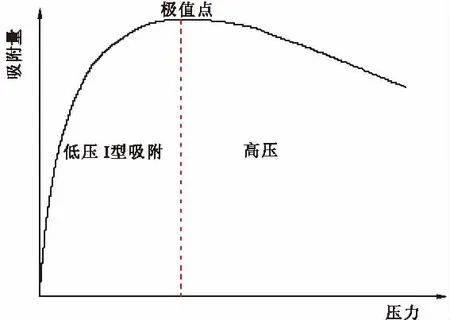
图1 甲烷在活性炭上的吸附等温线Fig.1 Adsorption isotherm of methane on activated carbon
如何建立恰当的模型以描述超临界气体的吸附等温线,不仅可以揭示吸附机理,而且也是开发具有实际应用价值ANG技术的基本环节之一。胡涛等[2]指出高压下等温线出现最大点是由于气相密度与吸附相密度之比值变大造成相对吸附量与绝对吸附量明显不相等引起的。并提出以吸附相密度为参数,用L-F方程表示绝对吸附量的超临界高压吸附等温线模型。Xu等[11]采用双位Langmuir模型对甲烷在页岩上吸附等温线出现极大值的吸附行为进行了拟合分析。周理等[1]基于Gibbs吸附,采用D-A方程描述绝对吸附量,以吸附相密度为参数,并用超临界吸附的极限态作参考态,提出了超临界吸附等温线新的模型化方法。郑青榕等[12]通过实验数据的非线性回归Toth方程参数后,可用来预测甲烷在活性炭上的过剩吸附等温线。但前提是先确定吸附剂的孔径分布(PSD)和吸附质分子吸附时的临界孔宽。Ono S及Kondo S将晶格学、热力学及蒙特卡洛等方法相结合,提出了用以表征分子吸附特征的晶格理论[13]。Aranovich等[14-17]将晶格理论的Ono-Kondo方程引入到气体在微孔吸附剂内的吸附研究中,该模型能够反映超临界流体吸附等温线的特殊性(即随着压力增加吸附量先增大后减小)。杨晓东等[18]、郑莲慧等[19]分别采用晶格理论对甲烷在活性炭和页岩上的吸附特征进行了研究,在吸附平衡压力较低时,预测结果精度较高,但未进行高压时的研究。
为了更好地开发ANG技术,开展CH4在活性炭上跨越临界点的大范围吸附模型尤为必要[20-21]。因此,本文基于晶格理论模型,研究了不同温度下大范围吸附平衡压力时活性炭对CH4的吸附特征,并对其吸附等温线进行了理论预测。
1 超临界流体晶格模型
活性炭对甲烷的吸附主要是微孔吸附,假设活性炭微孔为狭缝,且在狭缝宽度方向吸附N层CH4分子,如图2所示。基于晶格理论,在活性炭与CH4吸附平衡条件下把第i层中的一个CH4分子移到气相中一个空位时,则焓变ΔH、气体温度T和熵变ΔS 满足[15]:

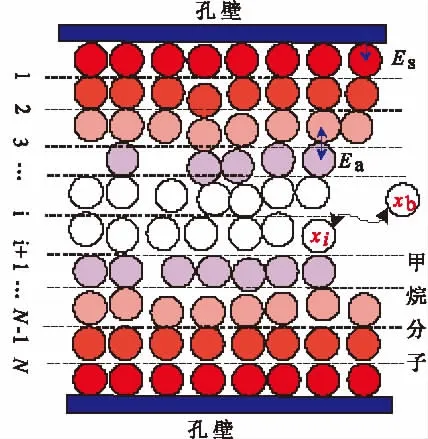
图2 狭缝晶格一维模型Fig.2 One-dimensional model of the slit pore lattice
焓变ΔH和熵变ΔS的立方晶格计算式为[15,19]:

式中,k为玻尔兹曼常数;xi为第i层上气体物质的量分数;xb为i→∞气体物质的量分数;Ea为相邻CH4分子之间的作用势。
将式(2)代入式(1),得[15,17,20-21]:

超临界条件下,CH4不会凝结,由此引入微参量δi:

采用 δi将式(3)线性化,可得:

式中

式(5)为二阶线性差分方程,其通解为:

式中,C1和C2为任意常数;ω1和ω2为特征方程(8)的根[19-20]。

从式(8)可知ω1ω2=1。因此,其中一根的绝对值小于1,另一个绝对值大于1,则:

由式(6),对于临界流体可得α>2,在此条件下,式(8)的根ω1为实数,且为小于1的正值。在此,当i趋于无穷大时,δi趋于 0,而>1,因此由式(7)可得C2=0。
为了确定常数 C1,当 i=1,由式(3)可得
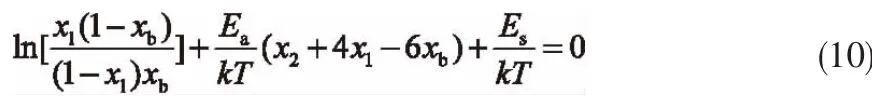
式中,Es为CH4分子与孔壁之间的作用势。

由式(4)、式(7)和 C2=0 可得:

由式(11)和式(12)可确定参数C1,整理得:

2 Gibbs吸附理论
Gibbs吸附等温线表示为[8]:

式中,ne为过剩吸附量,mmol/g;ns为表面单层理论饱和吸附量,mmol/g。

由式(4)、式(7)和 C2=0 得:将式(15)代入式(14)得:
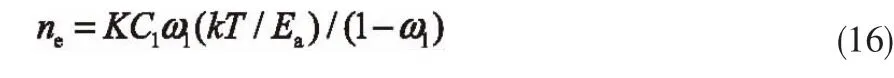
式中,K=ns。
由式(14)和式(16),整理得:
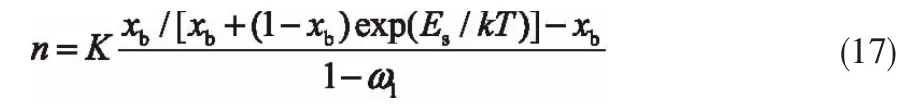
对于活性炭吸附CH4,吸附层数i是有限的,而且,C2≠0,在对称边界 x1=xN条件下,可得[8,13]:
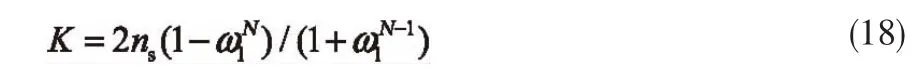
假设CH4分子为单层吸附,则N=2,且x1=x2,式(18)变为:

将式(19)代入式(17),则CH4气体过剩吸附ne可表示为:

CH4气体物质的量分数xb可表示为[21]:

式中,ρb为气相密度,mol/L;ρm为气体最大吸附量时吸附相密度,mol/L。
将式(21)代入式(20),整理得:

由式(6)、式(9)和式(22)组成CH4气相密度 ρb与过剩吸附量 ne的关系, 包含 ns、ρm、Es及 Ea等 4 个参数,通过试验测试CH4吸附平衡压力p和过剩吸附量ne的关系(吸附等温线)可以拟合出4个参数的值。其中,CH4气相密度ρb可用气体状态方程得到:

式中,p为CH4吸附平衡时瓦斯压力;M为CH4分子量;R为气体常数;Z为CH4在温度、压力条件下的压缩系数,采用Redlich-Kwong方程式进行计算:

式中:h为中间变量;Tr=T/Tc为CH4气体的对比温度;pr=p/pc为CH4气体的对比压力;Tc为CH4临界温度,取 190.7K;pc为 CH4临界压力,取 4.64MPa。
3 活性炭高低温环境吸附CH4测试
3.1 试验装置

图3 高/低温吸附装置示意图Fig.3 Diagram of high/low temperature adsorption device
为了实现在不同温度下活性炭对CH4吸附性能的测试,搭建了高低温吸附试验系统(如图3),该系统主要包括高低温变频控制单元、真空脱气单元、吸附平衡单元、数据实时采集系统。温度主要由高低温变频试验箱控制,温度范围:-50~100℃,温度偏差:≤±1℃,温度波动度:±0.5℃。
3.2 试验过程
试验活性炭为商用Ajar活性炭,其BET比表面积达到1200m2/g,微孔体积0.538mL/g。活性炭粒径均为380~830μm,将其放入干燥箱中在105℃条件下干燥24h,干燥后,所制备的样品试验前放在吸附干燥器中备用。活性炭对甲烷的吸附试验采用容积法,甲烷纯度为99.99%。
活性炭对CH4吸附试验分为以下5个过程:①将装有活性炭的吸附罐置于高低温变频控制箱中(如图2),根据实验需要将温度控制系统设置恒定温度;② 抽真空,直至吸附罐中真空度低于10Pa,并维持2h(使活性炭温度与环境温度一致);③ 向充气罐内充入一定量的甲烷气体,当充气罐内的压力恒定后,打开吸附罐的阀门向吸附罐内充入一定气体后,关闭阀门15,直至吸附罐内气体压力不再变化,即吸附平衡;④重复步骤③,得到不同压力下的吸附平衡;⑤重新设置试验温度,在不同温度下测试活性炭的吸附平衡压力。
3.3 测试结果
分别在 3个设定恒温下(283.15K、303.15K、323.15K)对Ajar活性炭的CH4吸附性能进行测试,试验吸附平衡压力在0~14MPa,此温度和压力范围基本囊括了CH4吸附天然气技术 (ANG)的应用范围。不同温度下活性炭的CH4等温吸附曲线如图4所示。
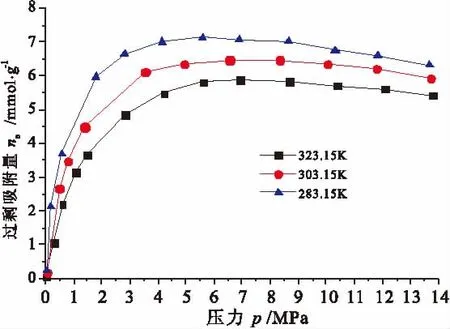
图4 不同温度下CH4在活性炭上的吸附等温线Fig.4 Adsorption isotherms of methane on activated carbon
从图4可以看出,随着温度降低,活性炭对CH4吸附量也越大。这是因为降低温度减弱了CH4分子的能量水平,进而游离CH4分子更容易被吸附,而且被吸附的CH4分子也难以获得足够的能量克服物理吸附力返回气相中,因此瓦斯吸附量增大。不同温度下活性炭对CH4的吸附规律一致:在温度较高、压力较低时,CH4在活性炭上的吸附等温线为 I型等温线;在温度较低、压力较高时,CH4在活性炭上的过剩吸附等温线出现了极大值。这与文献[1,2,12]等试验结果一致。实际上,即使在较高温度下,如果压力足够高,吸附等温线也将出现最大点[22]。
4 活性炭吸附CH4的晶格理论分析及预测
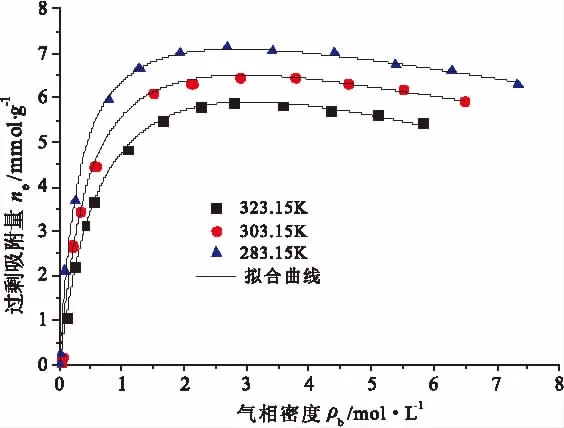
图5 CH4在活性炭上吸附规律的晶格理论模型拟合Fig.5 Fitting curves of CH4adsorption laws with lattice model
为了采用晶格理论模型拟合CH4在活性炭上的吸附规律,采用R-K方程式(23)~(25)计算得到不同吸附平衡压力下CH4气相密度,其与吸附量的关系如图5所示。从图5中可看出,CH4吸附量随气相密度增大先增大后减小,这是因为在低压/高温下,气相密度ρb与气体最大吸附量时吸附相密度ρm相差极大,而xb(即 ρb/ρm)远小于 1可忽略,因此无需区分过剩吸附量与绝对吸附量,即可认为二者相等。但随着吸附压力增大,气相密度ρb与吸附相密度ρm的比值xb随之增大,绝对吸附量随压力的增高而趋于饱和值。此后,测得的过剩吸附量n必然随压力(或主体气相密度ρb)的继续增长而下降。采用式(6)、式(9)和式(22)组成的气相密度ρb与过剩吸附量n的关系对CH4在活性炭上的吸附规律进行拟合,如图4所示,拟合参数见表1。
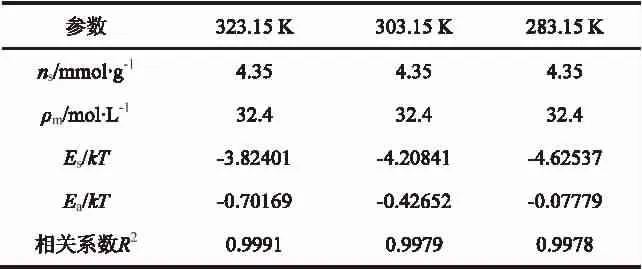
表1 晶格理论模型拟合参数Table 1 Fitting parameters of lattice model
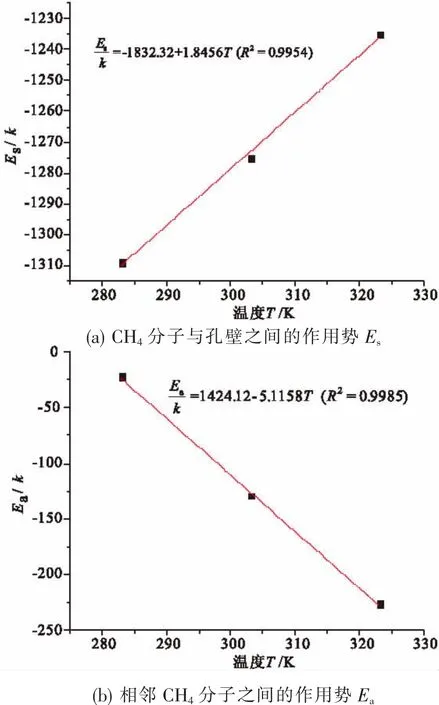
图6 作用势随温度变化规律Fig.6 Interaction potential vs temperature

表2 Es/k和Ea/k与T关系拟合参数Table 2 Fitting parameters between Es/k and Ea/k and T
从表1中的拟合参数中可以看出,采用晶格理论模型拟合CH4在活性炭上吸附出现极值的等温线效果良好,相关系数均在0.99以上。而且不同温度下,活性炭表面单层理论饱和吸附量ns和气体最大吸附量时吸附相密度ρm均为定值。同样温度下,CH4分子与孔壁之间作用势Es远大于相邻CH4分子之间的作用势Ea;而且CH4分子与孔壁之间的作用势Es和相邻CH4分子之间的作用势Ea均与温度T线性相关,如图6所示,拟合参数如表2。这是因为气体分子在吸附剂表面放热失去平均移动能而形成吸附相,温度越高,吸附剂表面活性越大,使得气体分子失去平均移动能越小,即Es越小;而分子之间的作用力使相互之间的距离到达到势能最小值,温度越高,使得分子之间相互作用达势能最小值的势能越大,即Ea越大。
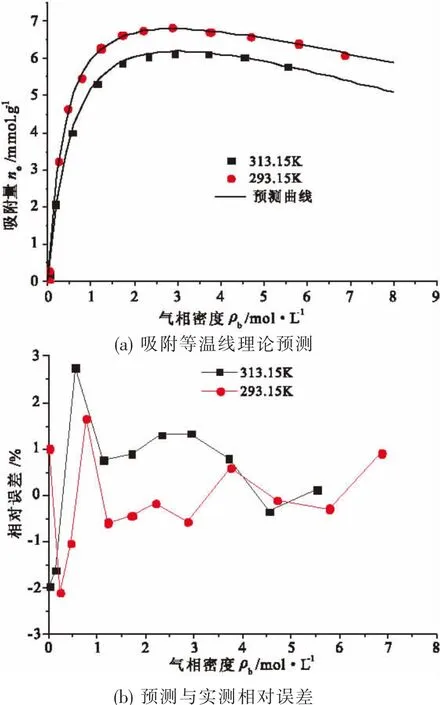
图7 不同温度下吸附量及误差分析Fig.7 Adsorption capacity prediction and error analysis
在不同温度下,采用晶格理论模型对活性炭的CH4的吸附等温线进行预测,计算结果与实测结果如图7所示,基于晶格理论模型的预测结果与实测结果基本一致,其相对误差不超过3%。由此,采用晶格理论模型对吸附等温线出现极大值情况 (大范围吸附平衡压力)的预测是切实可行的。
5 活性炭储存CH4性能分析
活性炭储存CH4的能力包括吸附气量和自由气体量。活性炭对CH4等温吸附曲线的测试和拟合,主要是计算某种条件下(温度和压力)活性炭的吸附气含量ne。而自由气体量可通过孔隙体积Vtot、气相密度ρb等参数求得,两者相加即可得到活性炭储存 CH4的总气量 ngip,即[11]:

式中,Vtot为活性炭孔隙体积,mL/g。
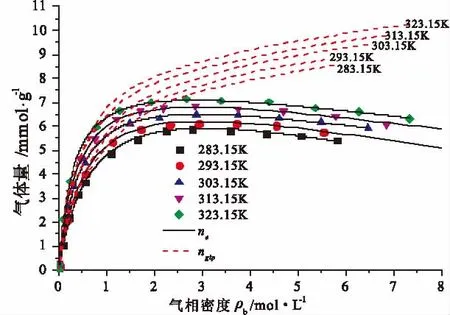
图8 不同温度下活性炭储CH4量Fig.8 CH4quantities in activated carbon under different temperature
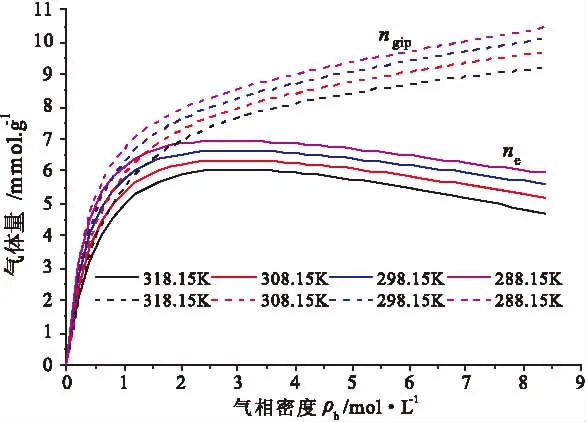
图9 活性炭储CH4量预测Fig.9 Prediction CH4quantities in activated carbon
图8和图9为不同温度下活性炭对CH4的吸附等温线(过剩吸附)和储CH4量的预测结果。从图8和图9可以看出,在压力较低时(<0.5MPa),活性炭过剩吸附量与储CH4总量差别不大,随着压力增大,活性炭储CH4总量与活性炭对CH4的过剩吸附量差别逐渐增大,这是因为活性炭孔隙中游离气体密度逐渐增大,进而自由气体量也随之增大,且占活性炭储CH4总量的比例也随着增大。
6 结论
天然气吸附存储(ANG)技术的关键问题是活性炭对CH4的吸附能力,建立恰当的吸附模型是开发具有实际应用价值ANG技术的基本环节之一。通过微孔吸附超临界流体的晶格理论模型和高低温环境活性炭对CH4的吸附试验,研究了不同温度下大范围吸附平衡压力时活性炭对CH4的吸附特征,并对其吸附等温线进行了理论预测,研究结果表明:
(1)在压力较低时,CH4在活性炭上的吸附等温线为I型等温线,但压力较高时,CH4在活性炭上的过剩吸附等温线出现了极大值,此后,测量吸附量随着气体压力的增大而降低。
(2)采用晶格理论模型拟合CH4在活性炭上吸附出现极值的等温线效果良好,相关系数均在0.99以上。
(3)CH4分子与孔壁之间的作用势Es和相邻CH4分子之间的作用势Ea均与温度T线性相关,且Es/k与温度正相关,Ea/k与温度负相关。
(4)采用晶格理论模型对活性炭的CH4吸附预测结果与实测结果基本一致,其相对误差不超过3%。
(5)活性炭储存CH4的能力比过剩吸附量大得多,特别是高压区。由此,采用晶格理论模型对吸附等温线出现极大值情况的预测是切实可行的,且可用来准确预测活性炭对CH4的储存量。
