低值鱼调味品发酵过程分子量分布的变化
2018-07-17霍奕璇
霍奕璇
(辽宁省鞍山市工业研究院,辽宁 鞍山 114000)
鱼类水解蛋白是水解动物蛋白的一种,除了保持了原本的营养成分外,由于蛋白质被水解,成为大量的易溶于水的游离氨基酸以及一些呈味肽,这样不仅使其风味口感更佳同时也更易被人体所消化吸收,产品特征风味的不同主要取决于其氨基酸种类以及配比。在各类海产品中,因品种的不同,蛋白质的氨基酸组成也随之不同,特别是游离氨基酸的组成更显差异,因此海产品风味的不同主要取决于其不同原材料中游离氨基酸的组成。
1 材料与方法
1.1 材料
凤尾 鱼 (干)、麸 皮、米 曲 霉As 3.042、黑 曲 霉As 3.350。
1.2 仪器和设备
选取SYQ.DSX-280B手提式的不锈钢压力蒸汽灭菌器,722s的分光光度计,pHS-3C的精密pH 计,DK-S26电热恒温型水浴锅,KQ-500DB数控超声波清洗器等。
1.3 实验方法
1.3.1 制备培养基
1.3.1.1 马铃薯培养基(培养霉菌)的配制
土豆0.2kg,蔗糖0.02kg,琼脂0.02kg,水1L。
土豆去皮,切成1cm的正方块,然后加水煮沸约0.5h,通过纱布进行过滤,并在滤液中加一定量的蔗糖和琼脂,待完全溶解补水直到1L,分装后湿热灭菌121℃条件下,0.5h[1]。
1.3.1.2 麦芽汁培养基(培养酵母菌)的配制
首先,向磨碎后的麦芽中加约0.8L的水,然后在锅中(60~65℃)进行糖化,时间控制在3~4h,直到麦芽汁再无淀粉反应。均匀搅拌后进行煮沸过滤,最后调节麦芽汁糖度,控制在8~10,最后进行湿热灭菌121 ℃,30min[2]。
1.3.2 样品的制备
先将低值鱼平均切成0.5cm的小块,然后与麸皮进行混合,并蒸料杀菌(121℃,30min),冷却直到室温后接菌,菌种比例为As3.042∶As3.350为3∶1,种曲的接种量为1%,培养温度为30℃,72h出曲后进行接种,发酵温度最好为室温(发酵历经8月至次年的3月,室温从29℃变化到20℃),加入料液比约为1∶2.3的18°Bé的盐水,并进行高盐稀态发酵,在发酵31天左右时加入耐盐酵母2.297,接菌量2%。
1.3.3 多肽的粗分离及其分子量的测定
将已选定的蛋白标准品通过凝胶过滤层析的时间可以测定出未知样品的分子量。制作标准曲线的方法为以标准蛋白的洗脱体积以及标准蛋白分子量的对数作为标准曲线,在进行标准曲线方程后,根据样品自身不同的洗脱体积,可以清晰准确地算出组分的分子量[3]。
首先测定出已选定的葡聚糖凝胶G-50的吸光度值A(在紫外280nm的条件下)。确保洗脱条件大致相同,洗脱标准的样品液为L-酪氨酸、杆菌肽、中性胰岛素以及细胞色素C,进行测定并逐项记录每一个收集管中溶液的吸光度值A,以吸光度的值作为坐标的纵坐标,洗脱体积作为坐标的横坐标,然后绘制出标准的洗脱曲线。按照每一组的洗脱体积,同时对照标准的洗脱曲线,可以准确地计算出相应分子量的大小。
2 结果与分析——多肽的粗分离及其分子量
2.1 采用Sephadex G-50对发酵90天的样品进行粗分离
本实验采用1.7cm×60cm规格的Sephadex G-50葡聚糖凝胶柱,该凝胶柱适用于粗分离分子量介于30~1.5kDa的样品,以0.9mol/L的NaCl溶液为洗脱液,首先对样品的上样以及其他条件进行优化调整。
2.1.1 上样量的确定
按照凝胶柱的安装要点装柱后,凝胶柱的有效柱长为44cm,凝胶柱的规格为1.7cm×60cm,因此计算出凝胶柱的有效柱长体积为99.8mL,按照规定的要求,确定上样量应为柱床体积的1%~5%,因此对上样量范围限定为1~5mL。选择分别为1,2mL的上样量,流速设定为0.6mL/min,单试管的收集量约为2.4mL,见图1和图2。

图1 上样量为1mL的洗脱曲线Fig.1The elution curve of loading quantity of sample of 1mL
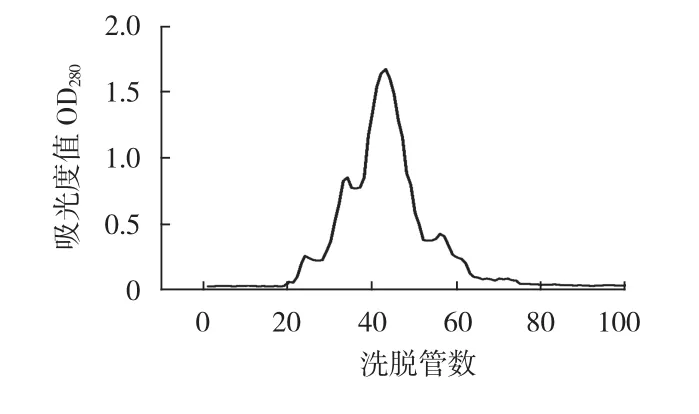
图2 上样量为2mL的洗脱曲线Fig.2The elution curve of loading quantity of sample of 2mL
由图1和图2可知,当上样量为2mL时,样品相对过多,第1个峰和第2个峰并没有完全地进行分开,并且在60~80管中间,存在“拖尾”的现象,分离效果远不如上样量为1mL时的效果好;因此对比曲线分析,建议选择上样量为1mL。
2.1.2 流速的确定
设定的流速分别在0.4,0.6mL/min,并将两管的收集体积均设置在2.4mL,见图3和图4。
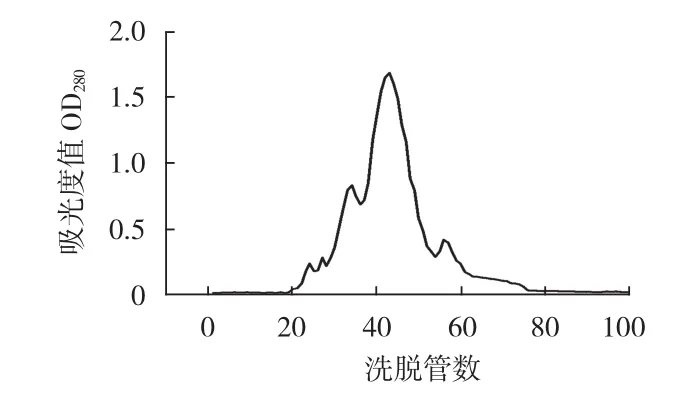
图3 当流速设定为0.4mL/min时的洗脱曲线Fig.3The elution curve when the flow rate is set to 0.4mL/min

图4 当流速设定为0.6mL/min时的洗脱曲线Fig.4The elution curve when the flow rate is set to 0.6mL/min
由图3和图4可知,当流速设定为0.4mL/min时,洗脱到30管左右时,可以看到两峰之间有重叠现象,分离速度过慢导致分离效果不好;流速为0.6mL/min时的洗脱曲线峰形较好,峰形明显,有4个组分被分离出来,因此选择流速为0.6mL/min。
综上所述,本实验采用1.7cm×60cm的Sephadex G-50葡聚糖凝胶洗脱样品,用0.09mol/L的溶液进行洗脱,分离的条件设定为:上样量设定为1mL,流速设定为0.6mL/min,洗脱液的接受容量约为2.4mL。样品分离成为4组组分,最大的吸收峰出现在第24管、34管、43管和61管。
2.2 发酵90天样品的分子量
标准品的分子量:通过牛血清白蛋白、细胞色素C、中性胰岛素、杆菌肽做标准曲线。各标准样品洗脱曲线见图5~图8。

图5 牛血清白蛋白洗脱曲线Fig.5The elution curve of BSA
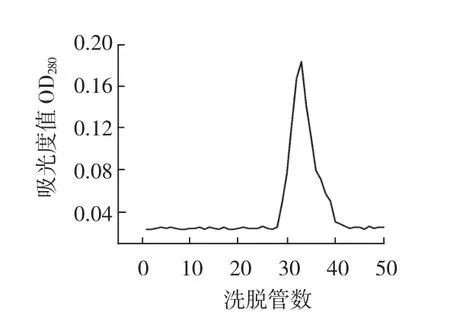
图6 细胞色素C洗脱曲线Fig.6The elution curve of cytochrome C

图7 中性胰岛素的洗脱曲线Fig.7The elution curve of neutral insulin
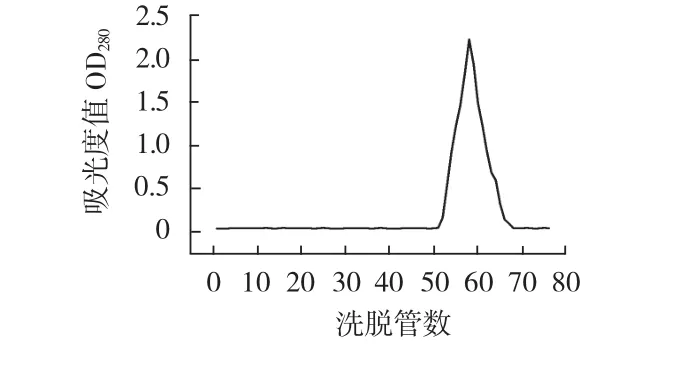
图8 杆菌肽洗脱曲线Fig.8The elution curve of bacitracin
各标准品出峰的管数及洗脱体积与分子量之间的关系见表1。
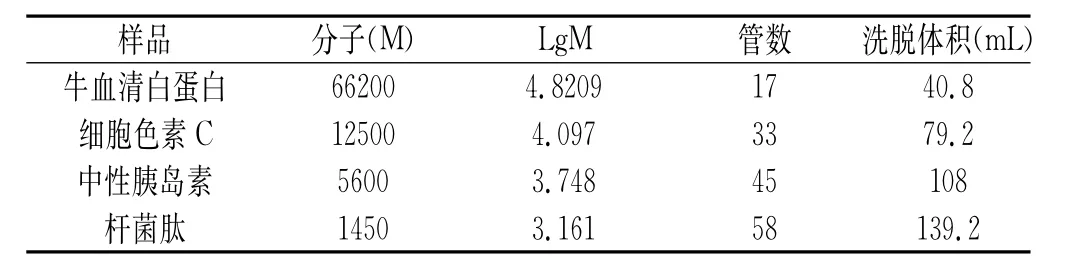
表1 标准品的洗脱体积和分子量间的关系Table 1The relation between molecular weight and elution volume of the standard substance
根据相应的标准品分子量对数和洗脱体积,得出标准洗脱曲线,见图9。

图9 分子量的标准曲线Fig.9The standard curve of the molecular weight
由图9可知,回归方程Y=5.47145-0.0165X,相关系数为R2=0.9940。按照小分子肽分离组分中最大的吸收峰为第24管、第34管、第43管和第61管,可以计算出其分子量分别为33193.17,13336.75,6430.578,1137.274Da。由分子量可知,组分中含有尚未被分解的蛋白质、长链多肽。根据出峰位置可以算出,分子量分布在30000Da左右的肽段,占所有分离组分的2.36%,分子量分布在10000Da的肽段占所有分离组分的8.66%,分子量分布在10000~2000Da的肽段占所有分离组分的82.88%,分子量分布在1000~2000Da的肽段占所有分离组分的5.66%。
2.3 采用Sephadex G-50对发酵180天样品进行粗分离
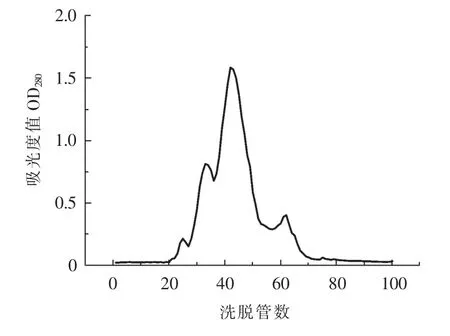
图10 上样量为1mL的洗脱曲线Fig.10The elution curve of input 1mL
由图10可知,明显有4个峰形。分为第25管、33管、42管和62管。根据标准洗脱曲线方程,我们可计算出其分子量分别为30300.52,14609.99,6430.578,1004.015Da。本实验采用微积分原理,结合本实验绘制洗脱曲线的全过程,上面的两个点之间所形成的图形类似看作梯形,梯形的上部分与平滑曲线之间部分可以忽略不计;将所有组成的梯形进行相互叠加,与得到的洗脱曲线峰的总面积比较。通过出峰位置的管数可以算出,分子量在30000Da左右分布的肽段占所有分离组分的2.04%,分子量分布在10000Da的肽段占所有分离组分的9.31%,分子量分布在10000~2000Da的肽段,占所有分离组分的83.58%,分子量分布在1000~2000Da的肽段占所有分离组分的5.06%。
对比不同发酵时间下的分子量分布可知,随着时间的延长,分子量分布在30000Da左右的肽段,所占比例有下降趋势,从发酵90天的2.36%下降到2.04%;分子量分布在10000Da的肽段,所占比例有上升趋势,从90天的8.66%上升到9.31%;分子量分布在10000~2000Da的肽段,所占比例有上升趋势,从90天的82.87%上升到83.59%;分子量分布在1000~2000Da之间的肽段,相应比例呈现下降趋势,从90天的6.10%下降到5.06%。但整体趋势变化并不显著,呈动态平衡状态,这是因为在发酵的过程中,在相应的酶的催化作用下,大分子中的肽慢慢地降解成为小分子的肽,甚至降解成为游离氨基酸。同时,小分子中的肽也进一步降解,逐渐成为游离氨基酸,某一肽段所占比例的升高都会引起另一肽段所占比例的下降。
3 小结
总体看来,不同发酵时间下的肽段主要集中在2000~10000Da,占所有肽段的80%。变化不显著主要是由于在发酵的后期,中性蛋白酶和酸性蛋白酶活力逐渐降低,对蛋白质的生成和降低所发挥的作用逐渐减小,其大分子中肽段开始降解的速度和小分子中肽段开始生成的速度达到了动态平衡,所以发酵后期变化较小。
分子量1000Da的肽段比例呈下降趋势,说明部分肽段越来越多地降解为游离氨基酸,这与氨基态氮的升高呈一定的负相关性。
随着小分子量的肽段逐渐增多,发酵液的风味愈发丰富,这是由于大量呈味氨基酸的溶出和生成,其中常见的氨基酸如天门冬氨酸、谷氨酸、丝氨酸、等都极具鲜味。其中鲜味最为强烈的当属谷氨酸;呈甜味的氨基酸中含有甘氨酸、苏氨酸、色氨酸、脯氨酸、丙氨酸等;再加上发酵过程中产生的琥珀酸、丁酸、乳酸、戊酸、异戊酸、柠檬酸以及醇类和有机酸等生成的酯类等,最终形成低值鱼调味品的风味。
