肠外营养与肠内营养支持对根治性全胃切除术后胃肠功能的影响
2018-07-16唐永钦
李 晋,唐永钦,章 敢
(安徽省滁州市第一人民医院 普外三科, 安徽 滁州 239000)
胃癌属于临床常见的消化系统恶性肿瘤,患者常合并有免疫功能障碍以及营养摄入不良,目前针对胃癌主要的治疗方法是采取全胃根治性切除手术,但是由于围手术期持续性消耗和消化道梗阻等多种因素造成了体内出现负氮平衡,患者体质会进一步降低,影响了手术的后续治疗[1]。由于全胃切除手术对患者腹腔干扰较大,患者术后容易出现疼痛等并发症,术后胃肠功能受到影响,机体免疫功能进一步降低,传统的肠外营养方式近年来发现弊端较大,早期肠内营养方式则有助于保持患者肠黏膜结构与功能完整性,减少了内毒素细菌的异位,改善了患者肠黏膜缺血症状,提升机体的防御机制,减轻了术后的炎症反应[2]。为了观察两种营养支持方式应用在根治性全胃切除手术中对患者胃肠功能影响,我们进行了观察分析,现汇报如下。
1 资料与方法
1.1一般资料回顾性选取2012年10月至2017年6月滁州市第一人民医院普外三科收治的根治性全胃切除术患者58例,根据治疗营养支持方法不同分为对照组和观察组。对照组28例,男15例,女13例;年龄34~69岁,平均(51.00±11.23)岁。观察组30例,男16例,女14例;年龄34~69岁,平均(50.89±11.15)岁。所有患者均行根治性全胃切除术,术前肝肾功能正常,术前和术后 7 d 均未应用免疫治疗和放、化疗,未并存代谢性和肠道炎性疾病。排除合并糖尿病者及精神疾病者。两组患者的年龄和病情等一般资料比较,具有均衡性(P>0.05)。
1.2方法对照组:给予患者肠外营养支持,术后24h开始给予脂肪乳氨基酸注射液1 440 mL/d,其中氮源为乐凡命氨基酸注射液,非蛋白热卡的30%~40%由20%脂肪乳剂供给,60%~70%由10%葡萄糖及5%的葡萄糖盐水供给,水溶性维生素用水乐维他,脂溶性维生素采用维他利匹特,微量元素用安达美(以上均由华瑞公司生产),胰岛素常规按1∶5添加配成3 L袋,经中心静脉输入。观察组:给予患者肠内营养支持,手术中将鼻空肠管插入食管空肠吻合下40 cm,术后d1经鼻空肠管滴注瑞素(每100毫升含蛋白质3.8 g、必需氨基酸1.75 g、脂肪3.4 g、碳水化合物13.8 g、饱和脂肪酸1.6 g、能量100 kcal)1~1.5L,微泵控制输注滴速为50~75m L/h,使用的瑞素稀释度应根据患者耐受情况决定,保证稀释度、温度和滴速患者可以耐受,每间隔4 h用20 mL温开水冲洗鼻肠管1次,防止营养液堵塞。两组均在患者肛门排便后3~5 d停止进行,叮嘱患者进食半流质饮食。两组患者采取不同营养支持方式,为患者提供的总热量全量按30 kcal/(kg·d)计算。
1.3检测方法抽取患者空腹静脉血10 mL,采用酶联免疫吸附法测定患者血清总蛋白、前清蛋白、转铁蛋白与生长激素水平。采用全自动生化分析仪测定患者肝脏功能指标变化,采用郭峰法测定患者红细胞免疫指标和免疫球蛋白变化。
1.4观察指标观察两组患者治疗后排气和排便恢复时间、住院时间、并发症情况、营养状况、生长激素、免疫功能和肝功能水平变化情况。

2 结果
2.1两组患者术后一般状况比较观察组患者排气、排便恢复时间及住院时间均短于对照组(P<0.05,见表1)。
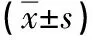
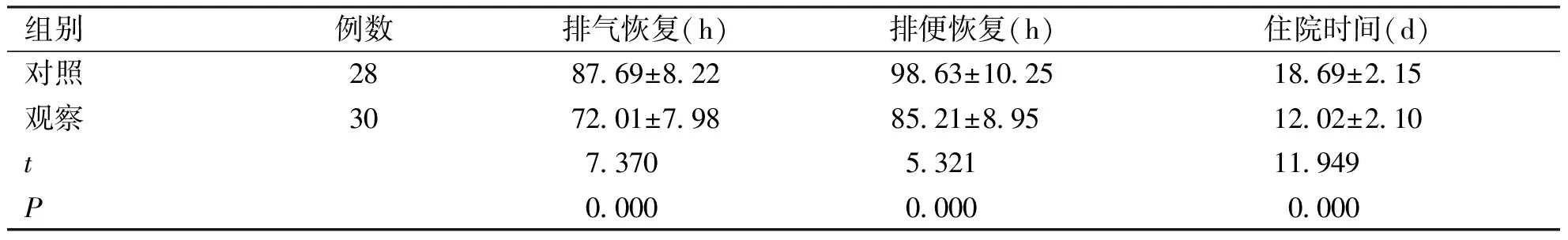
组别例数排气恢复(h)排便恢复(h)住院时间(d)对照2887.69±8.2298.63±10.2518.69±2.15观察3072.01±7.9885.21±8.9512.02±2.10t7.3705.32111.949P0.0000.0000.000
2.2两组患者治疗前后营养状况和生长激素水平比较对照组患者治疗后血清总蛋白、前清蛋白及转铁蛋白水平均较治疗前下降,生长激素水平较治疗前上升(P<0.05)。观察组患者治疗后血清总蛋白、前清蛋白及转铁蛋白水平与治疗前比较无统计学差异(P>0.05),生长激素水平较治疗前升高(P<0.05)。两组患者治疗后营养指标和生长激素水平比较有统计学差异(P<0.05,见表2)。
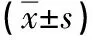

营养状况和生长激素时间对照组(n=28)观察组(n=30)t(组间)P总蛋白(g/L)治疗前70.12±3.3670.14±3.400.0230.982治疗10 d-3.73±3.54-1.03±3.422.9540.005t(组内)5.5761.650P0.0000.110前清蛋白(mg/L)治疗前310.58±32.52312.01±31.210.1710.865治疗10 d-61.78±30.62-2.65±28.477.6210.000t(组内)10.6760.510P0.0000.614转铁蛋白(g/L)治疗前2.75±0.342.77±0.320.2310.818治疗10 d-0.85±0.43-0.05±0.477.5920.000t(组内)10.4600.583P0.0000.565生长激素(g/L)治疗前25.93±2.5425.95±2.570.0300.976治疗10 d6.71±2.8613.69±3.717.9830.000t(组内)12.41520.211P0.0000.000
2.3两组患者治疗前后免疫功能和肝功能水平比较对照组患者治疗后RBC-C3rbR水平较治疗前下降,RBC-ICR、ALT及AST水平较治疗前上升(P<0.05)。观察组患者治疗后RBC-C3rbR水平较治疗前上升,RBC-ICR水平较治疗前下降(P<0.05),但ALT和AST水平与治疗前比较无统计学差异(P>0.05)。两组患者治疗后免疫功能和肝功能水平比较有统计学差异(P<0.05,见表3)。
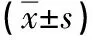

免疫功能和肝功能水平时间对照组(n=28)观察组(n=30)t(组间)PRBC-C3rbR(%)治疗前11.23±0.7111.20±0.730.1580.875治疗10 d-3.13±0.61∗1.01±0.69∗24.1400.000t(组内)27.1518.017P0.0000.000RBC-ICR(%)治疗前11.52±1.3211.55±1.300.0870.931治疗10 d1.86±1.35-2.05±1.1811.7650.000t(组内)7.2919.516P0.0000.000ALT(U/L)治疗前20.14±2.8520.16±2.810.0270.979治疗10 d7.39±2.510.91±2.639.5850.000
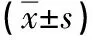
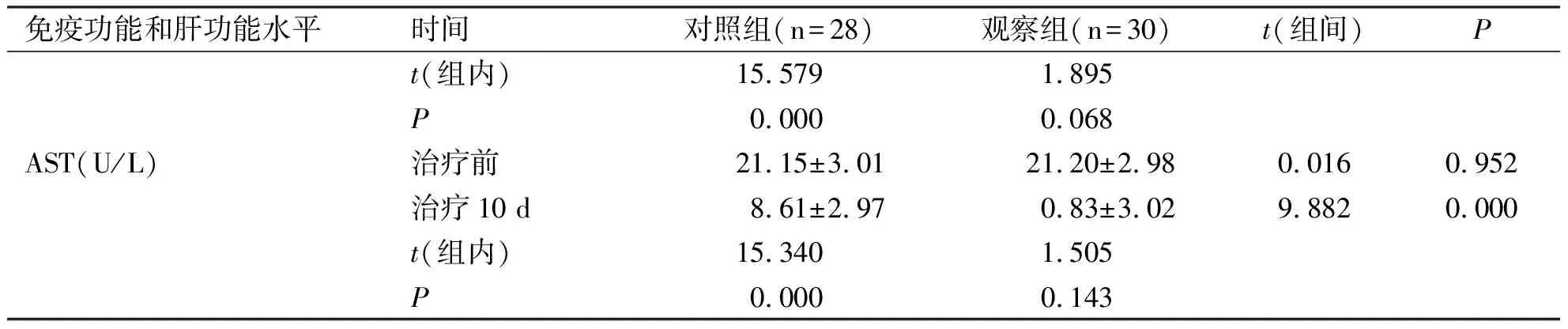
免疫功能和肝功能水平时间对照组(n=28)观察组(n=30)t(组间)Pt(组内)15.5791.895P0.0000.068AST(U/L)治疗前21.15±3.0121.20±2.980.0160.952治疗10 d8.61±2.970.83±3.029.8820.000t(组内)15.3401.505P0.0000.143
2.4两组患者并发症情况比较观察组患者并发症发生率为3%低于对照组(P<0.05,见表4)。
表4两组患者并发症情况比较[n(%)]

组别例数切口感染肺部感染其他并发症发生率(%)对照283(10.71)2(7.14)3(10.71)8(28.57)观察301(3.33)0(0.00)0(0.00)1(3.33)合计584(6.90)2(3.45)3(5.17)9(15.52)χ20.243P0.022
3 讨论
胃肠道肿瘤属于临床常见的恶性肿瘤,尤其在我国沿海城市发病率一直居高不下,肿瘤细胞增殖会让人体营养成分不断被消耗,随着病情不断进展患者会合并疼痛、食欲减退等症状,进一步影响进食,同时胃肠道恶性肿瘤患者本身存在进食困难,这些因素会造成患者营养状况进一步恶化,晚期出现营养不良甚至恶病质,尤其是蛋白质摄入不足会造成免疫功能低下,引发严重后果[3-4]。目前手术治疗一直是胃癌的主要治疗方案,但是大部分患者在术前存在营养不良,同时手术麻醉、操作创伤以及禁食等多种因素会造成患者机体分解代谢增加,营养不良程度加重,患者术后细胞、体液免疫功能降低,容易诱发肺部感染、肺功能障碍以及胃肠吻合口漏等并发症,而且已有研究证实营养不良以及低蛋白血症同患者术后病死率及并发症发生率呈现显著相关性[5-6]。研究显示营养和免疫功能不全一方面会造成手术耐受力下降以及术后创口愈合延缓,同时低蛋白血症也会造成体内胶体渗透压降低,血容量出现不足,患者在术中或者术后对于失血耐受性明显降低;另一方面患者免疫应答能力损伤,感染性并发症和器官功能障碍发病率呈现提升趋势,因此术后营养支持对于胃癌患者围手术期康复至关重要[7-8]。
目前临床应用的营养支持方案主要是肠内营养支持和肠外营养支持,均为补充患者营养的重要方法,能够增加患者摄入热量与氮,促进正氮平衡的回复,减少手术创伤后患者体内高代谢反应和应激反应,改善患者机体的营养状况[9]。研究发现肠外营养会增加患者术后肝脏负担,引发肠道微生物菌群紊乱,可能导致出现小肠粘膜以及肠源性感染等并发症,限制了其在临床应用。近年来研究显示肠内营养支持方法已经被认为是胃肠道肿瘤术后营养支持的首选方法,能够纠正患者手术创伤、维护肠粘膜屏障完整性,调节人体代谢并提升机体免疫功能,减少了胃肠道粘膜损伤,更符合人体的生理性要求[10-11]。研究发现肠内营养支持方案通过改善患者蛋白质代谢,抑制分解,促进合成,可以刺激胃肠激素和免疫球蛋白分泌,促进了胆囊收缩和胃肠蠕动,增加了内脏的血流量,有效的改善患者机体营养状况,提升免疫功能[12]。同时肠内营养支持还会刺激胃肠道激活肠道神经内分泌免疫轴促进肠道激素如神经紧张素、缩胆囊激素与胃激素合成和释放,调节了胃、胆、胰腺分泌,加速了术后患者胃肠蠕动功能恢复,肠内营养还可以维持机体肠粘膜结构、功能完整性,防止细菌菌群发生移位,降低了肠源性感染的发生[13-15]。本研究显示,观察组患者排气、排便恢复时间及住院时间均短于对照组,说明应用肠内营养支持在根治性全胃切除手术后能够缩短患者胃肠功能恢复时间。两组患者治疗后血清总蛋白、前清蛋白及转铁蛋白水平均较治疗前下降,生长激素水平较治疗前上升,观察组和对照组患者治疗后营养指标和生长激素水平比较有统计学差异,说明应用肠内营养支持在根治性全胃切除手术后可以维持患者体内营养状态。两组患者治疗后免疫功能和肝功能水平比较有统计学差异,说明应用肠内营养支持在根治性全胃切除手术后可以减轻患者肝脏负担,增强患者机体免疫功能。在并发症发生情况方面比较,观察组患者并发症发生率为5.41%低于对照组22.86%,说明应用肠内营养支持在根治性全胃切除手术后可以减少术后并发症发生。本研究优势在于观察了肠内营养在胃癌根治性手术后应用的效果,为胃癌围手术期患者选择更为优质的营养支持方法,但是本研究属于回顾性研究,对于患者缺乏远期随访,无法观察远期疗效,因此还有待进一步开展多中心、大样本、长期随机对照研究。
综上所述,肠内营养支持有利于根治性全胃切除术后患者胃肠功能的恢复,可改善患者营养状况,提高患者免疫功能,且安全性高。
