基因沉默LMTK3对甲状腺乳头状癌细胞株BCPAP恶性生物学行为的影响
2018-07-16泮红飞冯继红杨涛羽刘芊伊刘旭恒龙润莹罗军敏
泮红飞,冯继红,杨涛羽,苏 俊,刘芊伊,刘旭恒,龙润莹,殷 茜,罗军敏
(1.遵义医学院 免疫学教研室,贵州 遵义 563099; 2.遵义医学院 贵州省普通高等学校特色药物肿瘤防治特色重点实验室,贵州 遵义 563099; 3.遵义医学院附属医院 肿瘤医院腹部肿瘤科,贵州 遵义 563099;4.遵义医学院附属医院 病理科,贵州 遵义 563099)
甲状腺癌(Thyroid Cancer,TC)是最常见的内分泌恶性肿瘤之一,近年已成为发病率增速最快的恶性肿瘤[1]。甲状腺乳头状癌(Papillary Thyroid Cancer,PTC)是甲状腺癌最常见的一种,约占80%。手术、化疗及I131放疗等治疗手段虽已取得较明显的临床疗效,但复发和转移仍是导致PTC患者死亡的主要原因[2-3]。因此,进一步揭示PTC细胞恶性生物学行为变化的规律及相关的驱动机制,对有效控制PTC患者的复发和转移,以及延长总生存期具有重要临床价值。狐猴酪氨酸激酶3(The lemur tyrosine kinase 3,LMTK3)是丝氨酸/苏氨酸/酪氨酸激酶家族(Serine-threonine-tyrosine kinase family)的重要成员。多项研究已表明,LMTK3在多种恶性肿瘤组织及血清中高表达,干预其基因表达可导致肿瘤细胞相关恶性生物学行为的改变。迄今为止,有关LMTK3与PTC相关性的研究仅限于组织和血清层面,尚未见针对PTC细胞的报道。本研究以PTC细胞模型BCPAP为研究对象,应用基因沉默LMTK3的慢病毒载体感染BCPAP细胞后探讨其增殖、迁移、侵袭及凋亡等恶性生物学行为的改变情况,从而在细胞水平初步阐明LMTK3的生物学功能,为甲状腺乳头状癌靶向治疗的靶点选择提供新依据。
1 材料与方法
1.1主要试剂和仪器人甲状腺乳头状癌细胞株BCPAP购自中科院上海细胞库;胎牛血清和1640培养基购自Gibco公司;含shLMTK3的重组慢病毒载体由OBiO公司包被完成;LMTK3兔抗人多克隆抗体购自Lifespan公司;过氧化物酶标记的山羊抗兔多克隆抗体、过氧化物酶标记的驴抗小鼠多克隆抗体购自Proteintech公司;β-actin小鼠抗人单克隆抗体来自Cell Signaling Technology公司;全蛋白提取试剂盒购自凯基生物科技有限公司;BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒和ECL发光液均购自碧云天公司;Matrigel胶和流式凋亡检测试剂盒购自BD公司;CCK8试剂购自日本同仁公司;Transwell小室购自美国Corning公司;TE2000-S型倒置荧光显微镜购自日本Nikon株式会社;无菌操作台和细胞培养箱购自美国Thermo Fisher Scientific公司;流式细胞计数仪FACS Calibur购自美国Becton- Dickinson公司。
1.2实验方法
1.2.1细胞培养和慢病毒感染人甲状腺乳头状癌细胞BCPAP培养在含10%胎牛血清的1640培养基中,培养条件为5% CO2、37 ℃饱和湿度。将处于对数生长期的BCPAP细胞接种于6孔板中,待细胞融合至70%左右时,进行慢病毒感染。分为五组:以沉默LMTK3的重组慢病毒载体(LV-shLMTK3)的3个序列(分别为LV-shLMTK3-1、LV-shLMTK3-2和LV-shLMTK3-3)和对照慢病毒载体(LV-Control)分别感染人甲状腺乳头状癌细胞BCPAP,作为实验组(LV-shLMTK3)和阴性对照组(LV-Control),空白对照组的细胞不做任何处理。感染条件:每孔1 mL培养基,10%胎牛血清,6×106TU/mL的病毒液,polybrene 5 μg/mL,10 h时换成2 mL无血清培养基,72 h时换为完全培养基,荧光显微镜下观察细胞的感染效率。
1.2.2Western blot方法检测细胞中LMTK3的表达用Lysis Buffer裂解、提取上述五组细胞总蛋白,BCA法测定蛋白含量。将蛋白置于10% SDS-PAGE凝胶中电泳分离,转膜40 min,5% BSA封闭50 min后,加入β-actin小鼠抗人单克隆抗体(1∶1 500)和LMTK3兔抗人多克隆抗体(1∶500),4 ℃孵育12 h,漂洗,再加过氧化物酶标记的驴抗小鼠多克隆抗体和过氧化物酶标记的山羊抗兔多克隆抗体(1∶800),20 ℃孵育1.5 h后滴加发光试剂,于暗室曝光条带。每组3个复孔,取平均数。实验重复3次。从LV-shLMTK3-1、LV-shLMTK3-2和LV-shLMTK3-3三个实验组中选择沉默效果最佳的一组代表实验组,与LV-Control组组合进行后续实验。
1.2.3CCK8法检测沉默效果最佳的LV-shLMTK3组和LV-Control组细胞增殖能力的变化取上述沉默效果最佳的LV-shLMTK3组和LV-Control组处于对数生长期的细胞,以5×103/100 μL/孔的密度接种于96孔培养板,放入5% CO2、37 ℃培养箱分别培养24 h、48 h、72 h、96 h和120 h时,加入10 μL的CCK8试剂继续孵育3 h,用酶标仪在570 nm波长下检测各孔吸光度值。每组3个复孔,取平均数。实验重复3次。
1.2.4Transwell实验检测沉默效果最佳的LV-shLMTK3组和LV-Control组细胞的迁移和侵袭能力的变化Transwell小室置于24孔板中,无血清培养液和液态基质胶7∶1混合,取60 μL铺于每个Transwell上室(6个Transwell上室加基质胶做侵袭实验,6个Transwell上室不加基质胶做迁移实验),5% CO2、37 ℃条件下孵育2 h,弃上层无血清培养液。两组处于对数生长期的细胞均稀释至6×104/mL,12个上室加200 μL细胞悬液,对应的12个下室加600 μL含15% FBS的培养液,5% CO2、37 ℃培养箱中培养48 h,弃培养液,棉签轻擦上室细胞,PBS冲洗4次,10%多聚甲醛固定20 min,自然晾干。加0.1%的结晶紫溶液染色小室20 min,PBS冲洗多余染料。在倒置显微镜下随机计数3个细胞视野,计数下室面的细胞数即为穿膜细胞数,取平均数。实验重复3次。
1.2.5流式细胞术检测沉默效果最佳的LV-shLMTK3组和LV-Control组细胞的凋亡率的变化将沉默效果最佳的LV-shLMTK3组和LV-Control组处于对数生长期的细胞以6×106/2 mL/孔接种于6孔板中,5% CO2、37 ℃条件下常规培养。细胞生长融合至90%时,PBS洗涤细胞3次,用不含EDTA的胰酶消化,经1 000 r/min离心10 min,冷PBS洗涤细胞沉淀1次,1 000 r/min离心10 min,洗涤细胞,加入300 μL染色缓冲液重悬细胞,再加入5 μL Annexin V-FITC混匀,室温避光孵育20 min,加入5 μL PI,1 h内上机检测。每组3个复孔,取平均数。实验重复3次。
1.3统计学分析采用Image J和Graphpad prism 5.0软件进行分析,两组样本比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1BCPAP细胞被慢病毒载体感染后显微镜下观察其被感染的效果慢病毒颗粒感染BCPAP细胞48 h后,于倒置荧光显微镜下判断感染效果。发现5组细胞荧光感染率均达到80%以上(见图1)。

3个基因沉默序列的慢病毒感染效果类似,因此只呈现了一组作为代表。 图1 慢病毒质粒感染BCPAP细胞的荧光表达情况(SP×100)
2.2检测LMTK3在五组细胞中的表达Western blot实验结果发现,LV-shLMTK3组细胞LMTK3蛋白的表达水平明显低于LV-Control组细胞的蛋白表达水平(P<0.05),特别是LV-shLMTK3-3组差异更显著(P<0.01),而阴性对照组和空白对照组间无明显差异性(见表1,图2)。实验结果表明,基因沉默LMTK3的慢病毒细胞株构建成功,后续实验采用LV-shLMTK3-3作为实验组。
表1Western Blot方法检测三组细胞的OD值
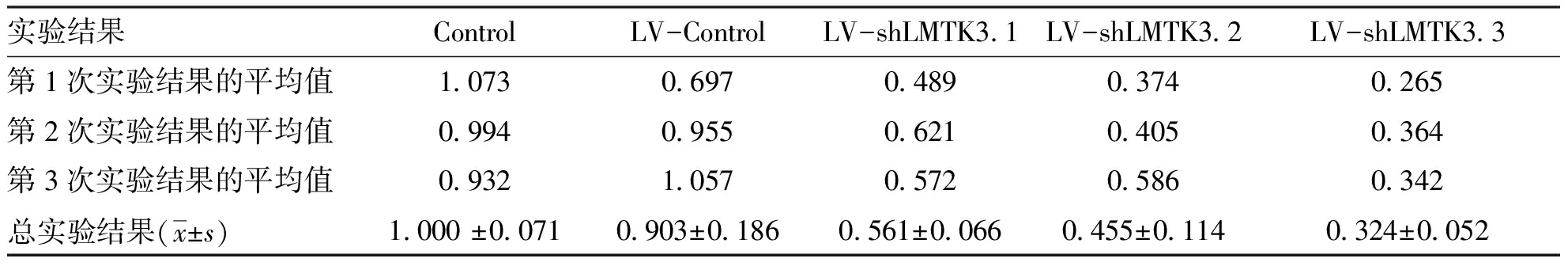
实验结果ControlLV-ControlLV-shLMTK3.1LV-shLMTK3.2LV-shLMTK3.3第1次实验结果的平均值1.0730.6970.4890.3740.265第2次实验结果的平均值0.9940.9550.6210.4050.364第3次实验结果的平均值0.9321.0570.5720.5860.342总实验结果(x±s) 1.000 ±0.0710.903±0.1860.561±0.0660.455±0.1140.324±0.052

与对照组比较,*P<0.05,**P<0.01。图2 Western blot检测LMTK3在BCPAP细胞中的表达
2.3基因沉默LMTK3表达对BCPAP细胞增殖能力的影响CCK8实验检测结果显示,细胞培养24 h时,LV-shLMTK3-3组和LV-Control组细胞间的增殖速度无明显差异(P>0.05);从48 h开始,LV-shLMTK3-3组细胞的增殖速度均明显低于LV-Control组细胞的增殖速度(分别为P<0.01,P<0.001,P<0.001和P<0.001,见表2,图3)。实验结果表明,基因沉默LMTK3能够显著抑制BCPAP细胞的增殖能力。


组别24 h48 h72 h96 h120 hLV-Control0.991±0.0121.246±0.0291.667±0.0831.834±0.0851.846±0.077LV-shLMTK3-30.978±0.0261.144±0.0221.211±0.1211.245±0.0541.378±0.034

与对照组比较,**P<0.01,***P<0.001。图3 基因沉默LMTK3对BCPAP细胞增殖能力的影响
2.4基因沉默LMTK3表达对BCPAP细胞迁移和侵袭能力的影响Transwell迁移和侵袭实验结果显示,细胞培养48 h时,LV-shLMTK3-3组细胞的迁移(见表3,图4)和侵袭(见表4,图5)能力分别明显低于LV-Control组细胞的迁移和侵袭能力,差异具有统计学意义(均为P<0.01)。实验结果表明,基因沉默LMTK3能够显著抑制BCPAP细胞的迁移和侵袭能力。
表3Transwell迁移实验检测两组细胞的迁移能力(n=3)

组别第1次实验结果的平均值第2次实验结果的平均值第3次实验结果的平均值总实验结果(x±s)LV-Control1.0491.0140.9371.00±0.06LV-shLMTK3-30.5070.4200.2970.41±0.11
所有数据均进行过归一化处理,即所有值分别除以Control的平均值。
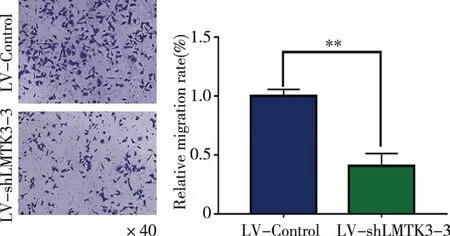
与对照组比较,**P<0.01。图4 基因沉默LMTK3对BCPAP细胞迁移的影响(SP×40)
2.5基因沉默LMTK3表达对BCPAP细胞凋亡率的影响通过流式细胞术检测培养48 h时的细胞,我们发现LV-shLMTK3-3组细胞的凋亡率均明显高于LV-Control组细胞的凋亡率(P<0.01)(见表5,图6)。实验结果表明,基因沉默LMTK3能够显著促进BCPAP细胞的凋亡率。
表4Transwell侵袭实验检测两组细胞的侵袭能力(n=3)

组别第1次实验结果的平均值第2次实验结果的平均值第3次实验结果的平均值总实验结果(x±s)LV-Control1.0680.8531.0801.00±0.13LV-shLMTK3-30.5860.4340.5540.52±0.08
所有数据均进行过归一化处理,即所有值分别除以Control的平均值。

与对照组比较,**P<0.01。图5 基因沉默LMTK3对BCPAP细胞侵袭的影响(SP×40)
表5流式细胞术检测两组细胞的凋亡率(%,n=3)
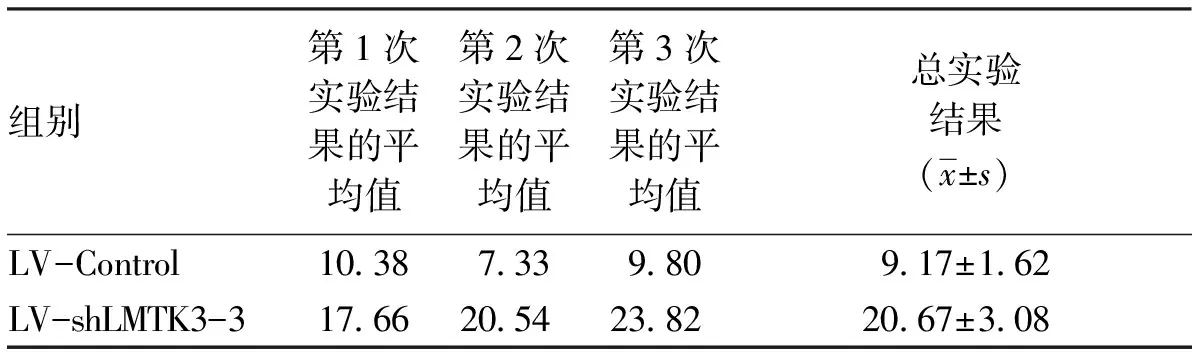
组别第1次实验结果的平均值第2次实验结果的平均值第3次实验结果的平均值总实验结果(x±s)LV-Control10.387.339.809.17±1.62LV-shLMTK3-317.6620.5423.8220.67±3.08
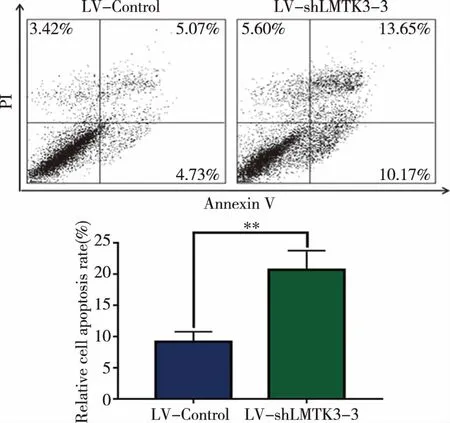
凋亡率=早期凋亡率+晚期凋亡率。与对照组比较,**P<0.01。图6 基因沉默LMTK3对BCPAP细胞凋亡的影响
3 讨论
据美国癌症协会统计,2017年美国甲状腺癌(TC)新发病例5 399万例,死亡病例206万例,其中女性TC患者的发生率约为男性患者的3倍,死亡率无明显性别差异[1]。甲状腺乳头状癌(PTC)的发生率也存在上述性别差异[4],颈部淋巴结转移率高达50%以上[2],局部复发率高达34.6%[3]。因此,控制TC患者的复发及转移可有效降低死亡率。多项研究提示,与甲状腺癌细胞增殖及转移相关的生物标志物已成为目前TC研究的热点。
丝氨酸/苏氨酸/酪氨酸激酶家族的成员包括LMTK1、LMTK2和LMTK3,人类LMTK3基因位于19q13.33,是一类在人体内广泛表达的单次跨膜蛋白,在大脑皮质、小脑、乳腺、肺、胃及结直肠中的表达量较高[5]。研究表明,LMTK3在甲状腺癌[6]、乳腺癌[7]、肺癌[8]、胃癌[9]、结直肠癌[10]和慢性中性粒细胞白血病[11]等多种人类恶性肿瘤组织或血清中均高表达,而在前列腺癌[12]组织中低表达,目前LMTK3对乳腺癌细胞生物学行为影响的研究最多。Mackiewicz等[13]研究发现,miR-34a可通过下调ER的活性和AKT信号通路抑制乳腺癌细胞的增殖和周期进程,而LMTK3是miR-34a的靶点[14];Giamas等[15]证明,沉默LMTK3可显著抑制ERα阳性乳腺癌细胞的增殖和裸鼠种植瘤的生长,LMTK3能直接或通过PKC-AKT-FOXO3信号通路间接磷酸化ERα,在mRNA和蛋白两个层面保护ERα的含量和活性,导致对他莫昔芬的耐药[14];Stebbing等[16]验证LMTK3通过c-MYC、HSPB8和SIAH2等多种机制参与了乳腺癌患者对他莫昔芬的原发性耐药和获得性耐药。LMTK3除了通过ERα信号通路发挥生物学功能,还可依靠非ER信号通路影响肿瘤的恶性生物学行为,如:LMTK3与生长因子受体结合蛋白2(growth factor receptor-bound protein 2,GRB2)相互作用能促进乳腺癌细胞的侵袭、迁移和抑制凋亡,而阻断GRB2能产生相反的作用[17-19];LMTK3可通过与KAP1结合增强PP1α的活性来抑制乳腺癌细胞中部分肿瘤抑制样基因的表达[20]。此外,朱文等[21]发现下调LMTK3可显著抑制A549细胞的增殖、迁移和周期进展;Sun等[12]报道LMTK3在体内外均能抑制前列腺癌细胞的生长、迁移和侵袭,诱导其凋亡,并能抑制AKT和ERK的磷酸化,促进p38激酶和JNK激酶的磷酸化和激活。在非小细胞肺癌[8]、胃癌[9]和结直肠癌[10]中,LMTK3作为一种致癌因子,与临床病理资料还存在显著的相关性。由此推断,LMTK3能够在多种恶性肿瘤中发挥重要调节作用。
Lu等[6]发现LMTK3在TC血清中的表达水平与临床分期和病理类型有关,基因水平敲减LMTK3可显著抑制人甲状腺鳞癌SW579细胞的增殖、侵袭和迁移,同时可促进其凋亡。本课题组前期研究[22]发现LMTK3在PTC患者甲状腺组织中的表达水平与其临床分期和ERα的含量正相关。为此,本研究通过构建针对LMTK3的重组慢病毒载体(LV-shLMTK3),分组感染BCPAP细胞株,观察基因沉默LMTK3对细胞增殖、迁移、侵袭及凋亡能力的影响。我们发现慢病毒颗粒能够高效感染BCPAP细胞株,被LV-shLMTK3慢病毒感染的BCPAP细胞株中LMTK3蛋白的表达量很低(P<0.01)。进一步的研究显示,基因沉默LMTK3能显著抑制BCPAP细胞的增殖(P<0.001)、迁移(P<0.01)和侵袭(P<0.01)能力,且能明显促进其凋亡(P<0.01)。上述结果提示LMTK3可能作为甲状腺乳头状癌的一个新的致癌基因,为甲状腺乳头状癌的靶向基因治疗提供了新视角。结合文献报道,PI3K/AKT、GSK3-β和mTOR等信号分子对于调节细胞生长、增殖和分化具有重要作用,Bcl-2蛋白家族和Caspase-3信号分子在细胞凋亡过程中发挥了关键作用[23],上皮来源肿瘤细胞侵袭转移能力的变化也常伴有上皮间质转化(Epithelial-mesenchymal transition,EMT)进程的改变[24]。至于LMTK3是否通过上述分子调节BCPAP细胞的增殖和凋亡,是否通过调节EMT进程来促进BCPAP细胞的侵袭转移能力,以及LMTK3在肿瘤细胞与其微环境中所扮演的角色尚未知,仍亟待深入探究。因此,本课题组将在后续实验中采用qRT-PCR和Western Blot技术检测相关因子的表达及通过相关体内实验进一步探讨LMTK3在甲状腺乳头状癌细胞中的具体作用机制。由此认为,LMTK3参与甲状腺乳头状癌细胞生物学行为的具体分子机制有望成为一个新的研究思路。
综上所述,LMTK3可在人类多种恶性肿瘤的发生发展中扮演重要角色,可能是促进PTC发生发展的重要分子。本研究初步证实了基因沉默LMTK3能够抑制人BCPAP细胞的增殖、迁移及侵袭能力,促进其凋亡,可为进一步研究LMTK3对PTC恶性生物学行为影响的分子调控机制提供基础理论依据。
