MEG3对鼻咽癌细胞转移能力的影响及相关机制的初步探究
2018-07-16邹森
邹 森
(攀枝花学院附属医院 耳鼻咽喉科,四川 攀枝花 617000)
鼻咽癌(nasopharyngeal carcinoma,NPC)好发于我国南方,是我国高发的恶性肿瘤之一,据报道2015年我国NPC发病6.06万例,死亡3.41万例,均居耳鼻咽喉恶性肿瘤之首[1],严重影响人们的生命健康安全。多数NPC患者早期无明显特异性症状,易导致病情延误,且NPC细胞颈部淋巴结转移发生较早[2],不利于患者预后,因此,明确NPC细胞侵袭转移的具体机制对NPC的诊治具有重要意义。长链非编码RNA(long non-coding RNA,LncRNA)是长度超过200nt的RNA分子,其不编码相应蛋白,但可通过表观遗传、转录及转录后修饰实现对基因表达的调控[3],母系表达基因3(maternally expressed gene3,MEG3)是LncRNA的成员之一,其被发现可影响多种恶性肿瘤的不同恶性行为[4-5],但对NPC细胞的影响尚不清楚,本研究通过慢病毒转染及Transwell实验等体外实验技术,揭示MEG3对NPC细胞侵袭迁移能力的影响,并对可能的相关机制进行初步探究。
1 材料与方法
1.1实验材料实验细胞:包括人鼻咽癌细胞CNE1及人胚肾细胞293T,来自美国模式培养物集存库(American type culture collection,ATCC)。
实验仪器:超净工作台(美国Thermo Scientific ECO1.5),光学显微镜(德国Leica DM1000),高速低温离心机(德国Eppendorf 5424R),超微量分光光度计(美国NanoDrop2000),荧光定量PCR仪(美国ABI 7500),多孔酶标仪、凝胶成像仪(美国Bio-Rad),电泳槽、电泳仪及转印夹等(上海Tanon)。
实验试剂: RPMI-1640、DMEM培养基、胎牛血清、小牛血清(美国Gibco),胰蛋白酶、嘌呤霉素(美国Sigma),质粒抽提试剂盒(美国Promega),转染脂质体(Lipofectamine 2000,美国Thermo Scientific),RNAiso Plus、逆转录试剂盒(日本Takara),SYBR Green荧光定量染料(美国Thermo Scientific),引物合成(上海生工),MEG3过表达载体及空白载体(山东维真生物),慢病毒包装载体pSPAX2及pMD2.G(美国Addgene),24孔板、Transwell小室及Matrigel胶(美国BD),IP蛋白裂解液(上海碧云天),蛋白酶抑制剂(美国Sigma),BCA蛋白浓度测定试剂盒(上海翊圣生物),蛋白marker(上海生工);抗体(美国Abcam):一抗包括抗E-cadherin(ab40772)、抗Vimentin(ab92547)、抗β-catenin(ab32572)及抗β-Actin(ab8226);二抗包括鼠二抗(ab6728)、兔二抗(ab6717);ECL发光液(美国Millipore),NaCl等无机试剂(美国Sigma),甲醇、异丙醇及无水乙醇等(国药化学试剂公司)。
1.2细胞培养293T细胞以DMEM+10%胎牛血清培养,CNE1细胞以RPMI-1640+10%胎牛血清培养,培养于37℃,5%CO2,相对湿度100%的生化培养箱中,于超净工作台中严格无菌操作。
1.3慢病毒转染载体上调CNE1中MEG3的表达将MEG3、空白载体及pSPAX2、pMD2.G载体在感受体细胞中扩增并进行质粒抽提以备后续使用。接种生长状态良好的293T细胞于6孔板中,浓度1×105个细胞/孔,12h后细胞贴壁进行慢病毒包装,将1 μg MEG3及空白载体分别加入1.5 mL规格的Eppendorf管中,每管再加入1.2 mL DMEM无血清培养基、1 μg pSPAX2、0.5 μg pMD2.G载体及7.5μL转染脂质体,并充分混匀。静置30 min后均匀加入293T细胞中进行培养。6 h后弃上清,更换DMEM+10%胎牛血清培养基培养,48 h后收集上清液,并进行过滤,得到慢病毒包装好的含MEG3载体及空白载体的两组病毒悬液。将两组病毒悬液分别与RPMI-1640+10%胎牛血清1∶1混合均匀后,培养CNE1细胞,连续培养3 d后1 μg/mL嘌呤霉素进行筛选,至细胞生长状态良好完成两组细胞系的构建,转染MEG3载体的作为实验组细胞,转染空白载体的作为对照组细胞。
1.4荧光定量PCR技术检测两组细胞MEG3的表达收集1×105个以上的实验组及对照组细胞,消化离心于1.5 mL Eppendorf管中,PBS洗细胞3次,去上清,1 mL RNAiso Plus重悬细胞,Trizol法进行细胞总RNA的抽提。检测两组细胞总RNA浓度,取2 μg进行逆转录,得到两组细胞cDNA模板,稀释至1mL。稀释合成引物,包括MEG3引物L:5’-TGAAGAGGACCGGAACTGAC-3’,R:5’-TCCAGTTTGCTAGCAGGTGA-3’,产物大小:172 bp;内参基因β-actin L:5’- CTCCATCCTGGCCTCGCTGT -3’,R:5’- GCTGTCACCTTCACCGTTCC -3’,产物大小268bp,取上游及下游引物各10 μL并稀释至1 mL。将10 μL SYBR Green荧光定量染料、5 μL cDNA模板及5 μL引物加至RT-qPCR反应8连管中,设置3个复孔,反应条件: 50℃ 2 min,95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 30 s,60 ℃ 15 s,40个循环,MEG3的相对表达量采用2(-△△CT)法计算。
1.5Transwell侵袭实验检测两组细胞侵袭能力培养对数生长期的实验组及对照组细胞于10 cm培养皿中,RPMI-1640+3%小牛血清处理过夜。将Transwell小室架于Transwell 24孔板中,50 mg/L Matrigel胶与无血清RPMI-1640培养基1∶7混合均匀,取100 μL加至小室中央,置于37℃生化培养箱中孵育,6 h后取出并弃去残余液体。将实验组及对照组细胞消化离心后,PBS洗3次,RPMI-1640+1%小牛血清重悬细胞并进行细胞计数,取2×105个细胞/孔接种至Transwell小室,下小室加入800 μL RPMI-1640+10%胎牛血清培养基,于生化培养箱中培养。48 h后PBS洗细胞3次,无水乙醇固定细胞10 min,0.1%结晶紫染色30 min,自来水洗净结晶紫,200×光镜下计数,随机统计从中间和四周5个视野的细胞数,求其平均值及标准差。
1.6Transwell迁移实验检测两组细胞迁移能力培养对数生长期的实验组及对照组细胞于10 cm培养皿中,RPMI-1640+3%小牛血清处理过夜。将Transwell小室架于Transwell 24孔板中,实验组及对照组细胞消化离心后,PBS洗3次,RPMI-1640+1%小牛血清重悬细胞并进行细胞计数,取5×104个细胞/孔接种至Transwell小室,下小室加入800 μL RPMI-1640+10%胎牛血清培养基,于生化培养箱中培养。48 h后PBS洗细胞3次,染色及计数方法同Transwell侵袭实验。
1.7Western Blot检测两组细胞EMT相关分子的表达培养对数生长期的实验组及对照组细胞于10 cm培养皿中,消化离心后,PBS洗3次,300 μL IP裂解液+30 μL蛋白酶抑制剂重悬细胞,0 ℃裂解2 h,16 000 rpm 4 ℃离心15 min取上清,检测上清液的蛋白浓度,并稀释至浓度为2.5 μg/μL,加入蛋白loading后100 ℃水浴5 min,同蛋白marker进行聚丙烯酰胺凝胶电泳,稳压120 V,时间2 h;转至PVDF膜,稳流300 mA,时间2 h;10%脱脂牛奶封闭2 h;一抗4 ℃孵育相应条带:E-cadherin 135 kDa、Vimentin 57 kDa、β-catenin 93 kDa、β-actin 42 kDa,孵育浓度1∶1 000,12 h后PBS洗膜3次,二抗孵育1 h,孵育浓度1∶2 000,PBS洗膜3次后ECL发光显影,ImageLab系统分析条带灰度值。

2 结果
2.1两组细胞MEG3的表达情况实验组细胞MEG3相对β-actin的表达水平为0.147±0.021,显著高于对照组细胞相对表达水平0.053±0.010,差异具有统计学意义(t=6.99,P<0.01)。
2.2两组细胞侵袭能力的比较实验组细胞侵袭细胞数为43.9±8.6个/视野相比对照组细胞侵袭细胞数62.5±11.7个/视野显著降低,差异具有统计学意义(t=2.28,P<0.05,见图1)。
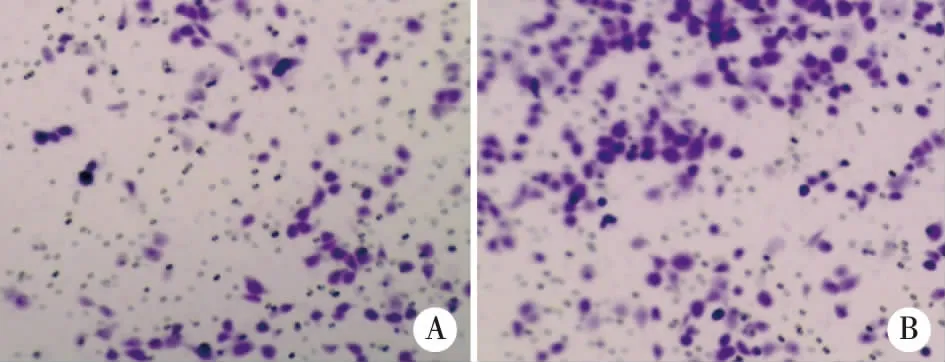
A:实验组;B:对照组。图1 两组细胞侵袭能力的比较(×200)
2.3两组细胞迁移能力的比较实验组细胞迁移细胞数为69.5±10.4个/视野相比对照组细胞迁移细胞数112.6±14.9个/视野显著降低,差异具有统计学意义(t=4.10,P<0.01,见图2)。
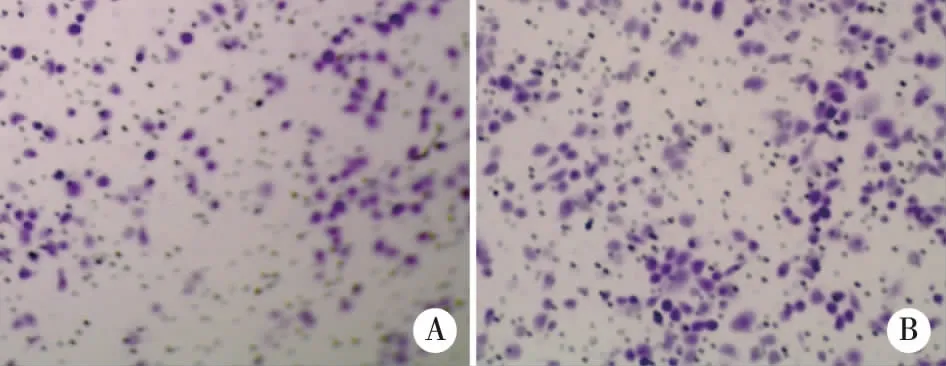
A:实验组;B:对照组。图2 两组细胞迁移能力的比较(×200)
2.4两组细胞EMT相关分子表达情况实验组细胞E-cadherin相对灰度值为0.833±0.107相比对照组细胞相对灰度值0.572±0.084显著增高,差异具有统计学意义(t=3.32,P<0.05);实验组细胞Vimentin相对灰度值为0.163±0.031相比对照组细胞相对灰度值0.423±0.077显著降低,差异具有统计学意义(t=4.46,P<0.01);实验组细胞β-catenin相对灰度值为0.271±0.048相比对照组细胞相对灰度值0.640±0.089显著降低,差异具有统计学意义(t=5.16,P<0.01),见图3。
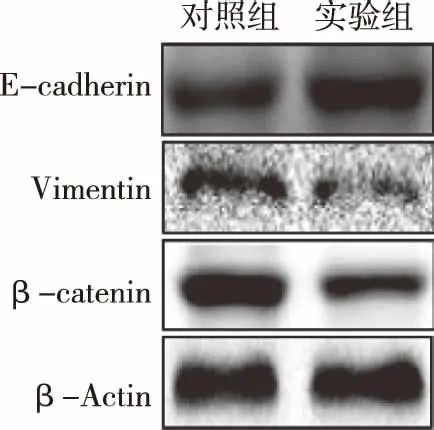
图3 两组细胞EMT相关分子表达情况
3 讨论
MEG3是众多LncRNA中的一员,其基因位于人类染色体14q32.3上,在哺乳动物的脑组织及垂体中表达较高。近年有研究显示,MEG3在多种恶性肿瘤中表达缺失,包括胃癌、乳腺癌、非小细胞肺癌、肝细胞肝癌、脑胶质瘤等,且其可通过多种途径抑制恶性肿瘤的发生发展过程[6]。侵袭转移是恶性细胞的主要特征之一,也是引起恶性肿瘤相关死亡的主要因素,其过程涉及多种途径,目前机制尚未完全阐明。EMT是恶性肿瘤侵袭转移机制研究较为深入的途径之一,上皮恶性肿瘤细胞通过EMT途径获得间质细胞的表型,包括细胞间连接减弱,细胞活动性增强[7],因此EMT相关分子标志物可作为衡量细胞侵袭转移能力的依据。MEG3也被发现参与抑制多种恶性肿瘤的侵袭转移:Wang等[8]的研究显示MEG3可通过下调Rac1的表达进而抑制甲状腺癌细胞的侵袭能力,而Rac1也被发现参与EMT进程[9-10],提示MEG3对EMT可能存在间接的调控作用;Peng等[11]在胃癌组织中发现MEG3表达的下调,且与胃癌转移负相关,体外实验发现MEG3可抑制胃癌细胞侵袭迁移能力;Sun等[12]的研究表明MEG3在乳腺癌组织中低表达,上调乳腺癌细胞MCF7及MB231中MEG3的表达后,细胞增殖及侵袭转移能力均明显下调,Zhang等[13]在体外也发现MEG3对乳腺癌细胞系侵袭转移能力的抑制作用,同时通过裸鼠移植瘤模型发现MEG3在体内可抑制乳腺癌细胞的生长、浸润与肿瘤血管生成;Wang等[14]发现MEG3可通过抑制ZEB-1及Wnt信号通路,进而抑制骨肉瘤细胞侵袭迁移能力;Lu等[15]在非小细胞肺癌组织中检测到MEG3的低表达,且低MEG3表达与肿瘤大小、TNM分期及患者预后不良密切相关;另外在口腔鳞癌及脑胶质瘤中均有MEG3抑制恶性肿瘤细胞侵袭转移能力的报道[16-17]。但目前MEG3对于NPC细胞侵袭转移能力的影响及相关机制尚不明确。
本研究在体外通过构建MEG3过表达NPC细胞系,并检测细胞侵袭迁移能力及EMT相关分子表达的变化,明确了MEG3对NPC细胞侵袭迁移能力及EMT进程的影响,结果显示过表达MEG3的CNE1细胞侵袭迁移能力显著下调,进而我们检测了EMT相关分子表达的变化,包括E-cadherin、Vimentin及β-catenin,其中E-cadherin是介导细胞间相互聚集黏附的重要分子,并在维持细胞极性中发挥重要作用,其表达的下调意味着细胞活动性增加、侵袭转移能力增强,是EMT最主要的标志性变化[18];Vimentin是成纤维细胞中等纤维的主要成分,主要功能是维持细胞骨架完整性,肿瘤细胞中其表达上调往往意味着细胞活动性增强,EMT程度加深[19];β-catenin则是Wnt信号通路中的重要成员,其表达增加可促进核内EMT相关转录因子的表达,进而促进细胞EMT进程[20]。我们的研究显示CNE1细胞中过表达MEG3后E-cadherin表达显著上调,而Vimentin及β-catenin的表达显著下调,提示MEG3可抑制CNE1细胞的EMT进程。综上所述,我们的研究发现MEG3可减弱NPC细胞CNE1的侵袭转移能力,其机制与抑制细胞EMT进程有关。
