尼洛替尼和伊马替尼对慢性粒细胞白血病表达谱的影响*
2018-07-14荆凌华刘松年马利敏杨海平
荆凌华,刘松年,马利敏,杨海平
(河南科技大学第一附属医院 血液科,河南 洛阳 471023)
慢性粒细胞白血病(chronic myelocytic leukemia,CML)是一种起源于造血干细胞的恶性增殖性疾病,以t(9∶22)(q34∶q11)染色体易位形成的BCRABL融合基因为主要特征,该基因编码的BCR-ABL融合蛋白可以持续性活化酪氨酸激酶活性。酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)伊马替尼作为首个上市的分子靶向药物,能够抑制BCR-ABL蛋白激酶,在CML的靶向治疗方面取得很好的效果。然而随着临床的广泛应用,部分患者出现耐药性。伊马替尼耐药性是由多种机制引起的,其中BCR-ABL激酶的点突变是最常见的耐药机制[1-2]。第2代TKIs尼洛替尼和达沙替尼等能够克服大部分突变体产生的耐药性,但对T315I突变型BCR-ABL激酶引起的耐药无效,已有多项研究表明,尼洛替尼能够安全有效地治疗伊马替尼耐药或不耐受的CML患者,表现出很好的应用前景[3-5]。本研究从基因表达数据库(Gene Expression Omnibus, GEO)中下载尼洛替尼和伊马替尼处理后CML细胞的基因表达谱数据,筛选出因TKIs处理而改变的差异基因并进行生物信息学挖掘,阐明TKIs对CML基因表达和功能的影响以及分子机制,为白血病的靶向治疗提供基础。
1 材料与方法
1.1 材料
从在线GEO数据库中下载GSE19567数据集,该数据集由Bruennert D和Neumann F提交,包含12个样品的表达谱芯片数据(GSM487683-GSM487694)。实验设计方案为CML细胞系K562以0.05 μmol尼洛替尼或0.50 μmol伊马替尼处理24 h,对照组以DMSO处理,分别提取处理后K562细胞的总RNA,采用GPL571检测平台,即Affymetrix Human Genome U133A 2.0 Array进行芯片检测,各有4个生物学重复。
1.2 方法
1.2.1 差异表达基因筛选 将下载的GSE19567数据集CEL文件输入BRB-ArrayTools软件,进行基因芯片信号值的预处理、标准化和过滤,然后采用SAM方法统计各个样品中每个基因的显著水平P值和误判率Q值,筛选差异表达基因(differentially expressed genes,DEGs)的标准为P<0.05,Q<0.05,差异倍数≥2倍。同时计算基因与样本间的相关性,按照先基因、后样本的顺序将DEGs表达数据进行层次聚类分析,连接方法为Average Link。
1.2.2 GO功能富集分析 基因本体(gene ontology,GO)是标准化的基因功能分类体系,包括细胞组分、分子功能和生物过程3个类别。本研究把筛选的DEGs向GO数据库(http://www.geneontology.org/)映射,计算每个GO条目映射到的差异基因数目,采用Fisher检验统计GO富集的概率值,并用Benjamini-Hochberg法进行调整以控制错误发现率(false discovery rate, FDR),显著富集GO条目的标准为P<0.05,FDR<0.05。
1.2.3 KEGG通路富集分析 KEGG数据库有助于把基因及其表达情况以整体网络形式进行全面研究,能够从大规模分子水平信息注解生物系统的高级功能。本研究基于KEGG数据库,采用Fisher精确检验统计DEGs在Pathway中的富集程度,P<0.05和FDR<0.05的pathway定义为显著富集的pathway。
1.2.4 互作网络分析 基于KEGG数据库中基因表达产物之间的相互作用,在Pathway数据库内搜索DEGs的正向和反向基因,再依据差异基因与其正反向作用关系描绘基因间的连接线,圆圈表示基因,线段表示相互作用,从而构建基因互作网络。以Pathway为单位,利用图论的方法将显著富集的Pathway根据KEGG数据库中的相互关系构建pathway互作网络,进而分析显著性Pathway之间的传导关系[6]。
2 结果
2.1 差异基因筛选结果
下载GEO数据库中的GSE19567数据集,以DMSO处理的K562细胞为对照组,尼洛替尼或伊马替尼处理的K562细胞为实验组,根据筛选标准,从尼洛替尼处理的CML细胞表达谱芯片数据中筛选出1 517个DEGs,包括上调基因328个,下调基因1 189个,层次聚类图见图1;从伊马替尼处理的CML细胞表达谱数据中筛选出692个DEGs,包括上调基因250个,下调基因442个,层次聚类图见图2。取交集后共得到519个DGEs,包括上调基因177个,下调基因342个,部分差异基因见表1。
2.2 GO功能富集分析
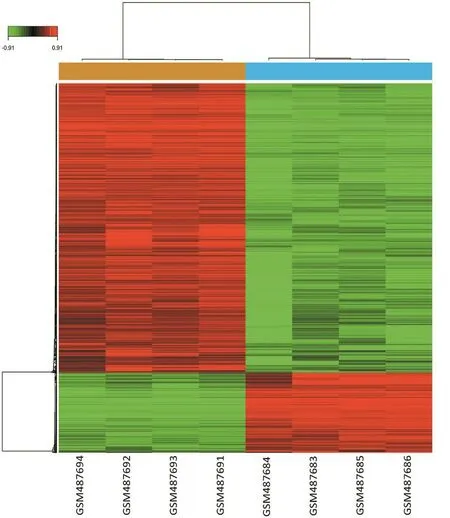
图1 尼洛替尼影响的差异基因聚类分析
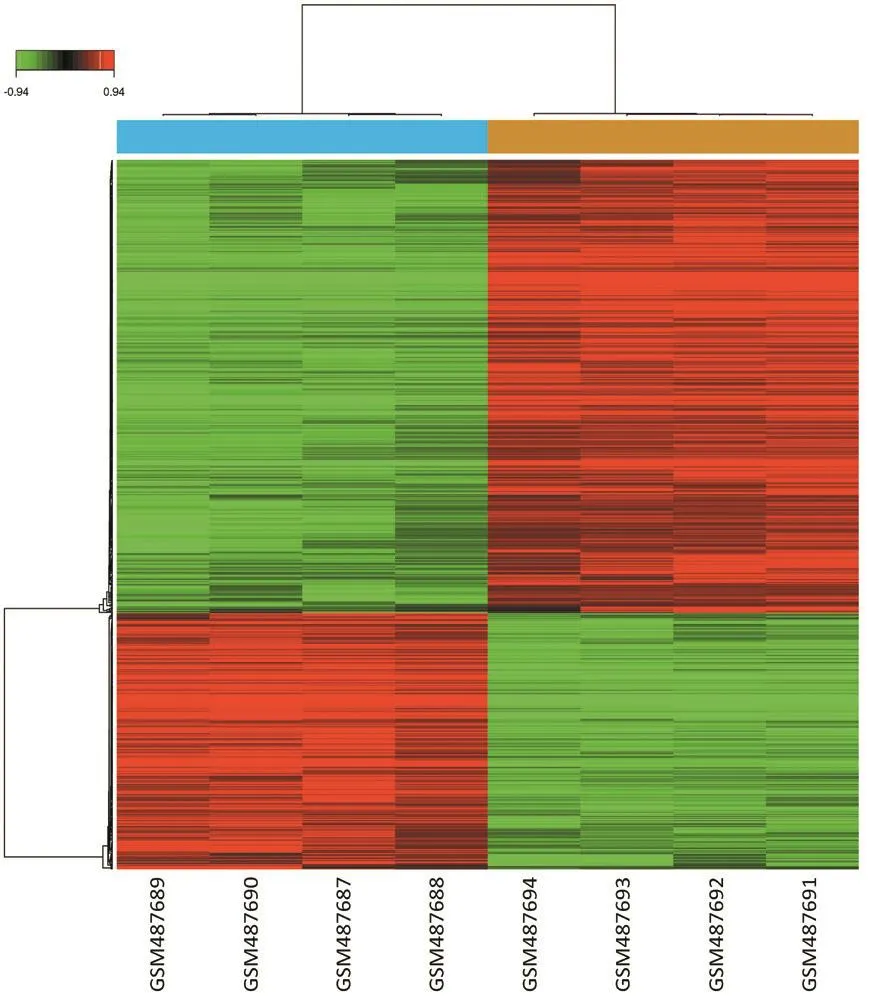
图2 伊马替尼影响的差异基因聚类分析
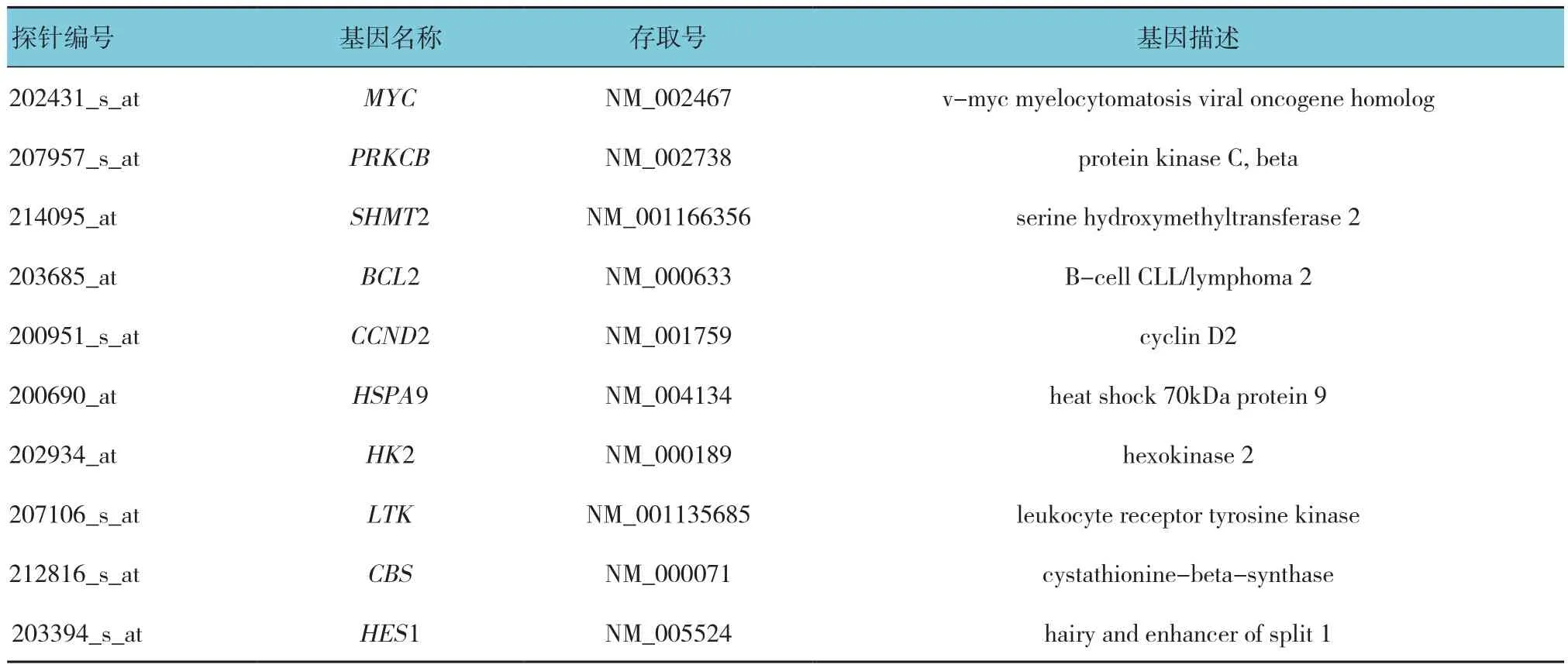
表1 部分差异表达基因列表
将筛选出的DEGs进行GO功能注释后发现,显著富集的生物过程类别共264个GO条目,主要涉及小分子代谢、血液凝固、转录调控、细胞增殖与凋亡调控等;显著富集的分子功能类别共80个GO条目,主要集中在蛋白结合、蛋白二聚化活性、序列特异性DNA结合和ATP结合等。GO富集分析中生物过程类别和分子功能类别富集水平最显著的前10个GO条目见表2、3。
2.3 KEGG通路富集分析
以KEGG数据库中的Pathway为单位,将筛选出的DEGs向整个背景基因组映射,结果发现代谢通路、氨基酸合成、PI3K-Akt通路和Jak-STAT通路等60个Pathway显著富集,其中富集水平最显著的前10个Pathway见表4。
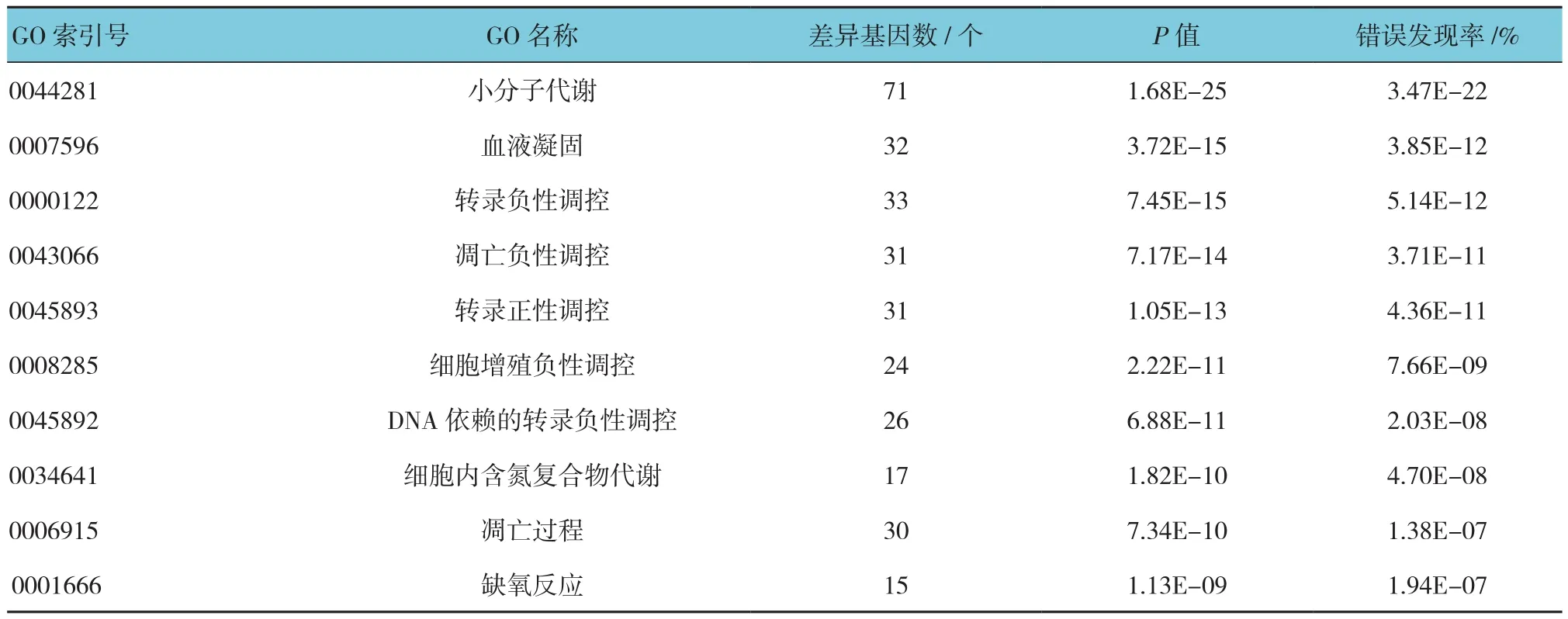
表2 差异基因GO富集分析(生物过程类别)
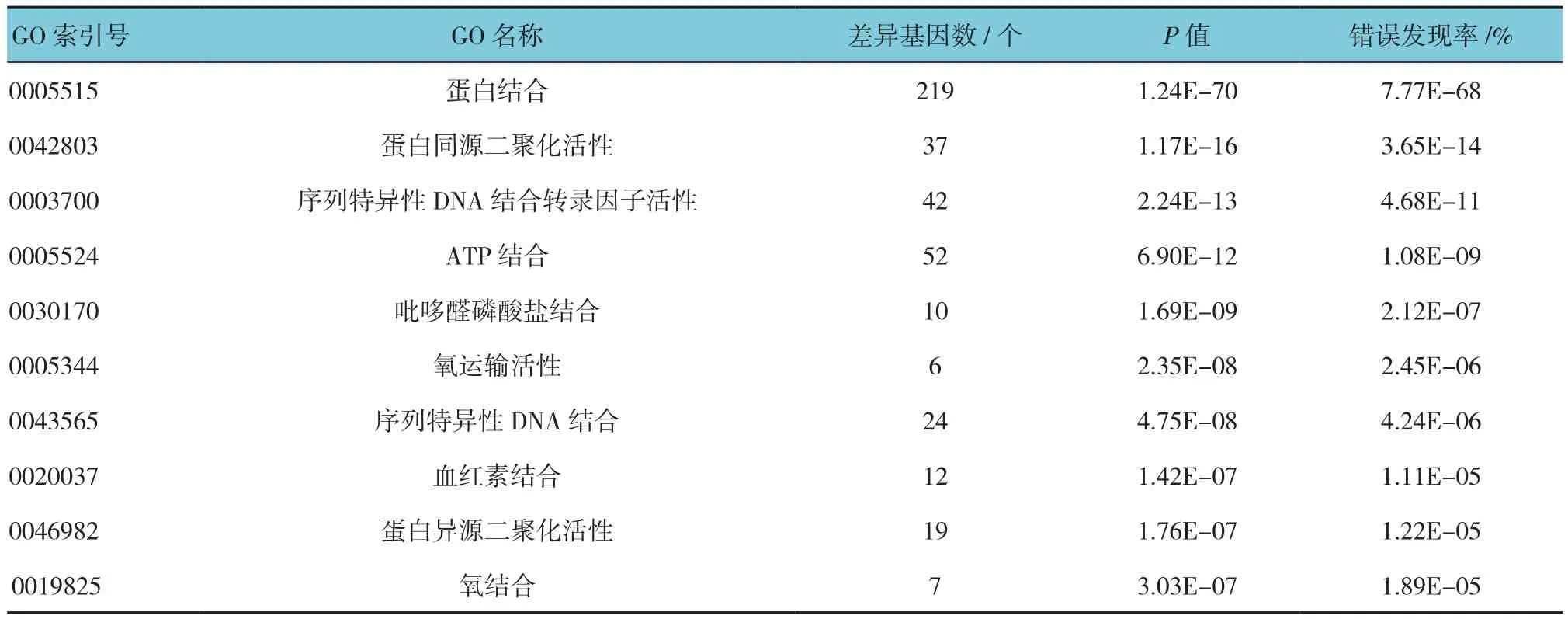
表3 差异基因GO富集分析(分子功能类别)
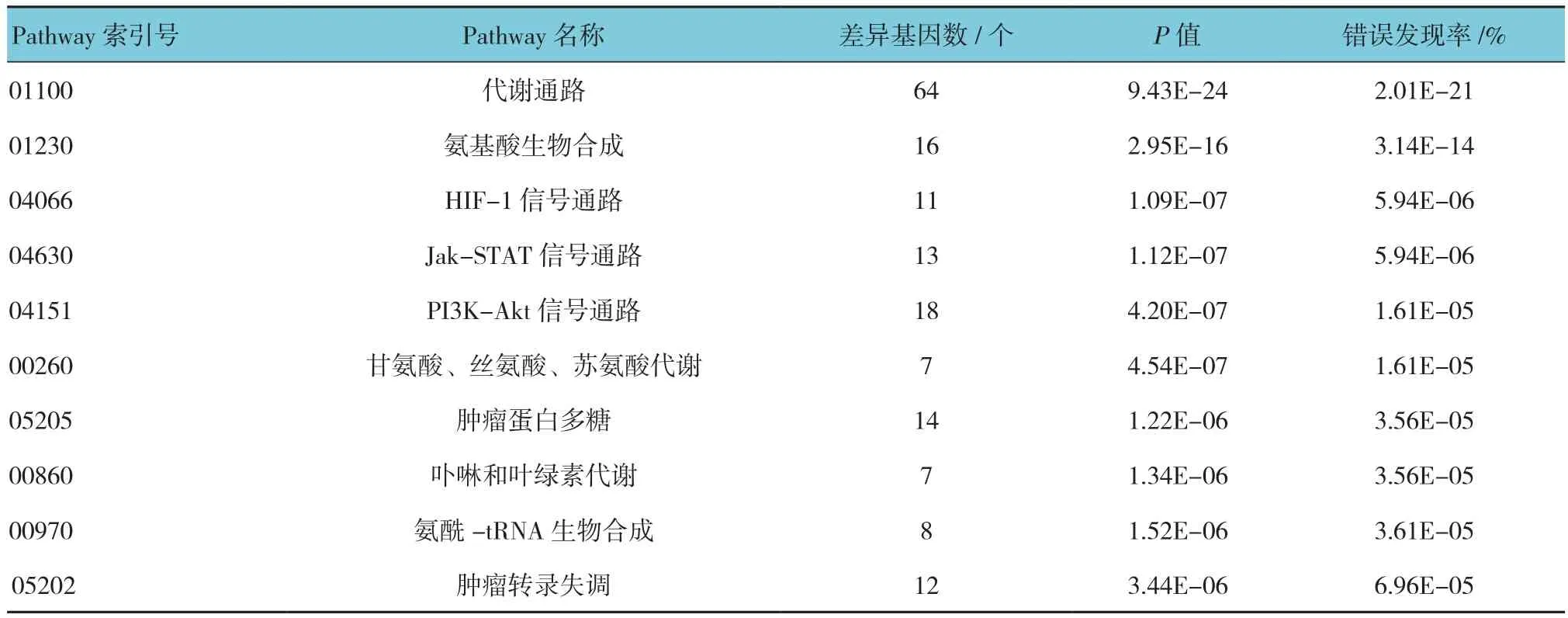
表4 差异基因pathway富集分析
2.4 互作网络分析
根据KEGG数据库中蛋白质之间的作用关系而构建的基因互作网络图见图3,圆点为差异基因,连线表示2个差异基因间的作用关系。圆点的大小代表betweenness值,圆点越大,表明该差异基因在互作网络中越重要,网络中的核心基因包括SHMT2(betweenness=142)、CBS(betweenness=108)、CTH(betweenness=108)、HK2(betweenness=64)。 基 于KEGG数据库中信号通路的正反向关系,构建pathway之间的互作关系网络图(见图4),圆点表示通路,带箭头的实线表示两个通路之间的上下游关系。圆点大小代表degree值,圆点越大,表明与之有正反向关系的通路数目越多,在网络中的作用也越重要,核心pathway包括MAPK信号通路(degree=18)、细胞凋亡(degree=15)、细胞周期(degree=14)和肿瘤通路(degree=14),其中肿瘤通路是上游调控通路,MAPK信号通路、细胞凋亡和细胞周期主要作为反向效应通路。
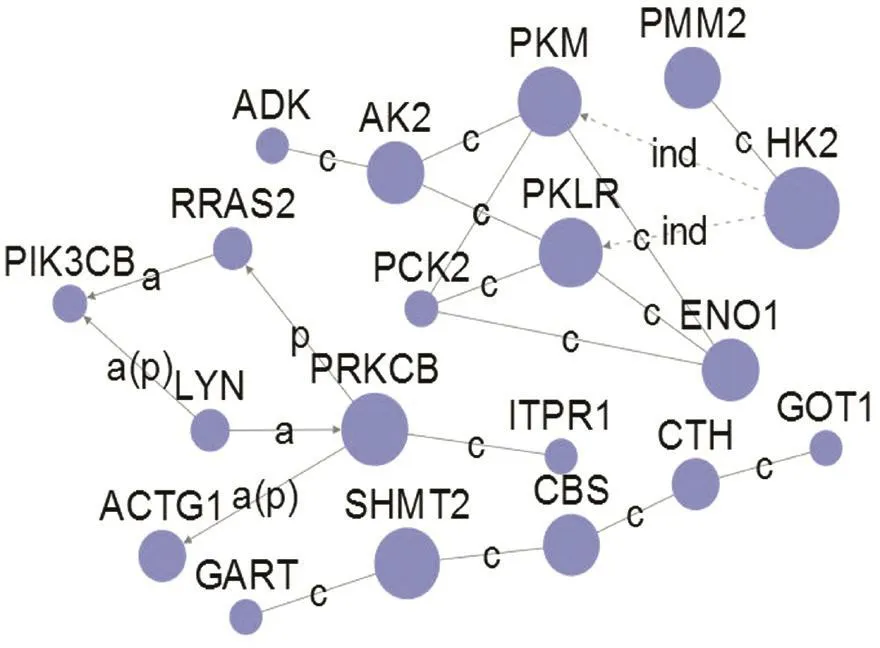
图3 差异基因相互作用网络分析
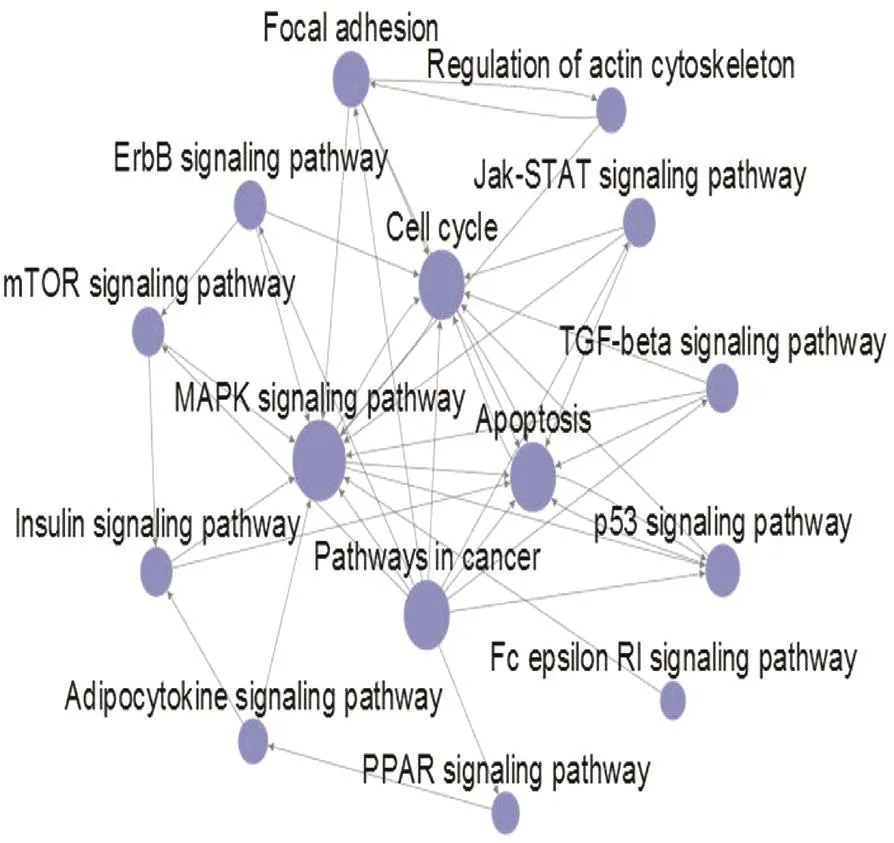
图4 Pathway相互作用网络分析
3 讨论
BCR-ABL激酶能够活化PI3K、Ras、Jak-STAT等信号通路,干扰正常的细胞周期和增殖分化,促进白血病的发生和发展。伊马替尼高度特异地占据BCRABL激酶非活化构象上的ATP结合位点,阻碍ATP的鸟嘌呤与BCR-ABL结合和ATP磷酸化,进而显著抑制ABL酪氨酸激酶的催化活性,特异地抑制BCR-ABL细胞的增殖。以甲基咪唑环置换伊马替尼的N-甲基哌嗪基团,并在苯环上连接三氟甲基,得到新型高亲和力ATP竞争性抑制剂尼洛替尼。尼洛替尼也是结合非活化构象的ABL激酶,使P-环折叠覆盖ATP结合位点,形成BCR-ABL激酶的无活性构象[7]。有研究表明,伊马替尼和尼洛替尼也能够有效抑制血小板衍化生长因子(platelet-derived growth factor, PDGF)和c-Kit受体的酪氨酸激酶[8-9]。BCR-ABL激酶抑制剂从单靶点发展至多靶点,不断提高其有效性和选择性,以克服各种突变型激酶引起的耐药。
为进一步探索尼洛替尼与伊马替尼在治疗CML时对基因表达和功能的影响,本研究从GEO数据库中下载GSE19567数据集,对TKIs处理后CML细胞的表达谱进行分析,共筛选出519个差异基因。GO功能和KEGG通路富集分析发现该差异基因主要涉及小分子代谢、血液凝固、转录调控、细胞增殖与凋亡调控等生物学过程,主要参与代谢通路、氨基酸合成、PI3K-Akt通路和Jak-STAT通路等Pathway。基因互作网络分析筛选的核心基因包括SHMT2、CBS、CTH、HK2,MAPK信号通路、细胞凋亡、细胞周期和肿瘤通路等核心Pathway在Pathway互作网络中发挥主要作用,该基因和通路可能是TKIs抑制白血病的潜在靶点。SHMT2基因编码丝氨酸羟甲基转移酶2,主要催化甘氨酸合成,也参与一碳代谢、细胞增殖调控等过程。CBS基因编码胱硫醚β合酶,涉及同型半胱氨酸、胱氨酸、丝氨酸等氨基酸代谢过程。有研究发现[10],CBS表达水平与巨核细胞白血病中成髓细胞对阿糖胞苷的敏感性密切相关。胱硫醚-γ-裂解酶CTH催化胱硫醚转变为半胱氨酸,涉及含硫氨基酸代谢、促进NF-κB转录因子活性、抑制凋亡信号通路等过程。HK2在葡萄糖稳态、缺血反应、凋亡线粒体改变、线粒体膜渗透性调控等过程发挥作用,在急性髓系白血病FLT3/ITD突变通过上调线粒体中HK2的表达引起有氧糖酵解增加,使得白血病细胞高度依赖于糖酵解;另外三氧化二砷能够抑制HK2,而HK2的过表达减少三氧化二砷所诱导细胞凋亡[11-13]。TKIs处理后CML细胞中SHMT2、CBS、CTH、HK2等基因表达下调,引起代谢通路和信号转导通路变化,活化MAPK、Jak-STAT信号通路,阻滞细胞周期,最终抑制白血病细胞的增殖和诱导其发生凋亡。
总之,TKIs影响CML细胞代谢通路和信号转导通路的相关基因,通过激活MAPK通路、细胞周期阻滞和诱导凋亡等分子机制抑制白血病,为白血病的分子靶向治疗提供基础,对设计和开发新型BCR-ABL激酶抑制剂也提供有价值的指导。
