索拉非尼对MHCC97-H肝癌细胞增殖、侵袭以及PRL-3蛋白表达的影响研究
2018-07-14马盼贾云宏
马盼,贾云宏
(1.锦州医科大学研究生学院,辽宁 锦州 121001;2.锦州医科大学药学院,辽宁 锦州 121001)
肝细胞癌进展的特点是细胞异常分化快,快速浸润性生长,转移早,恶性程度高,预后差。尽管肝移植、手术切除或肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)治疗可在一定程度上延缓病情的进展,然而治疗肝细胞癌的最大障碍仍然是侵袭和转移,近年来研究[1]证实,肝再生磷酸酶3(phosphatases of regenerating liver 3, PRL-3)是一种与肿瘤转移相关的磷酸酶,它的过度表达增加癌细胞的运动和侵袭。索拉非尼作为一种新型的分子靶向药物在临床实践中已显示出显著的疗效。索拉非尼能否下调肝癌细胞中PRL-3的表达,降低肝癌细胞的侵袭力鲜见相关文献报道,本研究旨在探讨索拉非尼对MHCC97-H肝癌细胞增殖抑制情况,对PRL-3蛋白表达水平的影响,以及对肝癌细胞侵袭力的作用。
1 材料与方法
1.1 材料
MHCC97-H肝癌细胞株购自上海细胞生物研究所,索拉非尼由德国拜耳公司生产,鼠抗人PRL-3多克隆抗体购自美国Bio Legend公司,胰蛋白酶、四甲基偶氮唑蓝(MTT)等均购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 细胞培养 37℃,5% CO2饱和湿度,DMEM培养液中生长,含有10%胚牛血清、青霉素100 u/ml及链霉素100 mg/L,消化传代使用0.25%胰蛋白酶和0.02% EDTA液。
1.2.2 实验分组 索拉非尼由100%二甲基亚砜(DMSO)溶解,实验组分别加入2、4、8和16 μmol/L的索拉非尼并且分别作用24、48和72 h以筛选最适合浓度和时间,对照组不加索拉非尼。
1.2.3 瑞氏-吉姆萨染色观察细胞形态 准备铺有盖玻片的6孔培养板以便于对数生长期细胞接种,同时设阴性对照,加入FTY720,经索拉非尼作用48 h,滴加无水乙醇风干后加瑞氏吉姆萨染液染色30 s,PBS浸泡2 min,洗去染液,固定、晾干、封片和镜检拍照。
1.2.4 MTT法检测细胞增殖抑制率 相同浓度MHCC97-H细胞悬液,实验组加2、4、8和16 μmol/L的索拉非尼。每组设6个复孔,培养24、48、72 h后每孔加入20 μl的MTT溶液,再培养4 h后终止,弃其上清后每孔加入DMSO溶液150 μl震荡溶解10 min。在490 nm波长处测定吸光度(A)值。细胞增殖抑制率=(1-实验组吸光度值/对照组吸光度值)×100%。
1.2.5 Western blot检测PRL-3蛋白表达的变化 收集经处理48 h的对照组,2、4、8、16 μmol/L的索拉非尼各组细胞,经裂解及离心后收集上清进行蛋白定量;上样缓冲液加入等量蛋白,煮沸、电泳及转膜后加入PRL-3和β-action一抗4℃过夜,HRP标记二抗孵育2 h,最后用ECL发光,X射线胶片进行曝光、显影、定影并应用AlphaEase FC软件分析图像。
1.2.6 Transwell侵袭实验 制备细胞悬液消化并且收集16 μmol/L的索拉非尼组细胞及对照组,调整细胞密度至5×104个/ml选取100 μl加入经Matrigel包被的Transwell小室。放入细胞培养箱中常规培养48 h后取出弃去培养液,用棉签擦去基质胶和上室内未穿膜的细胞,经固定漂洗后给予0.1%结晶紫染色,PBS洗3遍。400倍显微镜下随机观察及计数5个视野细胞。
1.3 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,比较采用重复测量设计的方差分析和单因素方差分析,在方差分析有意义的基础上,采用LSD-t进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 索拉非尼对MHCC97-H细胞的抑制作用
不同浓度的索拉非尼作用于MHCC97-H肝癌细胞24、48和72 h的细胞增殖抑制率比较,采用重复测量设计的方差分析,结果:①不同浓度索拉非尼的细胞增殖抑制率有差异(F=147.352,P=0.000);②不同作用时间下细胞增殖抑制率有差异(F=214.016,P=0.000);③不同浓度索拉非尼细胞增殖抑制率变化趋势有差异(F=157.263,P=0.000)(见表1和图1)。在本实验的几组浓度中筛选出索拉非尼进一步研究作用时间和浓度分别为48 h和16 μmol/L。
表1 索拉非尼对MHCC97-H细胞的抑制作用(%,±s)
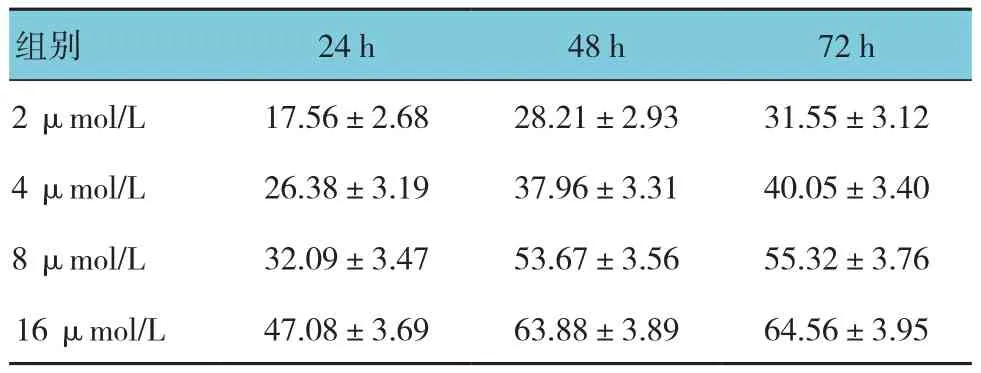
表1 索拉非尼对MHCC97-H细胞的抑制作用(%,±s)
组别24 h48 h72 h 2 μmol/L17.56±2.6828.21±2.9331.55±3.12 4 μmol/L26.38±3.1937.96±3.3140.05±3.40 8 μmol/L32.09±3.4753.67±3.5655.32±3.76 16 μmol/L47.08±3.6963.88±3.8964.56±3.95

图1 索拉非尼对MHCC97-H细胞的抑制作用
2.2 细胞形态
光镜下对照组细胞无核碎裂及溶解(见图2A),经16 μmol/L索拉非尼作用48 h后可观察大部分细胞发生凋亡,染色质固缩、胞核碎裂及凋亡小体等典型的凋亡形态(见图2B)。
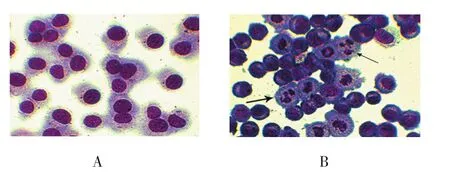
图2 MHCC97-H细胞形态图(瑞氏-吉姆萨染色×200)
2.3 PRL-3的蛋白表达
各组PRL-3表达的水平,差异有统计学意义(F=394.769,P=0.000)。对照组中可见PRL-3条带较粗,较强(见图3),与对照组比较,2、4、8、16 μmol/L组中PRL-3灰 度 均 降 低(t=2.550、5.903、8.957和11.884,P=0.034、0.000、0.000和0.000);与2 μmol/L组比较,4、8、16 μmol/L组中PRL-3灰度均降低(t=3.606、7.340和11.057,P=0.007、0.000和0.000);与4 μmol/L组比较,8、16 μmol/L组中PRL-3灰度均降低(t=5.367和11.500,均P=0.000);与8 μmol/L组比较,16 μmol/L组中PRL-3灰度降低(t=6.822,P=0.000)。浓度越高PRL-3蛋白表达量下降越明显。见图3和表2。
2.4 Transwell侵袭实验结果
细胞侵袭实验结果显示,经16 μmol/L索拉非尼作用48 h后,实验组与对照组在穿过Transwell膜的肝癌细胞数进行比较,采用t检验,差异有统计学意义(t=9.613,P=0.000),处理组穿膜细胞数低于对照组。见图4。

图3 不同浓度索拉非尼对PRL-3蛋白表达的影响

表2 经索拉非尼作用后的PRL-3蛋白表达
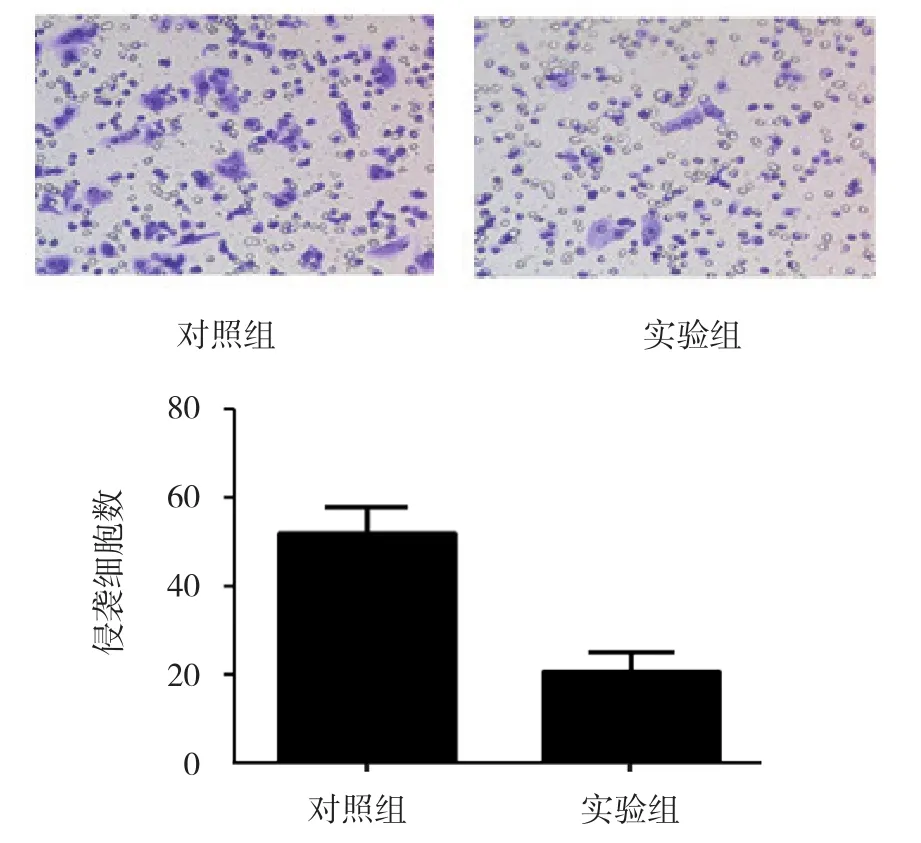
图4 索拉非尼抑制MHCC97-H肝癌细胞的体外侵袭能力
3 讨论
3.1 肝癌的研究现状
早期肝癌患者无明显的症状,缺乏适当的监测和筛选制度,大多数患者错过了最好的手术或肝移植机会。肝癌对放疗和化疗不敏感,其预后相对较差,主要是由于侵袭和转移引起的快速进展。细胞信号转导是一个复杂的多因素蛋白质网络,其中信息被有效地通过上游因子的激活传递,并转移到下游效应[2]。癌基因的异常表达是肿瘤形成、侵袭和转移的关键。如果涉及肿瘤侵袭和转移的基因被确定,分子生物学技术可纠正它们的表达水平,肝癌的侵袭和转移可以减少,从而延缓该疾病的进展。在分子靶向治疗的时代,确定预测的生物标志物是个性化医学成功实施的关键。随着对肝癌肿瘤异质性意义的进一步了解,肿瘤标志物的生物学特性可能是肝癌个性化靶向治疗成功发展的一条途径。随着生物信息学技术的发展和完善,从细胞分子层面阐述肿瘤的作用机制,为分子靶向治疗奠定了理论基础。
通过识别异种肿瘤相关分子的驱动程序,分子靶向为肿瘤细胞的治疗提供可观的效果。识别肿瘤血管生成的作用改变以往对肿瘤的局限认识,新的分子靶向治疗药物的出现使得癌症的治疗取得革命性的进步[3]。目前有各种特定的和有效的单目标/单基因药物,但他们的成本是相当昂贵的。此外,使用多个有针对性的靶向药物,将不可避免地增加患者的身体负荷和经济负担。因此,寻找高效能的多靶向药物已成为治疗癌症患者的首要目标[4]。随着医疗技术的进步,针对基因、受体和激酶的药物已在临床上应用,并在一定程度上为许多肿瘤的治疗提供巨大的前景。采用分子标记或者肿瘤生物标志物来理解这种高度侵袭性的作用机制,可以预测肿瘤的预后,为开发新的治疗方法提供重要的基础研究。近年来开发的药物靶向基因和激酶受体应用于临床,推进癌症的治疗到一个前所未有的新阶段[5]。
3.2 索拉非尼在治疗肝癌方面的应用
肝癌靶向治疗的关键是干扰肿瘤血管生成,目前所有新的药物用于治疗晚期肝细胞癌的疗效以索拉非尼最为显著[6]。索拉非尼能抑制PI3K/Akt、Ras/MAPK等通路,这将防止多药耐药途径,有更高的疗效和较低的不良反应[7-9]。一些研究还测试TACE联合索拉非尼在肝癌伴门静脉癌栓治疗的安全性和有效性[10],联合治疗肝癌可进一步提高疗效[11]。索拉非尼在Raf/丝裂原活化蛋白转导中起关键作用[12],调节ERK激酶信号通路,从而降低Cyclin D1的表达和细胞周期阻滞。索拉非尼还可通过抑制酪氨酸激酶受体[13]抑制肿瘤血管生成,导致肿瘤组织缺血坏死。此外,索拉非尼也能通过MAPK依赖的机制抑制其活性,增加肿瘤细胞凋亡的内在途径[14]。索拉非尼是多激酶的血管生成抑制剂,它已成为晚期肝细胞癌的标准治疗[15]。尽管索拉非尼可以抑制肿瘤细胞通过多种信号转导途径,但没有相关研究验证是否能有针对性地抑制PRL-3通路。
3.3 PRL-3与肿瘤转移的相关性
PRL-3是蛋白酪氨酸磷酸酶PRL亚组的一员,积极参与蛋白酪氨酸激酶信号通路的许多基本生理过程,调节多种酶的作用过程。越来越多的证据表明,PRL-3参与卵巢癌、胃癌、乳腺等[16-17]多种肿瘤细胞的增殖、生长调节、转移和侵袭。PRL-3被证明是肿瘤复发与多种人类癌症患者预后的有用指标。PRL-3在肿瘤血管生成及肿瘤侵袭性肝癌中起着关键的作用[18],调节MMP-2、MMP-9和E-cadherin在肝癌中的功能。抑制PRL-3也降低IL-6诱导STAT3的磷酸化,从而调节机体自身的免疫状态。最近一些研究[19]表明,PRL-3能够控制多个信号通路,包括PI3K/Akt、Ras/MAPK和CSK/Src途径,是细胞周期和细胞迁移的关键。PRL-3的高表达加速肝癌细胞侵袭、转移,导致更差的预后。PRL-3也被证明在PI3K/Akt活性主要负调节蛋白表达水平增加,同时下调Akt的活化,降低磷酸酶和张力蛋白同源物。PRL-3能通过自分泌分泌肿瘤坏死因子-α和白细胞介素6,激活NF-κB信号通路,引起机体免疫系统的破坏和激发炎症反应[20]。PRL-3已成为肿瘤转移的重要标志物之一[21]。探索PRL-3作为药物分子靶标抑制肝癌细胞侵袭与转移已成为一种目前热门课题。虽然大多数的肿瘤可以从单一的肿瘤细胞进化克隆,但所有的恶性肿瘤是遗传不稳定,导致显著的生化异质性。虽然PRL-3是1个理想的分子靶点,其效用仍然不能令人满意,主要由于肿瘤治疗的特异性和敏感性鉴定缺乏。
3.4 本研究的意义和局限性
本研究发现本次实验最佳干预索拉非尼浓度为16 μmol/L,最佳干预时间为48 h。索拉非尼作用后肝癌细胞出现典型的核碎裂及细胞凋亡形态;MHCC97-H细胞经索拉非尼作用后PRL-3蛋白量下调,侵袭力受到明显抑制,索拉非尼对肝癌细胞的抑制作用表现出一定的时间和剂量效应关系。索拉非尼可作用于多靶点,可能通过下调PRL-3蛋白从而减少肝癌细胞的侵袭,并诱导其凋亡。PI3K/Akt、Ras/MAPK等是索拉非尼和PRL-3调控的共同通路,此通路的抑制以及肝癌细胞侵袭力的下降可能是下调PRL-3蛋白,其作用机制需要进一步的探索。
综上所述,PRL-3是肝转移的重要调节因子,索拉非尼可下调PRL-3蛋白的表达从而减少肝癌细胞的侵袭,本研究为实现索拉非尼的工艺改进和集多靶点为一体奠定理论基础。
