雷公藤红素通过调节脂质合成及氧化降低HepG2细胞甘油三酯水平的研究
2018-07-13冯泽民万星勇虞朝辉厉有名
冯泽民,万星勇,虞朝辉,厉有名
雷公藤红素是从雷公藤属植物根部中提取的一种五环三萜类化合物,具有多种生物学功能,其抗炎和抗氧化作用可以用来治疗自身免疫性疾病及神经退行性疾病[1]。近年来,雷公藤红素在脂质代谢中的作用受到了越来越多的关注。Ma等[2]发现雷公藤红素可以激活热休克因子1,后者通过激活过氧化物酶体激活受体γ共激活剂 -1α(peroxisome proliferator-activated receptor γ coactivator-1α, PGC1A)相关的代谢程序调控能量消耗,最终能治疗小鼠肥胖及胰岛素抵抗。Guan等[3]报道雷公藤红素可以通过激活AMPK-PGC1A通路,减轻糖尿病大鼠的骨骼肌氧化应激。雷公藤红素是否在非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)的发生发展中起作用尚未明确。本研究旨在通过软脂酸(palmitic acid,PA)诱导的NAFLD细胞模型,研究雷公藤红素是否能降低HepG2细胞内TG含量,从而进一步探究其参与NAFLD发生发展的具体机制。
1 材料与方法
1.1 细胞培养 HepG2细胞购于美国模式培养物集存库,用含10%胎牛血清的培养基培养于37 ℃、5% CO2培养箱中。
1.2 实验试剂 DMEM培养基及胎牛血清均购于美国Gibco公司;抗体甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH )、固醇调节因子结合蛋白(sterol-regulatory element-binding protein1c, SREBP-1c)以及脂肪酸合成酶(fatty acid synthase, FAS)购于美国CST公司;PA及雷公藤红素购于美国Sigma公司;细胞活性检测试剂盒CCK-8购自日本同仁化学研究所;TG测定试剂盒购自北京普利莱有限公司。
1.3 实验方法
1.3.1 HepG2细胞活度测定 将细胞悬液100 μl(约5000个细胞)接种至96孔板中,每个处理水平及对照均设置5个复孔,37 ℃、5% CO2培养24 h。吸尽96孔培养板中的培养基,PBS洗2遍。每孔加10 μl CCK-8试剂+90 μl DMEM培养基,空白对照加空白的CCK-8液。37 ℃、5% CO2培养箱放置1 h,450 nm波长下测定吸光度。细胞活度(%)=[A(加药)-A(空白)]/[A(0加药)-A(空白)]×100。
1.3.2 PA诱导NAFLD细胞模型的建立以及雷公藤红素处理 PA以25%胎牛血清白蛋白悬浮,超声震荡至无颗粒状悬浮后于37 ℃水浴过夜,0.22 μm滤头过滤后制备成20 mmol/L浓度储备液于-20 ℃冰箱保存。HepG2细胞按照2×105/孔的密度铺于6孔板,24 h后细胞密度约30%左右,按照PA200 μmol/L(储备液稀释100倍)以及指定浓度雷公藤红素更换培养基,细胞换液48 h后用于TG测定以及蛋白、RNA提取。
1.3.3 细胞内TG水平测定 采用TG测定试剂盒及分光光度仪,根据GPO Trinder酶学反应原理检测细胞内TG浓度。先将试剂盒中不同浓度TG标准品加入TG工作液,然后用分光光度仪检测550 nm处吸光值(OD550)并绘制TG浓度标准曲线。104~105个靶细胞中加入100 μl试剂盒中TG裂解液,冰浴10 min,取40 μl裂解液用于蛋白浓度测定,其余裂解液70 ℃水浴10 min,室温2000 r/min 离心5 min,取上清加入TG工作液后检测OD550值,根据标准曲线获得TG浓度。检测中采用样本蛋白含量校准TG含量。
1.3.4 蛋白电泳 用0.05% NaTDC-PBS溶解靶细胞,12 000 r/min 4 ℃离心15 min,取上清用蛋白定量试剂盒测定总蛋白浓度。等量蛋白样本电泳结束后转移至聚偏氟乙烯膜,以兔抗人或鼠SREBP-1c、FAS为一抗,HRP标记羊抗兔IgG为二抗。采用Western blot检测目的蛋白杂交条带,实验中设置GAPDH为内参。
1.3.5 定量即时聚合酶链锁反应 靶细胞用0.05%胰酶消化,常规离心及PBS洗涤后取细胞沉淀用RNA提取试剂盒提取总RNA,紫外分光光度法测定总RNA浓度。PGC1A引物序列:上 游 引 物 5´- TCTGAGTCTGTATGGAGTGACAT-3´,下 游 引 物 5´- CCAAGTCGTTCACATCTAGTTCA-3´;过氧化物酶体增殖物激活受体γ (peroxisome proliferator-activated receptor γ, PPARγ)引物序列:上游引 物 5´- GGGATCAGCTCCGTGGATCT-3´, 下 游 引 物5´- TGCACTTTGGTACTCTTGAAGTT-3´;GAPDH 引物序列:上游引物5´-GGAGCGAGATCCCTCCAAAAT-3´,下 游 引 物 5´-GGCTGTTGTCATACTTCTCATGG-3´。然后按反转录试剂盒(TaKaRa)和SYBR Premix Ex TaqTM荧光定量PCR试剂盒(TaKaRa)说明书操作并检测各靶基因mRNA,ΔΔCt模型定量分析结果,实验中采用GAPDH-mRNA为内参。
1.4 统计学处理 用 SPSS 17.0 统计软件对数据进行处理,计量资料呈正态分布,用±s表示,组间比较采用单因素方差分析,各处理组与对照组两两比较用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 雷公藤红素对HepG2细胞活度的影响 雷公藤红素在低浓度(<800 nmol/L)下对HepG2细胞活度无显著影响;在800 nmol/L以及1000 nmol/L浓度下细胞活度略有降低但仍>80%(88.00%,85.69%);在2000 nmol/L甚至更高时细胞活度显著降低(图1)。

图1 不同浓度雷公藤红素对HepG2细胞活度的影响F=190.900,P=0.000,n=5;*.与雷公藤红素0 nmol/L组比较,P均<0.05Figure 1 Different concentrations of celastrol effect on HepG2 cell viability
2.2 雷公藤红素对PA诱导的HepG2细胞TG水平的影响 根据雷公藤红素的细胞活度实验结果,选取5个不同浓度的雷公藤红素刺激HepG2细胞。PA(200 μmol/L)单独刺激组较正常对照组,HepG2细胞内TG水平显著升高[(69.32±1.79)μg/mg vs.(54.07±2.57)μg/mg]。同时加用雷公藤红素可显著降低细胞内TG水平,其中400 nmol/L组、600 nmol/L组、800 nmol/L组、1000 nmol/L组的TG 水平分别为(64.55±1.92)μg、(64.16±2.19)μg、(60.94±2.70)μg、(61.45±1.61)μg、较 PA 组差异有统计学意义(P均<0.05)(图2)。
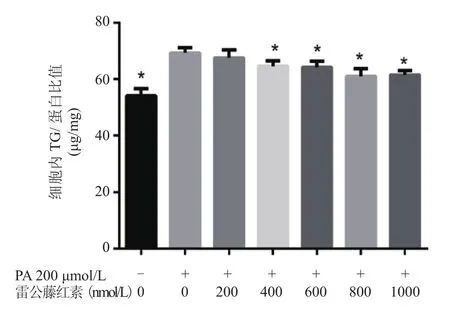
图2 不同浓度雷公藤红素对HepG2细胞TG水平的影响F=19.570,P=0.001,n=5;*.与雷公藤红素0 nmol/L组比较,P均<0.05Figure 2 Different concentrations of celastrol effect on triglyceride levels in HepG2 cells
2.3 雷公藤红素对HepG2细胞脂质合成相关蛋白SREBP1c及FAS表达的影响 在PA(200 μmol/L)单独刺激下,HepG2细胞的脂质合成相关蛋白SREBP1c及FAS的表达显著升高,而同时以雷公藤红素600 nmol/L以及1000 nmol/L浓度刺激可下调此2种蛋白表达(图3)。

图3 雷公藤红素降低HepG2细胞脂质合成蛋白SREBP1c以及FAS表达水平Cel.雷公藤红素Figure 3 Celastrol decreases the expression levels of lipid synthesis proteins, SREBP1c and FAS in HepG2 cells
2.4 雷公藤红素对HepG2细胞脂质氧化相关基因PGC1A及PPARγ表达的影响 PA(200 μmol/L)单独刺激下,HepG2细胞脂质氧化相关基因PGC1A及PPARγ表达均下调,但差异无统计学意义。同时以雷公藤红素刺激可升高此2种基因表达,其中PPARγ表达水平在600 nmol/L以及1000 nmol/L浓度下分别为1.11±0.09(相较正常对照组,下同)以及1.16±0.05,与PA组0.86±0.07相比,差异具有统计学意义(P均<0.05)(图4)。
3 讨 论
NAFLD是指除酒精和其他明确的肝损伤因素以外病因所致、以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征[4]。近年我国成人NAFLD患病率已约达到20%,且其发病率逐年升高[5]。NAFLD发生发展机制目前尚未完全明确,最为公认的发病机制为二次打击学说[6],其治疗也缺乏特别有效的方法。
目前认为,雷公藤红素减轻肥胖及糖尿病的关键分子PGC1A在NAFLD的发生发展中起重要作用。在小鼠肝脏,敲除或抑制PGC1A表达可导致肝细胞脂肪变性、肝脏炎症及慢性肝脏损伤[7-8]。PGC1A可以通过上调过氧化物酶激活受体 α(peroxisome proliferator-activated receptor α,PPARα)转录活性,并协同PPARα增强其下游线粒体脂肪酸β氧化相关基因肉碱棕榈酰基转换酶、极长链酰基辅酶A脱氢酶,长链酰基辅酶A脱氢酶及酰基辅酶A的表达,减轻肝脏脂肪变性[9]。Choi等[10]观察到雷公藤红素能有效抑制脂肪细胞3T3-L1的分化,进一步研究还发现,雷公藤红素对脂肪细胞脂质代谢的调节作用与其对PPARγ表达抑制相关。在高脂饮食诱导的NAFLD小鼠模型中,厄贝沙坦可以减轻小鼠肝细胞脂肪变性,而小鼠肝脏 PPARγ表达上调,提示增加PPARγ的表达可以减轻肝脏脂肪变性[11]。有研究指出雷公藤红素能抑制NF-κB通路及其下游促炎症因子IL-1β、TNF-α的释放,减轻糖尿病大鼠的肝脏炎性细胞浸润[12-13]。
在本研究中,PA诱导的NAFLD细胞模型中,雷公藤红素能显著降低细胞内TG含量,并呈现浓度依赖性。考虑到只用HepG2 1种肝细胞株不够有说服力,研究还选取了鼠源性肝细胞株AML作为研究对象,但雷公藤红素无法降低AML细胞内TG含量(文中未显示),提示雷公藤红素降低TG可能存在种属特异性。进一步的机制探究实验表明,该作用可能与雷公藤红素降低HepG2细胞脂质合成蛋白SREBP1c以及FAS表达水平以及上调脂质氧化相关基因PPARγ的表达水平有关。当然,更严谨的机制探索还须要借助于siRNA干扰靶分子及其抑制剂以及激动剂来进一步证明。同时,本研究后续还应纳入NAFLD动物模型实验来更全面论证雷公藤红素在治疗NAFLD中的作用,以期更好地解决这一全球性健康难题。

图4 雷公藤红素上调脂质氧化相关基因PGC1A及PPARγ的表达水平PGC1A 表达4组比较,F=2.738,P=0.113,n=3;PPARγ表达4组比较,F=7.326,P=0.011,n=3;*.与雷公藤红素0 nmol/L组比较,P均<0.05Figure 4 Celastrol increases the mRNA levels of lipid oxidation-related genes, PGC1A and PPARγ
