肝纤维化无创诊断研究进展
2018-07-13王晶晶陈国凤
王晶晶,纪 冬,陈国凤
全球估计超过5亿人患有肝脏疾病[1],肝病的进展通常会导致肝纤维化,肝纤维化最常见的病因是慢性乙型肝炎(chronic hepatitis B, CHB)、慢性丙型肝炎(chronic hepatitis C, CHC)、非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)、酒精性肝病和胆汁淤积性肝病,如未及时诊治,可逐渐发展为肝硬化并引起相关并发症。因此,在肝脏疾病的早期阶段进行准确可靠的诊断对肝病患者的治疗和预后至关重要。
目前肝穿刺活检仍作为评估肝纤维化程度的“金标准”,但由于肝组织的非均匀性,受取材部位、数量及大小的影响;病理医生诊断水平有差异;其成本高、有创伤性[2-6],导致肝穿刺活检并非肝脏疾病诊断的绝对完美方案。
近年来,无创肝纤维化诊断技术发展迅速,虽然不能像肝穿刺活检一样对肝纤维化进行精确分期,但因其无创、简便、经济等优势更容易应用于临床。目前正在研发的肝纤维化无创诊断方法包括血清生物标志物检测和物理成像相关技术。常见的血清生物标志物有FIB-4指数(f i brosis index based on 4 factors, FIB-4)、天门冬氨酸氨基转移酶/血小板比率指数(aspartate aminotransferaseto-platelet ratio index, APRI)、增强肝纤维化测试(enhanced liver fibrosis test, ELF)、NAFLD纤维化评分(NAFLD fi brosis score, NFS)、FibroMeter、FibroTest和HepaScore等。物理成像技术有瞬时弹性成像(transient elastography, TE)技术、声辐射力脉冲成像(acoustic radiation force impulse imaging, ARFI)技术、剪切波弹性成像(shear wave elastography, SWE)技术、磁共振弹性成像(magnetic resonance elastography, MRE)技术和磁共振波谱(magnetic resonance spectroscopy,MRS)分析技术。
1 非酒精性脂肪性肝炎
NAFLD是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝损伤,以弥漫性肝细胞大泡性脂肪变为主要特征的一组临床病理综合征,其疾病谱包括单纯性脂肪肝、非酒精性脂肪性肝炎、肝纤维化和肝硬化[7-9]。NAFLD是慢性肝病最常见的原因,世界上约25.24%的成年人患有该病[10]。由于肥胖、2型糖尿病及代谢综合征在全球的流行,NAFLD的发病率和病死率不断增加,预计在未来几年将成为肝移植的主要病因[11-12]。因此,在临床实践和研究中,开发准确、安全和易操作的无创诊断模型对精确诊断和监测NAFLD患者的肝纤维化程度有着重大的意义。
常用的血清学指标可以预测NALFD的纤维化程度,如血清转氨酶,当AST/ALT比值>1时可预测出患者的肝纤维化程度较重[13]。另外,传统的肝纤维化指标透明质酸、IV型胶原均显示出与晚期肝纤维化的良好相关性,但须进一步的研究来进行验证[14]。最新研究发现生长分化因子15与NAFLD肝纤维严重程度有明显相关性,提示其可作为诊断NAFLD晚期纤维化的一种新的生物标志物[15]。
除了生物标志物之外,目前还有很多预测NAFLD患者晚期肝纤维化的无创模型(见表1)。2000年出现的BAAT模型,其特异度可高达100%,但敏感度太低,仅为14%[16];2004年始于欧洲的肝纤维化评分系统(original european liver fibrosis test, OELF),其特异度、敏感度均较高,但计算公式复杂,临床可操作性欠佳[17];2006年FibroTest[18]和2007年NFS[19]的特异度、敏感度均较可,且已被临床验证;2008年的BARD评分系统在排除晚期肝纤维化方面显示出很强的准确性,但是确诊疾病的准确性较低[20];2009年出现的FibroMeter最初用于诊断HCV患者肝纤维化分期,但其在NAFLD中的使用也显示出其良好的准确性[21];2010年出现ELF[22],在OELF基础上去除了年龄,进行了修改简化,使计算更方便,且诊断性能仍较高;同时期出现的FIB-4可以预测中晚期肝纤维化,早期已在病毒性肝炎模型中得到验证,同样适用于NAFLD[23];2017年的一项荟萃分析结果显示NFS和FIB-4检测晚期肝纤维化的诊断性能最佳,显著高于APRI及BARD系统的评分,而MRE和SWE的诊断准确性则最好[24]。
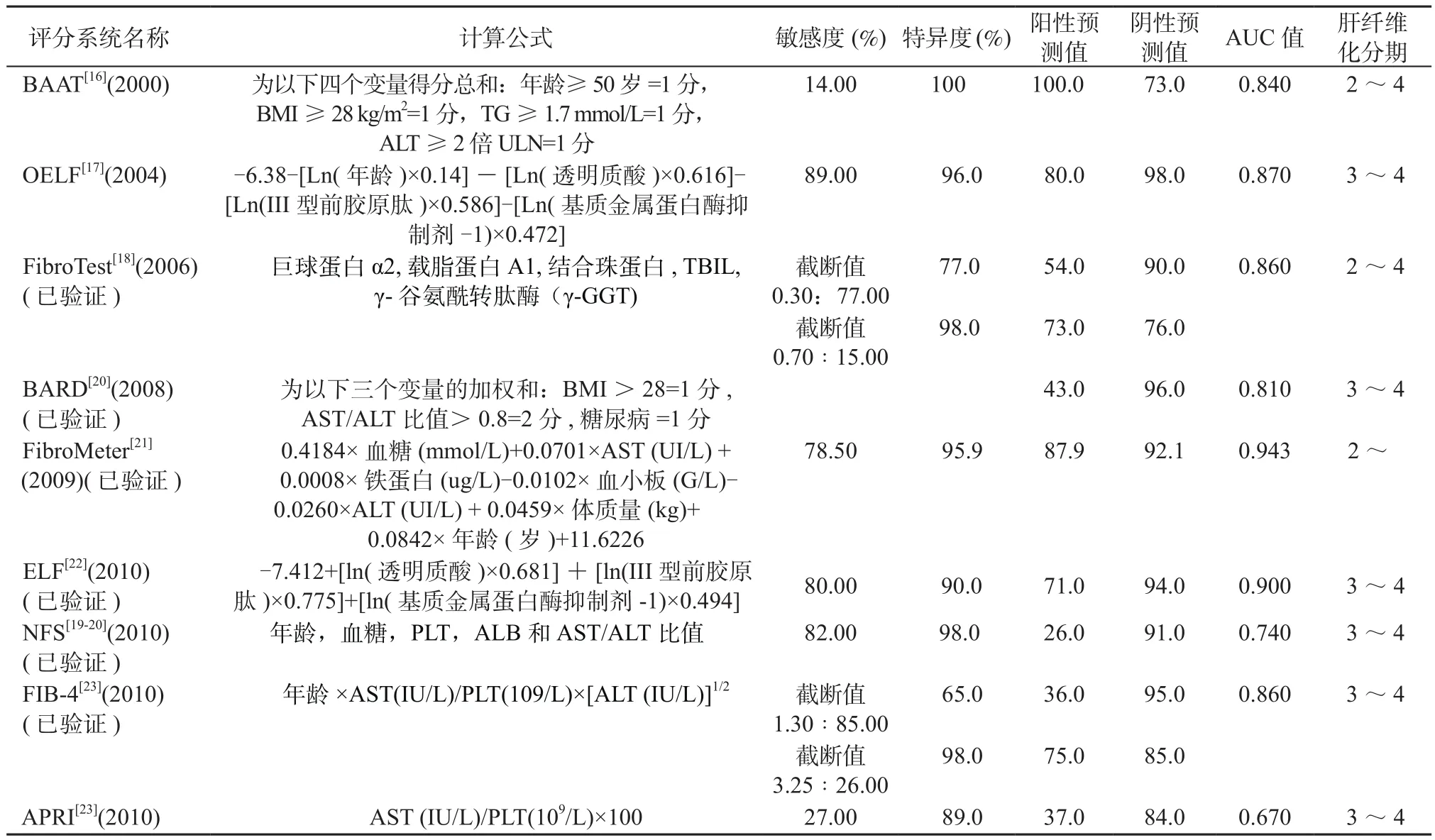
表1 常用的预测NAFLD纤维化的无创模型Table 1 Common non-invasive models for predicting NAFLD fibrosis
在物理成像技术方面,TE在鉴别NAFLD患者肝纤维化方面的有效性已被广泛证实。2016年一项荟萃分析评估TE用于诊断NAFLD纤维化的结果显示,随着纤维化程度的增加,其敏感度和特异度也相应提高[25]。同年还有一项研究比较了9种纤维化评分系统(BARD,NFS,FibroMeterNAFLD,APRI,FIB-4,FibroTest,Hepascore,FibroMeterV2G和LSM),确定TE为无创性诊断NAFLD患者肝纤维化的最准确的方法[26]。但是,TE在NAFLD无创诊断上也有其局限性,由于脂肪的影响,LSM可能高估了NAFLD患者的纤维化程度,同时亦有研究证实受控衰减参数值的增加可导致TE高估纤维化程度[27]。另外通过将FibroScan的M探头改进为XL探头可提高诊断的准确性[28]。
目前磁共振技术已取得重大进展,MRI和MRE是检测肝纤维化的高精度诊断工具,且MRE在检测晚期肝纤维化和肝硬化方面明显优于多种血清标志物, AUC分别为0.97 vs.(0.53~0.80)和0.98 vs.(0.58~0.80),并且在诊断肝硬化方面优于常规 MRI(AUC:0.98 vs.0.78)[29]。除此之外,2D-MRE可准确检测经活检证实的NAFLD患者的晚期肝纤维化和肝硬化程度,比ARFI技术具有更高的诊断准确性[30-31],且显著优于TE和肝脏弹性测量技术[32-33]。最新首个关于3D-MRE的前瞻性研究结果显示,在诊断进展期肝纤维化方面3D-MRE明显优于2D-MRE[34]。目前MRE评估肝纤维化大多数在NAFLD模型中进行,该方法虽较其他方法更准确,然而MRE在诊断肝纤维化方面仍有其局限性:①多数研究均属于单中心研究,仍需要多中心研究验证。②多数属于横断面研究,须要评估肝纤维化变化方面的纵向研究的证据。③虽然MRE的成本低于肝穿刺活检,但费用仍较昂贵。④被广泛接受用于评估肝纤维化的2D-MRE在临床上具有相对较高的失败率,特别是在铁超负荷患者中,所以仍须要在不同病因患者的大样本研究中评价和验证该技术。
近年来关于肠道微生物的热点研究在肝病无创诊断中也取得很大进展,研究显示粪便微生物有望应用于早期脂肪肝、肝纤维化及肝硬化的检测[35-36]。当然无创诊断也存在其诊断局限性,在患有糖尿病的NAFLD人群中,无创评分系统预测肝硬化和肝脏相关结局方面准确性较低[37]。
2 慢性乙型肝炎
既往常用的血清标志物FIB-4和APRI评分系统大多数均是在HCV模型中得到验证,不适用于根据Ishak分期评估CHB肝纤维化,特别是在评估治疗后肝纤维化的改善方面[38],因此在HBV模型中须要更进一步的完善与验证。2018年的一项单中心回顾性研究比较了17种无创诊断模型的准确性,结果显示鉴别显著乙型肝炎(乙肝)纤维化最好的3种模型分别是King's score(AUC=0.756),Virahep-C model(AUC=0.756)和GPR(AUC=0.744);区分乙肝肝硬化最好的3种模型分别是Lok index(AUC=0.832),FI(AUC=0.820)和FIB-4(AUC=0.818),在诊断肝纤维化和肝硬化方面,Virahep-C和GPR模型都有很高的准确性,且GPR明显优于APRI和FIB-4[39]。另有研究证实FIB-4、AST/ALT指数、APRI和年龄-血小板指数等常见的无创模型对进展期肝纤维化的诊断性能较差[40]。除此之外,评估还应考虑到HBeAg血清状态,与HBeAg-阴性患者相比,这些模型更适合HBeAg阳性患者。
大多数无创诊断模型仅在排除晚期肝纤维化或肝硬化时具有良好的准确性。最新的研究显示FibroStage[41]、高尔基体蛋白73联合肝硬度检测[42]均是针对中晚期肝纤维化的诊断效果较好,而不适用于肝纤维化的早期阶段。因此,对CHB患者而言,迫切须要寻找可以准确预示轻度至中度肝纤维化的无创血清生物标志物。一项验证性研究显示定量纤维胶原参数可以提高对CHB患者轻、中度肝纤维化纵向评估的有效性和准确性[43]。除此之外,一种基于抗-HBc定量、血小板和白蛋白与球蛋白比值的新型评分系统PACG[44],在预测中度至重度肝纤维化方面的性能良好,优于ARPI,FIB-4及LSM。而对于存在腹水、肋间隙过窄的患者,2D-SWE可能是更优的选择[45]。另外,对于合并肝脂肪变的CHB患者,APRI的肝纤维化诊断效能较差,而LSM、FIB-4、Forns指数诊断效能较好,其中轻度肝脂肪变可能影响Forns指数诊断CHB患者肝纤维化的效能[46]。
近年来许多研究人员将研究重点放在血液中的微小RNA(microRNA, miRNA)上。据报道,肝细胞miRNA-122与HBV复制以及肝纤维化有关,近期一项研究结果显示较低的血清miRNA-122水平是HBV患者晚期肝纤维化的有用预测指标,同时血清紫花苜蓿凝集素阳性Mac-2结合蛋白可以用于预测HBV患者的肝纤维化,这些标志物的组合可以更准确的评估HBV患者的肝纤维化程度[47]。
3 慢性丙型肝炎
随着直接抗病毒药物时代的到来,CHC进入治愈时代[48]。与NAFLD和CHB相比,近两年来丙型肝炎(丙肝)肝纤维化无创诊断方面的研究热度明显下降。在丙肝肝纤维化的无创诊断模型中,既往常用的血清标志物FIB-4与TE、ARFI诊断性能具有显著一致性,且明显高于APRI。2017年一项单中心回顾性研究分析显示,新VAP评分系统可以预测不同阶段的肝纤维化,特别是对轻度至中度纤维化患者具有较高的诊断性能,且易于计算[49],但其在临床实践中的有效性仍须要进一步的多中心、前瞻性研究加以证实。FIB-5评分在区分非显著性和显著性肝纤维化方面优于FIB-4指数[50]。血管生成指数与其他五项评分系统(King,Gotebörg University Cirrhosis Index, Lok, FIB-4 和AST/ALT指数)相比,具有较高的诊断性能[51]。血清标志物自分泌运动因子,被认为是与肝损伤有关的一种分泌酶,2017年的一项研究首次提出了性别因素在对HCV患者应用血清标志物预测肝纤维化过程中的影响[52]。肝纤维化受患者基因组学影响,其中一个因素就是miRNA,将miRNA与基线预测因子相结合可作为预测分期HCV相关肝纤维化的新型无创算法,但需要更多的研究来证实这一模型的效能,并测试其在其他病因肝纤维化中的意义[53]。另外血小板/淋巴细胞比值也可用于预测CHC患者是否存在显著肝纤维化[54]。
4 酒精性肝病
酒精是引起肝硬化和肝脏相关死亡的主要原因之一。目前TE所测量的肝硬度值可以很好地评估酒精性肝纤维化和肝硬化程度[55-56],但该方法成本较昂贵,在医疗资源有限的地区实施困难,相比之下廉价、方便、简单易获得的血清生物标志物更受欢迎,然而,既往对于酒精性肝病的无创诊断研究甚少,尚未形成一个用于鉴别和诊断酒精性肝病的验证体系。随着无创检测技术的发展,近几年来新发现的一些血清标志物,例如人类软骨糖蛋白、高尔基体蛋白和血清多花紫藤凝集素阳性巨噬细胞结合蛋白等都可适用于酒精性肝纤维化的诊断[57]。
最新一项前瞻性研究比较了ELF,FibroTest,肝硬度测量和6种间接标记测试在检测晚期肝纤维化方面的准确性,结果显示ELF和FibroTest在诊断酒精性肝病患者晚期肝纤维化方面的准确性较高(AUC≥0.90,以活检为参考),当ELF值<10.5或FibroTest值<0.58,可以排除患者患有进展性肝纤维化的可能,而TE联合血清学指标并没有提高诊断的准确性[58]。
5 总 结
现在已进入慢性肝病无创诊断的黄金时代。研究者们通过把“血清学”与“物理学”等指标有效整合建立无创诊断模型,大大减少了肝穿刺活检的临床应用。虽然现阶段肝脏无创检测尚不能完全取代肝活检,但其仍在多种肝脏疾病诊断中扮演着非常重要的角色。我们须要更进一步增加慢性肝病无创检测的诊断准确性和诊断范围,这将是肝病诊断的发展趋势。
